PTIP相关蛋白1在小鼠睾丸发育过程中的表达及定位
2018-04-03曹碗君赵洁乔慧莲马斌芳李臻
曹碗君,赵洁,乔慧莲,马斌芳,李臻
(第四军医大学基础部组织学与胚胎学教研室,西安 710032)
组蛋白甲基化是指发生在H3和H4组蛋白N端赖氨酸(lysine) (K)或者精氨酸残基上的甲基化,其中H3K4的甲基化与基因的激活相关,由组蛋白甲基转移酶介导催化。人类组蛋白H3K4甲基转移酶由以下3对复合物组成:SETd1A/SETd1B、MLL1/2和MLL3/4[1]。PTIP相关蛋白1(PTIP associated protein 1,PA1)首次由Young-Wook Cho等在研究MLL3/4复合体功能时发现,因为和Pax转录激活结构域相互作用蛋白(Pax transactivation-domain interacting protein,PTIP)关系密切,同为MLL3/4复合体内重要组成部分而得名;他们通过免疫共沉淀实验证实,PTIP和PA1只存在于MLL3/4复合体中[2]。人类PA1蛋白包含254个氨基酸,而小鼠PA1则由253个氨基酸序列构成,两者在氨基酸水平有87%序列一致。Jing Liang等采取Northern blot方法,对人心脏、脑、胎盘、肺、骨骼肌、肝脏和胰腺等器官进行了检测,发现这些器官中均存在PA1,说明PA1广泛表达在人体的各个器官[3]。然而,PA1在雄性生殖系统中的表达及其功能尚无报道。本文采用PCR、免疫组织化学染色以及荧光双标技术,检测PA1在小鼠睾丸发育过程中的表达及定位,为以后进一步深入探究其在雄性生殖系统中的功能及作用机制打下基础。
材料与方法
1 组织材料
SPF级C57小鼠,出生后 1w、2w、4w、8w、12w、18w及24w各4只,购自第四军医大学实验动物中心。2%苯戊巴比妥以45 mg/kg体重腹腔麻醉,取左侧睾丸用于提取RNA进行PCR分析,右侧睾丸取出后立即置于4%多聚甲醛中固定24h,石蜡包埋,切片(5μm)用于免疫组织化学染色。
2 主要试剂
RNA提取液Trizol plus,反转录试剂盒Prime ScriptTMRT reagent Kit, Premix Taq以及SYBR Primix Ex Taq均购自日本Takara公司。柠檬酸盐抗原修复液购自西安科昊生物有限公司。兔抗小鼠PA1多克隆抗体(NBP1 89792)购自美国NOVUS公司,生物素标记的抗兔IgG、 SABC检测试剂盒(SP-9000)购自北京中杉金桥生物技术有限公司。小鼠抗小鼠Sox-9单克隆抗体(SC-166505)购自美国Santa Cruz公司,小鼠抗小鼠AMHR2单克隆抗体(ab-64762)购自Abcam公司,Alexa Fluor 594标记抗兔IgG,Alexa Fluor 488标记抗小鼠IgG均购自美国Molecular Probe公司。
3 RT-PCR
新鲜睾丸组织100mg,剪碎研磨用Trizol法提取总RNA,在20μL 体系中加入1μg RNA,用反转录试剂盒,以37℃ 15min、 85℃ 5s反应条件合成cDNA第一链,以新合成的cDNA为模板进PCR,扩增PA1基因,PA1上游引物为:5’-TGG CCC AAA CCT AAA CAT TAG-3’;下游引物为:5’-TTA TGG CGC TTC ATG TCT GAG-3’,预计产物大小为200bp,25μL的反应体系,反应条件为:94℃ 30s,55℃ 30s,72℃60s,30个循环,最后72℃延伸10min。为了检测各RNA样品完整性和反转录效率之间的差别,将待测样品中的β-actin基因设为内参照。PCR产物用2%琼脂糖凝胶电泳检测。
4 实时定量PCR
以cDNA为模板用SYBR Premix Ex Taq 进行实时荧光定量分析,反应条件为95℃ 30s;95℃ 30s,60℃ 30s,40个循环。具体操作均按Takara说明书进行。每次扩增均设目的基因组和内参基因组及空白对照组,通过对每个反应管内荧光信号到达设定的阈值所经历的循环数(即CT值),按指数扩增的规律计算出组织中PA1 mRNA的相对表达量。
5 ABC法免疫组织化学染色
切片常规脱蜡至水后柠檬酸盐缓冲液(pH 6.0)微波修复(100°C 10min),0.3%甲醇-H2O2中室温1h,封闭内源性过氧化物酶;加一抗(兔抗PA1,1:200)4℃孵育过夜,生物素标记二抗(抗兔IgG,1:400)室温孵育3h,ABC复合物(1:400)室温孵育1h, 镜下掌握DAB 呈色,随后脱水、透明、封片。用PBS代替一抗作为阴性对照。
6 免疫荧光双标染色
切片常规脱蜡至水后柠檬酸盐缓冲液(pH 6.0)微波修复(100℃ 10min),1%BSA封闭1h;兔抗PA1(1:200)与小鼠抗Sox-9(1:400)混合一抗,4℃孵育过夜,Alexa Fluor594标记抗兔IgG(1:400)与Alexa Fluor488标记抗小鼠IgG(1:400)混合二抗室温孵育3h,50%甘油封片。用一抗稀释液代替一抗作为阴性对照。
结 果
1 PA1 mRNA在小鼠睾丸各个发育阶段的表达
对各周龄小鼠睾丸提取的mRNA进行RT-PCR分析,结果显示在小鼠睾丸发育不同阶段均有PA1 mRNA的表达,且条带大小与设计方案一致(图1)。PA1 mRNA在1w小鼠睾丸中的表达水平较高,在2w时达到高峰,随后(4w)逐渐降低,待8w后维持在稳定水平(图2)。
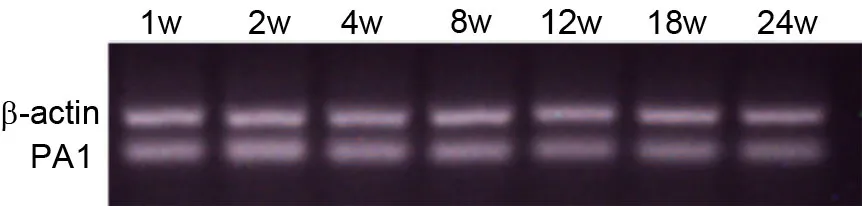
图1 PA1 mRNA在小鼠睾丸各个发育阶段表达的RT-PCR检测Fig. 1 RT-PCR detection for PA1 mRNA expression in various developmental stages of mouse testis

图2 PA1 mRNA在小鼠睾丸不同发育阶段表达变化的实时定量PCR检测Fig. 2 Quantitative analysis of PA1 mRNA expression during mouse testis development measured by qRT- PCR
2 PA1蛋白在不同发育阶段小鼠睾丸组织中的定位
为进一步了解PA1在不同发育阶段小鼠睾丸组织中的定位,我们利用免疫组织化学法染色观察了PA1在不同周龄小鼠睾丸的表达。PA1在1w、2w、4w、8w小鼠生精小管中的精原细胞和支持细胞以及间质细胞中均有表达,主要表达于细胞核中。在4w和8w小鼠睾丸组织内,除了精原细胞、支持细胞以及间质细胞外,PA1还表达于初级精母细胞、圆形精子细胞的胞核,此外在精子头部也有表达(图2)。免疫荧光双标检测显示,红色荧光信号标记的PA1与绿色荧光信号标记的支持细胞标志物 Sox-9以及间质细胞标志物AMHR2共存,进一步证实PA1在支持细胞和间质细胞中有表达(图4)。
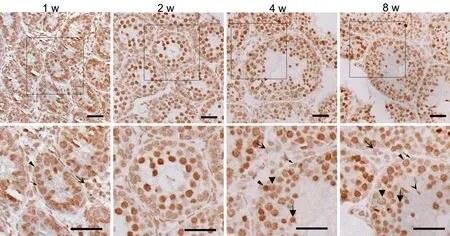
图3 小鼠不同发育阶段睾丸组织PA1表达的免疫组织化学染色。:间质细胞;:支持细胞;:精原细胞;:初级精母细胞;:圆形精子细胞;精子;比例尺:50 μmFig. 3 Immunohistochemical detection of PA1 expression in various developmental stages of mouse testes.: Leydig cell;: Sertoli cell;: spermatogonia;: primary spermatocyte.: round spermatid;: sperm; scale bar: 50 μm

图4 PA1在8w小鼠睾丸间质细胞和支持细胞中表达免疫荧光双标检测。比例尺:20 μmFig. 4 Double immuno fl uorescence staining detection of PA1 expression (red) in Sertoli cells (top, cell marker Sox-9 in green) and Leydig cells (bottom,cell marker AMHR2 in green) in 8w mouse testis. Scale bar, 20 μm
讨 论
哺乳动物生精细胞的分化是一个复杂的过程,从精原细胞开始分化到精子的形成涉及许多复杂的分子机制,其中包括DNA损伤、修复及重组,组蛋白的甲基化、磷酸化修饰以及染色质的浓缩[4]。研究发现,PTIP敲除小鼠由于组蛋白H3K4甲基转移酶活性减弱,小鼠睾丸发生萎缩,各级生精细胞发育停滞[5],提示H3K4甲基化与生精细胞的生长分化有关。PA1和PTIP同为MLL3/4复合体的核心组件,同时PA1也被认为参与完成组蛋白H3K4甲基转移功能[2],因此我们对PA1在睾丸发育中的表达及定位进行研究,为进一步探究其在生精细胞生长分化中的功能及作用打下基础。
小鼠出生2w后睾丸中精原细胞开始分化,此时小鼠体内的雄激素分泌水平亦达到高峰,5w时睾丸开始产生成熟精子,8w时达到性成熟[6]。我们通过RT-PCR和定量PCR检测到PA1 mRNA在小鼠睾丸各个发育阶段均有表达,在2w时表达最高,随后降低,8w后维持在一个稳定水平,表明PA1可能通过调节雄激素的分泌,参与生精细胞的生长和分化。已知睾丸间质细胞是产生雄激素的场所,免疫组织化学染色显示PA1在小鼠各个发育阶段的间质细胞中均有表达,进一步说明PA1参与调节间质细胞分泌雄激素。
间质细胞分泌雄激素还受支持细胞的调节,本研究发现PA1在睾丸各个发育阶段支持细胞中均有表达。支持细胞可通过雄激素受体(androgen receptor, AR)影响自身内部的抗苗勒管激素(anti-Müllerian hormone, AMH)分泌,从而间接调节间质细胞分泌雄激素[7],而PA1可以竞争性抑制AR的转录活性[8]。因此我们推测PA1在支持细胞中可能通过竞争性抑制AR的转录活性间接调节间质细胞分泌雄激素,从而维持生精小管内外雄激素的平衡,保证生精细胞的正常分化。另有研究发现,支持细胞可通过分泌骨形成蛋白-2(bone morphogenetic protein 2, BMP2)对精原细胞的分化进行调控[10],Rossella Puslisi等人在体外培养的小鼠睾丸碎片中添加BMP2后发现精原细胞增殖能力显著提高,表明BMP2对精原细胞的增殖有积极作用[11];此外在PA1敲除的胚胎中BMP2的表达显著降低[9]。这些研究说明PA1可能作为上游分子参与BMP2对生精细胞的增殖分化的调控。因此我们推测PA1在支持细胞中的表达还可能通过调节BMP2的分泌,从而间接影响精原细胞的分化。
我们通过免疫组织化学染色观察到PA1在小鼠睾丸各个发育阶段生精细胞均有表达,提示PA1作为MLL3/4复合体的构成元件参与调节组蛋白H3K4甲基化,从而调节精原细胞向精子分化。睾丸中生精细胞对电离辐射刺激相当敏感[12],5Gy的γ射线全身照射后3天,小鼠生精细胞死亡殆尽[13]。电离辐射可导致细胞DNA损伤,Gong等人发现293T细胞中PA1的缺失会导致细胞对电离辐射敏感性增强,表明PA1在调节细胞DNA损伤后的修复中亦发挥着重要作用[14]。因此PA1在睾丸中的表达可能还参与细胞DNA的损伤修复。同时,Takeshita等的研究发现PA1表达升高的乳腺癌患者预后较好,表明PA1还可能和肿瘤的预后相关[15]。然而PA1和生殖系统肿瘤的关系还有待进一步研究。
综上所述, PA1在睾丸各个发育阶段的广泛表达提示PA1可能通过调节间质细胞分泌雄激素,在支持细胞作用下维持生精小管中雄激素的平衡,另外通过BMP2调节生精细胞的生殖和分化,具体机制还有待进一步研究。
[1] Mohan M, Herz HM, Smith ER, et al. The COMPASS family of H3K4 methylases in Drosophila. Mol Cell Biol, 2011,31(21): 4310-4318.
[2] Cho YW, Hong T, Hong S, et al. PTIP associates with MLL3-and MLL4-containing histone h3 lysine 4 methyltransferase complex. J Biol Chem, 2007, 282(28): 20395-20406.
[3] Liang J, Zhang H, Zhang Y, et al. GAS, a new glutamate-rich protein, interacts differentially with SRCs and is involved in oestrogen receptor function. Embo Rep, 2009, 10(1): 51-57.
[4] Sasaki H, Matsui Y. Epigenetic events in mammalian germcell development: Reprogramming and beyond. Nat Rev Genet, 2008, 9(2): 129-140.
[5] Schwab KR, Smith GD, Dressler GR. Arrested spermatogenesis and evidence for DNA damage in PTIP mutant testes. Dev Biol, 2013, 373(1): 64-71.
[6] Hai Y, Hou J, Liu Y, et al. The roles and regulation of Sertoli cells in fate determinations of spermatogonial stem cells and spermatogenesis. Semin Cell Dev Biol, 2014, 29: 66-75.
[7] Chang C, Chen YT, Yeh SD, et al. Infertility with defective spermatogenesis and hypotestosteronemia in male mice lacking the androgen receptor in Sertoli cells. Proc Natl Acad Sci USA, 2004, 101(18): 6876-6881.
[8] Zhang Z, Sun Y, Cho YW, et al. PA1 protein, a new competitive decelerator acting at more than one step to impede glucocorticoid receptor-mediated transactivation. J Biol Chem,2013, 288(1): 42-58.
[9] Kumar A, Lualdi M, Loncarek J, et al. Loss of function of mouse Pax-Interacting Protein 1-associated glutamate rich protein 1a (Pagr1a) leads to reduced Bmp2 expression and defects in chorion and amnion development. Dev Dynam,2014, 243(7): 937-947.
[10] Puglisi R, Montanari M, Chiarella P, et al. Regulatory role of BMP2 and BMP7 in spermatogonia and Sertoli cell proliferation in the immature mouse. Eur J Endocrinol, 2004,151(4): 511-520.
[11] Itman C, Wong C, Whiley PAF, et al. TGFβ superfamily signalling regulators are differentially expressed in the developing and adult mouse testis. Spermatogenesis, 2011,1(1): 63-72.
[12] Hou W, Zhao J, Li Z, et al. Effects of electromagnetic pulse irradiation on the mouse blood-testicle barrier. Urology,2012, 80(1): 221-225.
[13] Khan S, Adhikari JS, Rizvi MA, et al. Radioprotective potential of melatonin against ⁶⁰Co γ-ray-induced testicular injury in male C57BL/6 mice. J Biomed Sci, 2015, 22: 61.
[14] Gong Z, Cho YW, Kim JE, et al. Accumulation of pax2 transactivation domain interaction protein (PTIP) at sites of DNA breaks via RNF8-dependent pathway is required for cell survival after DNA damage. J Biol Chem, 2009,284(11): 7284-7293.
[15] Takeshita T, Yamamoto-Ibusuki M, Yamamoto Y, et al. PTIP Associated protein 1, PA1, is an independent prognostic factor for lymph node negative breast cancer. PLoS One, 2013,8(11): e80552.
