小鼠乳腺增生组织中BMP信号通路的改变*
2018-04-02郭东辉郑洪新
孙 丽,郭东辉,刘 飞,蒋 宁,郑洪新
(辽宁中医药大学基础医学院,辽宁 沈阳 110847)
乳腺增生症是育龄期女性的常见病、多发病,其发病率在所有乳腺疾病中居于首位,同时也增加了乳腺癌的患病风险[1-3]。体内激素水平失衡及乳腺组织内激素受体表达的异常是乳腺增生发生的主要原因[3],但目前对乳腺增生的分子特征仍知之甚少。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是一类分泌性分子,属于转化生长因子β(transforming growth factor β,TGFβ)超家族的成员之一。目前已知有20多个BMPs,它们与细胞膜上丝氨酸/苏氨酸激酶受体(如 BMPR1和BMPR2)结合,磷酸化Smad1/5/9,引起一系列的级联反应,激活下游靶基因的表达[4]。而BMPs与其受体的结合主要受到分泌性拮抗剂[如Noggin、Chordin (Chrd)、Chordin-like 1 (Chrdl 1)、Chordin-like 2(Chrdl 2)和Twsg1等]的调控[4]。BMP信号通路作为参与乳腺发生、发育和癌变的主要信号通路[5-6],其在乳腺增生中的表达和激活情况仍然未知。因此,明确BMP信号通路在乳腺增生组织中的表达和激活情况,可能为治疗乳腺增生提供新的思路,对降低乳腺癌的风险具有重要意义。
因此,本研究以小鼠为研究对象,联合使用戊酸雌二醇和黄体酮诱导小鼠乳腺增生,通过real-time PCR检测BMP信号通路的配体、受体、拮抗剂在乳腺增生组织中的表达,并用Western blot鉴定该通路的激活,从BMP信号通路的角度阐释乳腺增生的分子特征和发病机制。
材 料 和 方 法
1 主要试剂
戊酸雌二醇片(Bayer HealthCare);黄体酮注射液(浙江仙居制药股份有限公司);洋红(carmine;购自Sigma);柱式动物组织总RNA抽提纯化试剂盒(生工生物);反转录试剂盒ProtoScript® II First Strand cDNA Synthesis Kit (New England Biolabs);荧光定量PCR试剂盒Brilliant II SYBR Green QPCR Master Mix (Angilent);抗p-Smad1/5/9抗体(Cell Signaling Technology);抗Smad1/5/9抗体(Immunoway);抗β-actin抗体(恩晶生物)。
2 主要方法
2.1动物分组与给药30只SPF级7周龄雌性未孕C57BL/C小鼠购自北京维通利华实验动物技术有限公司,合格证号为11400700088478。动物饲养于辽宁中医药大学实验动物中心,12 h光循环,室温22~25 ℃,空气相对湿度40%~60%。小鼠适应性饲养1周后,按体重随机分为对照(control)组和激素(hormone)组,每组15只。激素组每天给予戊酸雌二醇混悬液2.5 mg/kg灌胃,连续给药25 d;再连续5 d,每天腹腔注射4 mg/kg的黄体酮;对照组给以相应体积的PBS。给药结束后,颈椎脱臼处死动物,收集乳腺进行检测。
2.2乳腺整体染色取小鼠第4对乳腺,在载玻片上展开晾干,Carnoy’s固定液固定过夜,50%乙醇浸泡30 min,蒸馏水浸泡30 min,洋红染液染色24 h,水洗、乙醇梯度脱水,二甲苯中浸泡2 d,树胶封片,数码相机(Canon)拍照。
2.3Real-time PCR称取乳腺组织50 mg,按照试剂盒说明书提取总RNA。取1 μg的总RNA反转录成cDNA。将反转录后得到的cDNA稀释5倍后用于real-time PCR检测。PCR反应条件94 ℃ 5 min;94 ℃ 15 s、59 ℃ 15 s、72 ℃ 30 s,40个循环;用2-△△Ct法计算并分析mRNA的相对表达量。PCR引物见表1。

表1 Real-time PCR引物序列Table 1.Primer sequences for real-time PCR
F:forward; R:reverse.
2.4Western blot称取乳腺组织50 mg,液氮研磨成粉,加入到300 μL蛋白裂解液中,4 ℃裂解15 min,离心取上清,BCA法测定蛋白浓度。每样取50 μg总蛋白,常规法进行SDS-PAGE(分离胶浓度10%)。电泳后转膜,5% BSA封闭,加 I 抗,4 ℃孵育过夜,加HRP标记的 II 抗,ECL显色。用ImageJ软件分析各条带灰度。
3 统计学处理
用SPSS 17.0软件进行数据处理和统计分析。实验数据采用均数±标准差(mean±SD)表示,组间差异采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 激素处理后小鼠乳腺形态的变化
洋红染色结果可见,与对照组相比,激素组小鼠乳腺组织密度明显增加,导管分支和末端乳芽的数量增多,乳腺呈现增生状态,说明联合使用戊酸雌二醇和黄体酮能成功诱导小鼠乳腺增生,见图1。
2 BMP信号分子在乳腺增生组织中的mRNA表达水平
运用real-time PCR的方法,检测了BMP信号通路配体、受体和拮抗剂在乳腺增生组织中的表达,首先检测了BMP信号通路配体BMP2、3、4、5、6、7、9、12、13和14的表达。结果发现,与对照组相比,BMP2、4、6、7和14 的mRNA表达水平升高(P<0.05),BMP5、9、13的mRNA的表达水平下调(P<0.05),BMP3和BMP12的mRNA的表达水平无明显变化,见图2。
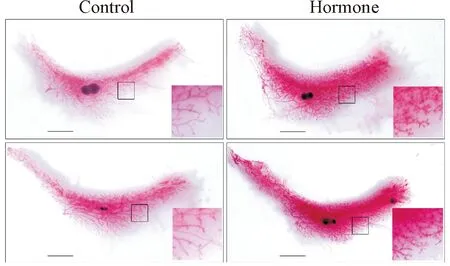
Figure 1.Whole-mount staining of mammary glands.The square areas are enlarged in the right bottom corners to demonstrate the terminal duct branches and terminal end buds.The scale bar=1 cm.
图1乳腺整体染色结果
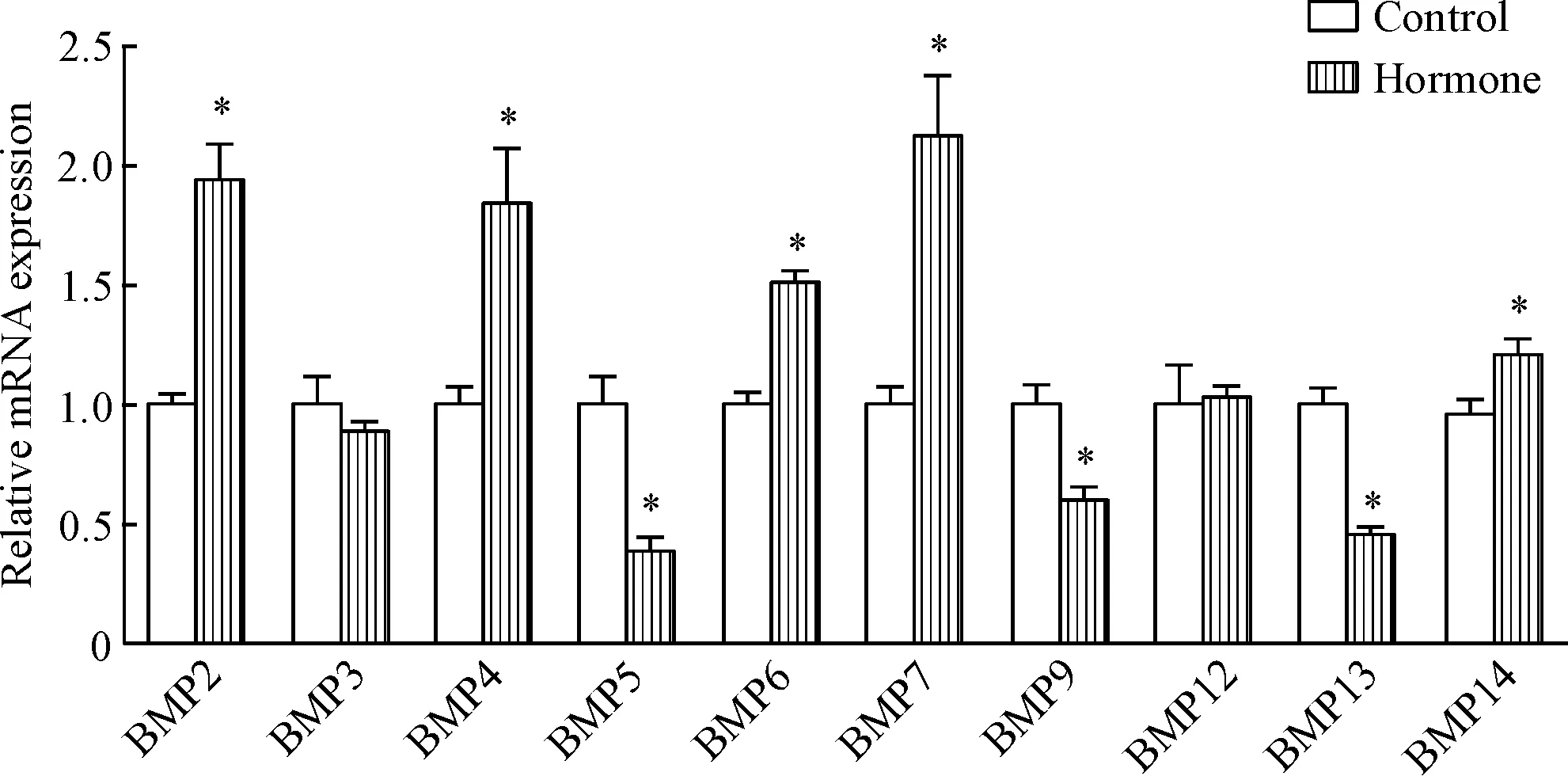
Figure 2.The mRNA expressions of BMP ligands in mouse mammary glands with hyperplasia.Mean±SD.n=5.*P<0.05vscontrol group.
图2BMP信号通路配体在小鼠乳腺组织中的表达
BMP信号通路有I型受体和II型受体。本实验检测2个常见的I型受体BMPR1A和BMPR1B及1个II型受体BMPR2在乳腺组织中的表达,结果显示在乳腺增生组织中只有BMPR1A的mRNA表达水平轻微下降(P<0.05),而BMPR1B和BMPR2的mRNA表达水平则无明显变化,见图3。
BMP信号通路中常见的拮抗剂Chrd、Chrdl1、Chrdl2、Noggin和Twsg1等也在乳腺中表达。结果显示,Chrdl1在增生的乳腺组织中的表达显著下调(P<0.05),Twsg1的表达明显升高(P<0.05),而其它3个分子的mRNA表达较正常乳腺组织则无明显变化,见图4。
3 BMP信号通路在乳腺增生组织中激活情况
BMP信号通路的激活以Smad1/5/9蛋白的磷酸化为标志。Western blot结果显示,与正常乳腺相比,乳腺增生组织中p-Smad1/5/9的表达水平显著升高(P<0.05),这说明BMP信号通路在乳腺增生组织中被激活,见图5。
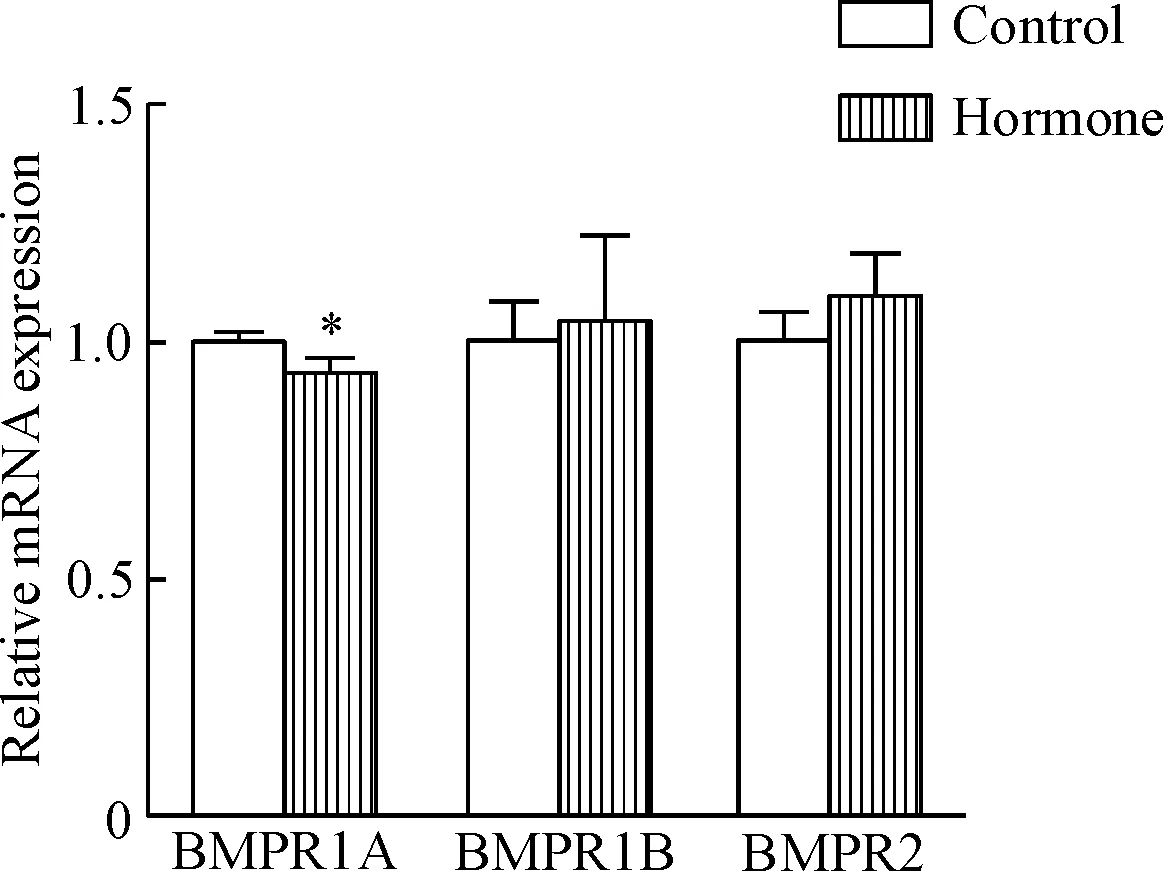
Figure 3.The mRNA expressions of BMP receptors in mouse mammary glands with hyperplasia.Mean±SD.n=5.*P<0.05vscontrol group.
图3BMP信号通路受体在小鼠乳腺组织中的表达
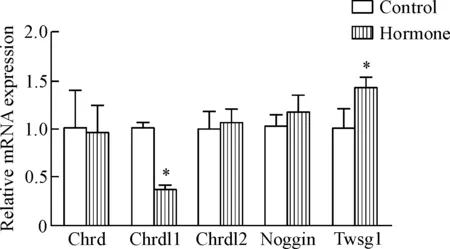
Figure 4.The mRNA expressions of BMP antagonists in mouse mammary glands with hyperplasia.Mean±SD.n=5.*P<0.05vscontrol group.
图4BMP信号通路拮抗剂在小鼠乳腺组织中的表达
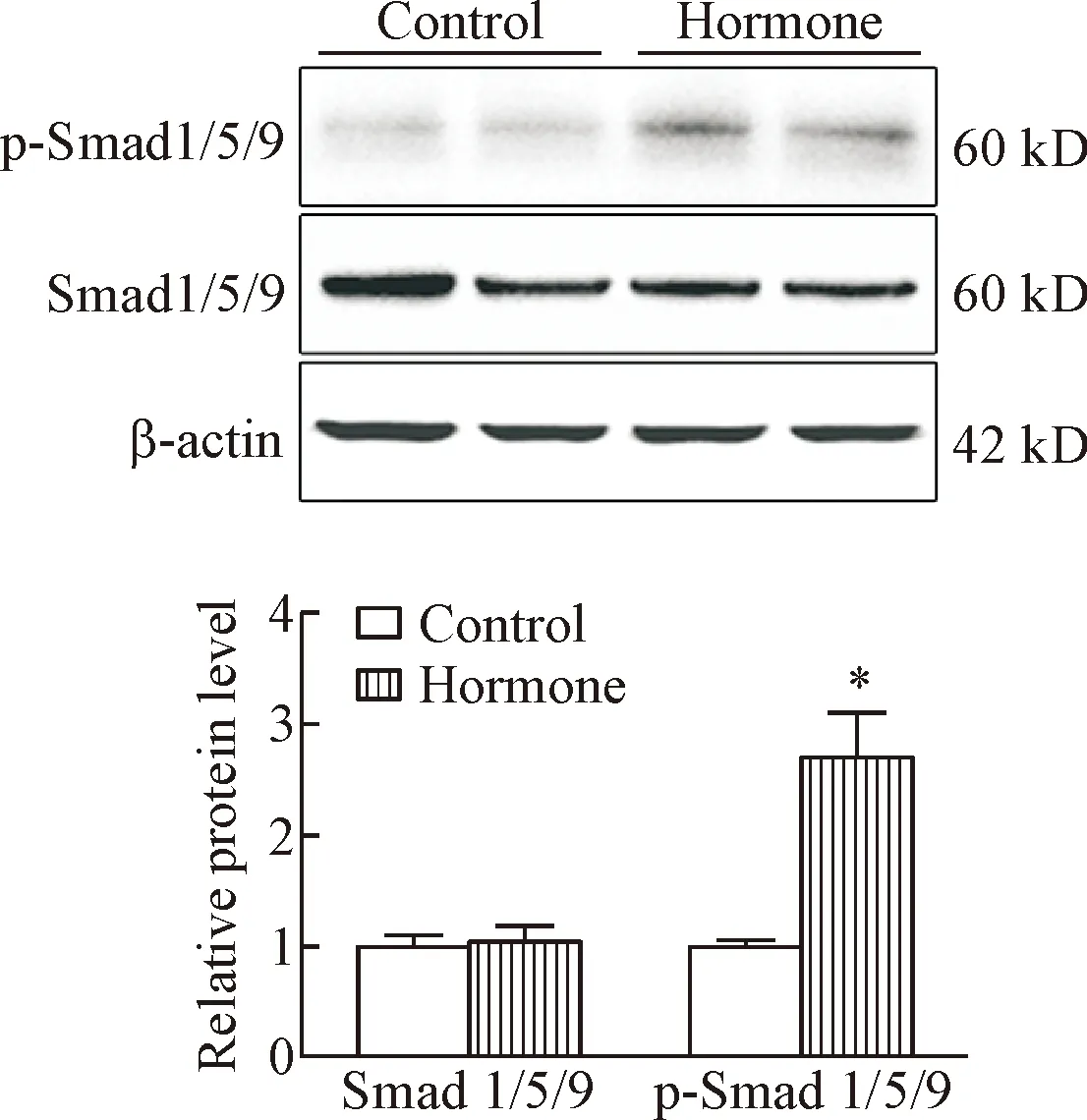
Figure 5.The expression of p-Smad 1/5/9 in mouse mammary glands with hyperplasia.Mean±SD.n=7.*P<0.05vscontrol group.
图5p-Smad1/5/9在小鼠乳腺组织中的水平
讨 论
乳腺增生症本质上是一种生理增生与复旧不全造成的乳腺正常结构的紊乱,主要原因是体内雌、孕激素水平失衡及乳腺组织内激素受体表达的异常,但该疾病的分子特征仍不明确。本研究以BMP信号通路为切入点研究乳腺增生组织的分子特征,发现BMP信号通路的配体BMP2、4、5、6、7、9、13和14,受体BMPR1A,以及拮抗剂Chrdl1和Twsg1等在乳腺增生组织中异常表达,其中BMP2、4、6、7、14和Twsg1表达上调,BMP5、9、13、BMPR1A和Chrdl1的表达下调。这些BMP分子的异常表达导致BMP信号通路的激活。
BMPs广泛地参与到乳腺的发生、发育和癌变的各个过程。BMP2和BMP4在乳腺发育过程中主要参与调控乳腺干细胞/祖细胞的命运,BMP2主要促进乳腺干细胞向管腔细胞的分化和管腔祖细胞群的扩增,BMP4主要促进乳腺干细胞/肌上皮祖细胞的增殖[7]。因此,在乳腺增生组织中发现BMP2和BMP4表达水平的升高并不难理解。在乳腺增生过程中雌激素和孕激素可能通过上调BMP2和BMP4的表达促进乳腺干细胞的增殖和分化,从而促进乳腺导管数量和分支的增加,致使乳腺上皮增生。已知BMP5在小鼠孕期乳腺导管分支增加过程中表达量下降[8],而乳腺增生的过程也伴随着乳腺导管数量的增加,因此,本研究中也观察到BMP5的下降。BMP6、7、9的研究多见于乳腺癌,主要功能是抑制乳腺癌细胞的增殖[9-10]。本研究观察到BMP9在乳腺增生组织中下调,这可能是乳腺细胞增殖所需,而同时BMP6和BMP7的表达在乳腺增生组织中上调,可能是使乳腺上皮细胞的增殖控制在一定的范围内,防止细胞恶性转化。BMP13和BMP14的在乳腺中的研究还未有报道,本研究发现BMP13在乳腺增生组织中表达下调,而BMP14的表达上调,它们的具体功能仍需进一步研究。
Chrdl1作为BMP信号通路的拮抗剂,主要抑制BMP4介导的信号转导,它能抑制BMP4诱导的乳腺癌细胞的迁移和侵袭[11]。本研究中观察到的Chrdl1在乳腺增生组织中的表达下调可能与BMP4介导的信号转导增强有关。Twsg1一般被认为是BMP信号通路的拮抗剂,但在乳腺组织中它主要作为BMP信号通路的激动剂[12]。在小鼠中全面敲除Twsg1后,乳腺组织中BMP信号通路受到抑制,乳腺导管的延伸推迟、官腔闭塞、二级分支减少[12],提示Twsg1能促进乳腺导管分支的形成。本研究发现Twsg1在乳腺增生组织中表达增加,这与乳腺导管分支增加的表型一致。
雌/孕激素联合使用对乳腺BMP信号通路的影响目前尚无报道。仅知在小鼠正常乳腺上皮细胞EpH4中孕激素受体A的过表达能引起经典BMP-Smad信号通路的激活[13];在人乳腺癌MCF-7细胞中,雌激素能下调BMPR1A、BMPR1B、BMP6和BMP7的mRNA水平,但并不激活BMP-Smad信号通路[9],这说明雌/孕激素能改变BMP信号通路。而本研究证实联合使用雌、孕激素也能引起BMP信号通路的改变,但与雌/孕激素的单独作用相比,某些分子(如:BMP6和BMP7)的变化趋势并不相同甚至相反,这一方面可能是由于体内和体外研究差异造成的,另一方面也可能是正常细胞和癌细胞不同引起的。
综上,本研究以小鼠为模型,从BMP信号通路入手,初步揭示了乳腺增生的分子特征,增进了对乳腺增生发生机制的了解。由于研究结果基于动物模型,仍需要临床上进一步的验证。今后的研究将围绕特定BMP分子在乳腺增生中的功能展开。
[参考文献]
[1]Amin AL,Purdy AC,Mattingly JD,et al.Benign breast disease[J].Surg Clin North Am,2013,93(2):299-308.
[2]Visscher DW,Frank RD,Carter JM,et al.Breast cancer risk and progressive histology in serial benign biopsies[J].J Natl Cancer Inst,2017,109(10).doi:10.1093/jnci/djx035.
[3]Li X,Xin P,Wang C,et al.Mechanisms of traditional chinese medicine in the treatment of mammary gland hyperplasia[J].Am J Chin Med,2017,45(3):443-458.
[4]Brazil DP,Church RH,Surae S,et al.BMP signalling:agony and antagony in the family[J].Trends Cell Biol,2015,25(5):249-264.
[5]Alarmo EL,Kallioniemi A.Bone morphogenetic proteins in breast cancer:dual role in tumourigenesis?[J].Endocr Relat Cancer,2010,17(2):R123-R139.
[6]Sundqvist A,Ten Dijke P,van Dam H.Key signaling nodes in mammary gland development and cancer:Smad signal integration in epithelial cell plasticity[J].Breast Cancer Res,2012,14(1):204.
[7]Chapellier M,Bachelard-Cascales E,Schmidt X,et al.Disequilibrium of BMP2 levels in the breast stem cell niche launches epithelial transformation by overamplifying BMPR1B cell response[J].Stem Cell Reports,2015,4(2):239-254.
[8]Romagnoli M,Belguise K,Yu Z,et al.Epithelial-to-mesenchymal transition induced by TGF-β1 is mediated by Blimp-1-dependent repression of BMP-5[J].Cancer Res,2012,72(23):6268-6278.
[9]Takahashi M,Otsuka F,Miyoshi T,et al.Bone morphogenetic protein6 (BMP6) and BMP7 inhibit estrogen-induced proliferation of breast cancer cells by suppressing p38 mitogen-activated protein kinase activation[J].J Endocrinol,2008,199(3):445-455.
[10] Wang T,Zhang Z,Wang K,et al.Inhibitory effects of BMP9 on breast cancer cells by regulating their interaction with pre-adipocytes/adipocytes[J].Oncotarget,2017,8(22):35890-35901.
[11] Cyr-Depauw C,Northey JJ,Tabariès S,et al.Chordin-like 1 suppresses bone morphogenetic protein 4-induced breast cancer cell migration and invasion[J].Mol Cell Biol,2016,36(10):1509-1525.
[12] Forsman CL,Ng BC,Heinze RK,et al.BMP-binding protein twisted gastrulation is required in mammary gland epithelium for normal ductal elongation and myoepithelial compartmentalization[J].Dev Biol,2013,373(1):95-106.
[13] Fleming JM,Ginsburg E,Goldhar AS,et al.Progesterone receptor activates Msx2 expression by downregulating TNAP/Akp2 and activating the Bmp pathway in EpH4 mouse mammary epithelial cells [J].PLoS One,2012,7(3):e34058.
