LRRK2/NF-κB信号对BCG诱导巨噬细胞RAW264.7炎症应答的调控
2018-04-02王启源徐红艳姬文兰
王启源,徐红艳,姬文兰
(陕西省结核病防治院内四科,陕西 西安 710100)
结核分枝杆菌(Mycobacteriumtuberculosis)是引起结核病(tuberculosis)的一种传染性病原菌[1]。肺泡巨噬细胞是结核分枝杆菌感染的主要靶细胞,在结核分枝杆菌感染的发病机理中发挥关键作用。巨噬细胞介导的先天免疫反应是宿主防御结核分枝杆菌的第一道防线[2]。宿主的免疫反应对结核感染的进展至关重要,了解结核分枝杆菌与宿主之间的相互作用对于控制结核是至关重要的。巨噬细胞产生的大量细胞因子如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)参与宿主防御结核分枝杆菌机制。
富亮氨酸重复序列激酶2(leucine-rich repeat kinase 2,LRRK2)是由PARK8基因编码的一种蛋白激酶。关于LRRK2的研究主要集中于慢性肠炎、麻风病和家族性帕金森病等。LRRK2在免疫调节中的作用主要依赖于特定的细胞类型及刺激环境。有研究表明LRRK2在小鼠神经炎症的动物模型中高表达,且能够调节小胶质细胞的炎症应答[3]。干扰素γ(interferon-γ,IFN-γ)能够诱导巨噬细胞中LRRK2的产生,此外,LRRK2对于巨噬细胞中细菌生存是非常必要的[4]。LRRK2通过负调控活化T细胞核因子1(nuclear factor of activated T-cells 1,NFAT1)抑制巨噬细胞中炎症因子的产生[5]。另有研究发现LRRK2通过激活核因子κB(nuclear factor-κB,NF-κB)通路促进炎症因子的产生[6]。而且,LRRK2通过促进NF-κB转录活性调节免疫应答进程[4]。
基于以上研究背景,本研究采用卡介苗(bacillus Calmette-Guérin,BCG)菌株感染小鼠肺泡巨噬细胞RAW264.7为细胞模型,建立了稳定的结核分枝杆菌感染巨噬细胞模型,通过探讨LRRK2对BCG感染后诱发巨噬细胞炎性反应及细菌生存率的调节作用,以期阐明LRRK2/NF-κB信号对巨噬细胞抗结核分枝杆菌感染的免疫调控机制,从而为进一步研究结核分枝杆菌在机体内的免疫机制提供一定的理论依据。
材 料 和 方 法
1 材料和试剂
小鼠巨噬细胞株RAW264.7(中科院上海细胞所);DMEM培养基和胎牛血清(HyClone);TRIzol试剂盒(Invitrogen);逆转录试剂盒(Promega);SYBR Premix Ex TaqⅡ(TaKaRa);BCA蛋白定量试剂盒(Thermo Fisher Scientific);抗LRRK2、p-p65和GAPDH蛋白抗体(Cell Signaling Technology);ECL显影试剂盒(Millipore);IL-1β、IL-6和IFN-γ酶联免疫吸附测定试剂盒(R&D);NF-κB抑制剂PDTC(Sigma)。
2 方法
2.1细胞培养将RAW264.7细胞置于含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养液中,37 ℃、饱和湿度、5% CO2培养箱中培养,每1~2 d传代1次。
2.2BCG感染巨噬细胞模型的建立RAW264.7细胞复苏后传2~3代,待细胞稳定后细胞长至70%~80%,按照感染复数(multiplicity of infection,MOI;即细菌数∶细胞数)为10∶1加入BCG菌悬液,轻轻摇匀,置于细胞培养箱中37 ℃、5% CO2孵育。感染4 h后更换新鲜培养基,24 h后收集细胞。
2.3qPCR检测mRNA的表达水平细胞总RNA提取按照TRIzol试剂盒说明书操作,将细胞总RAN逆转录获取cDNA。应用SYBR Green荧光染料试剂盒进行qPCR。采用Quantity One凝胶成像分析系统测定各相应条带的灰度值,选取GAPDH作为内参照。通过Ct值进行数据分析,目的基因的相对表达量以2-ΔΔCt表示。引物序列见表1。
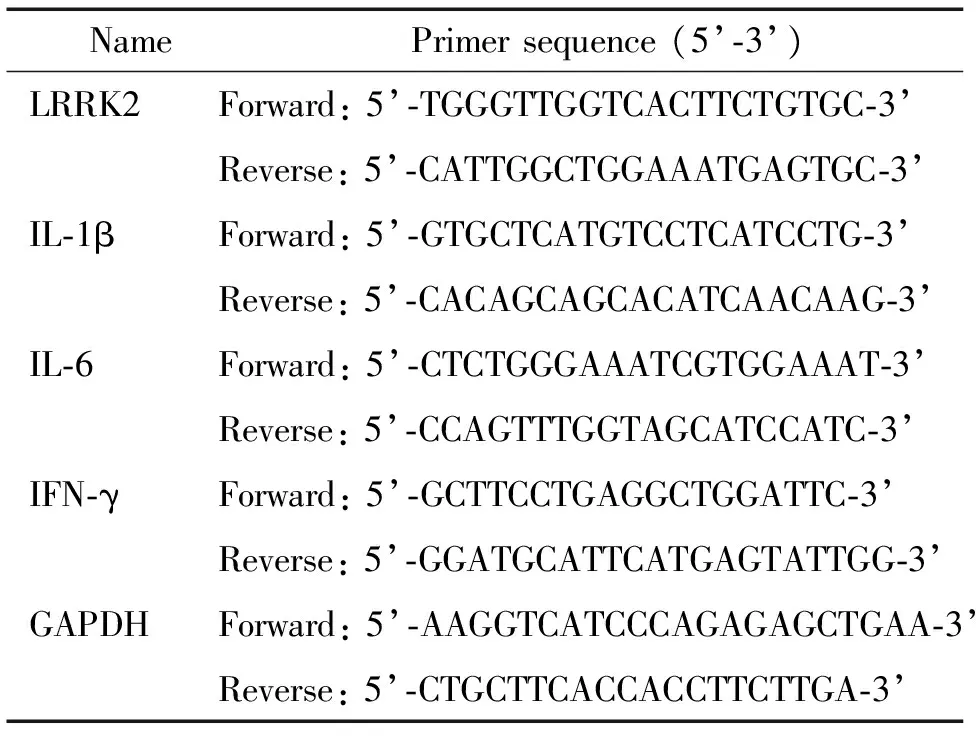
表1 qPCR引物序列Table 1.The primer sequences for qPCR
2.4Western blot检测蛋白表达收集各组细胞,加入细胞裂解液作用1 min,13 000 r/min离心15 min,吸取上清即细胞总蛋白,置于-80 ℃冻存备用。用BCA试剂盒检测蛋白浓度后,蛋白经SDS-PAGE分离后电转至PVDF膜。经5%脱脂奶粉室温封闭2 h后,加入相应 I 抗4℃孵育过夜。TBST洗膜3次,加入HRP标记的相应 II 抗,室温孵育1 h,TBST洗膜3次,ECL化学发光,显影,定影,拍照;Western blot检测条带用凝胶成像仪分析系统Quantity One软件扫描灰度值。计算目的蛋白与GAPDH灰度值的比值,进行统计学分析。
2.5菌落形成单位(colony-forming unit,CFU)计数检测结核分枝杆菌生存率巨噬细胞感染结核菌4 h后,用不含血清的DMEM培养液洗涤2次以除去细胞间未被巨噬细胞吞噬的细菌。向细胞培养板中再加入完全DMEM培养液1 mL继续培养。分别于细菌感染后的24 h和48 h去除12孔细胞板中的培养液,每孔加入500 μL 0.5% Triton X-100裂解细胞。倒置显微镜下观察巨噬细胞的裂解情况,待巨噬细胞全部裂解后每孔加入500 μL完全培养液终止裂解。振荡混匀5 min,接种于7H11培养基,37 ℃恒温培养箱培养3周后进行菌落计数。
2.6ELISA检测培养上清细胞因子的水平分别收集感染24 h后的培养上清,采用ELISA法测定促炎细胞因子IL-1β、IL-6和IFN-γ的水平,严格按照试剂盒说明书进行操作。
3 统计学处理
所有数据均采用SPSS 17.0软件包进行分析,应用GraphPad Prism 5软件作图。数据以均数±标准差(mean±SD)表示。两组间比较采用t检验,多组数据采用单因素方差分析。以P<0.05表示差异有统计学意义。
结 果
1 BCG诱导的巨噬细胞中LRRK2的表达水平
为阐明LRRK2在BCG感染的巨噬细胞中的作用,首先采用qPCR及Western blot检测BCG感染的RAW264.7细胞中LRRK2的表达水平,结果显示,RAW264.7细胞经BCG感染后,LRRK2的mRNA及蛋白表达均显著升高(P<0.05),感染6 h后LRRK2的表达出现上调,至24 h时到达顶峰,48 h有所下降,由此表明,BCG刺激可以诱导的巨噬细胞内LRRK2的表达水平,见图1。

Figure 1.The expression of LRRK2 at mRNA and protein levels in RAW264.7 cells infected with BCG.A:qPCR was used to detect the mRNA expression of LRRK2; B:Western blot was performed to determine the protein expression of LRRK2.Mean±SD.n=5.*P<0.05vs0 h group.
图1BCG对RAW264.7细胞中LRRK2的表达的影响
2 LRRK2对BCG感染的结核分枝杆菌存活率的影响
将小干扰RNA(small interfering RNA,siRNA,si)-阴性对照(negative control,NC)和si-LRRK2分别转染巨噬细胞后,用BCG感染,qPCR和Western blot结果表明沉默LRRK2后细胞中LRRK2的表达水平显著下调(P<0.05),见图2A、B。CFU计数结果显示,RAW264.7细胞经BCG处理后胞内结核分枝杆菌存活率明显升高,而si-LRRK2组的细菌生存率显著降低(P<0.05),说明LRRK2沉默能够抑制BCG诱导的结核分枝杆菌的存活率,见图2C。
3 LRRK2对BCG诱导的巨噬细胞炎症应答的影响
ELISA检测LRRK2对BCG诱导的巨噬细胞中炎症因子分泌的影响,结果显示,BCG刺激诱导RAW264.7细胞后,IL-1β、IL-6和IFN-γ的水平显著上调,而LRRK2下调明显降低BCG诱导的上述促炎细胞因子的水平(P<0.05),见图3A~C。进一步采用qPCR验证,结果与ELISA一致,沉默LRRK2降低BCG刺激分泌的细胞因子的mRNA表达水平(P<0.05),见图3D~F。以上结果表明LRRK2沉默能够抑制BCG诱导的巨噬细胞炎症应答进程。
4 LRRK2通过正调控NF-κB信号通路调节炎症应答进程
为了探讨LRRK2对BCG诱导的炎症应答的调控机制,检测了LRRK2对NF-κB通路的影响,qPCR和Western blot结果所示,BCG感染明显激活NF-κB通路,而下调LRRK2通过显著降低p-p65的蛋白水平抑制NF-κB信号通路(P<0.05)。同时,采用NF-κB通路的抑制剂PDTC探讨NF-κB信号是否参与LRRK2调控炎症应答,结果显示PDTC显著抑制BCG刺激诱导的炎症因子IL-1β和IL-6的mRNA表达(P<0.05),类似于LRRK2沉默的作用效果。由此说明下调LRRK2可能通过抑制NF-κB信号通路抑制BCG感染的炎症应答进程,见图4。
Figure 2.The effect of LRRK2 on the viability ofMycobacteriumtuberculosisin the RAW264.7 cells.A and B:qPCR and Western blot were used to evaluate the efficiency ofLRRK2 knockdown in the RAW264.7 cells; C:mycobacterial viability was measured by CFU assay.Mean±SD.n=5.*P<0.05vssi-NC group.
图2LRRK2对BCG感染的RAW264.7中细菌生存率的影响
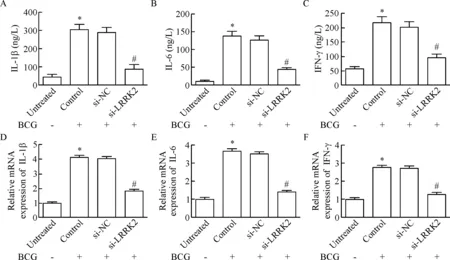
Figure 3.The effect of LRRK2 on the releases of inflammatory factors induced by BCG infection in the RAW264.7 cells.A,B and C:the release levels of IL-1β,IL-6 and IFN-γ from the RAW264.7 cells were examined by ELISA; D,E and F:the mRNA expression of IL-1β,IL-6 and IFN-γ was detected by qPCR.Mean±SD.n=5.*P<0.05vsuntreated group;#P<0.05vssi-NC group.
图3LRRK2对BCG诱导的RAW264.7细胞中炎症因子分泌水平的影响
讨 论
结核分枝杆菌是典型的胞内致病菌,肺泡巨噬细胞是结核分枝杆菌感染的主要靶细胞和宿主细胞,能够为结核分枝杆菌在宿主体内感染提供关键的胞内生存环境。结核分枝杆菌通过巨噬细胞表面的受体介导作用进入细胞内,引起细胞免疫应答反应[7]。
研究报道LRRK2能够调节免疫应答[4,8-9]。为检测结核分枝杆菌感染是否会导致LRRK2表达水平发生变化,建立了结核分枝杆菌BCG感染巨噬细胞RAW264.7的体外模型,观察了结核分枝杆菌感染细胞6、12、24及48 h时LRRK2的变化情况。qPCR和Western blot实验均显示,BCG感染RAW264.7细胞中LRRK2的表达水平明显上调,并且与感染时间有关。该结果表明LRRK2在巨噬细胞抗结核分枝杆菌感染中具有重要作用。此外,本研究发现沉默LRRK2抑制BCG感染RAW264.7细胞的结核分枝杆菌存活率。

Figure 4.NF-κB signaling was involved in the process of LRRK2-medicated inflammatory responses.A:Western blot was performed to determine the protein levels of p-p65 and p65; B:the mRNA expression of IL-1β and IL-6 was examined by qPCR.Mean±SD.n=5.*P<0.05vsuntreated group;#P<0.05vssi-NC group;&P<0.05vscontrol group.
图4NF-κB信号通路参与LRRK2调节BCG诱导的炎症应答过程
结核杆菌感染,特别是在感染早期,炎症应答对于结核分枝杆菌的清除十分重要。细胞因子的分泌失衡是结核分枝杆菌引起疾病进展的机制之一。当结核分枝杆菌感染后可触发信号使巨噬细胞活化产生大量的效应分子如IL-6、IL-1β和TNF-α等细胞因子[10]。本研究结果表明下调LRRK2可抑制BCG刺激诱导的炎性细胞因子IL-1β、IL-6和IFN-γ的表达,从而揭示LRRK2可正性调控巨噬细胞对结核分枝杆菌感染所产生的炎症应答。
NF-κB信号在炎症反应及免疫应答进程中具有非常重要的作用[11]。进而研究NF-κB通路是否参与LRRK2调控的炎症反应机制。本研究发现下调LRRK2通过抑制NF-κB信号通路抑制结核菌感染中的炎症反应的调节过程,为进一步阐明结核菌感染的免疫调控机制以及研发抗结核药物提供了新的靶标。
本研究结果揭示下调LRRK2可抑制BCG刺激诱导的炎症应答进程,进而抑制结核分枝杆菌在巨噬细胞内的生存和繁殖,此外,LRRK2对结核分枝杆菌感染导致炎症的正调控作用是通过促进NF-κB信号转导通路表达实现的。综上所述,LRRK2/NF-κB正反馈调控环在机体抗结核分枝杆菌感染过程中的免疫调控作用与机理,为进一步研究结核分枝杆菌感染的致病机理提供了新的思路,并为研制临床治疗结核病的药物研究提供了新的靶点。
[参考文献]
[1]任琳,李轶,王山梅,等.小鼠巨噬细胞内表达结核分枝杆菌CFP10-ESAT6融合蛋白对细胞增殖和凋亡的影响[J].中国病理生理杂志,2013,29(10):1809-1814.
[2]Liu PT,Modlin RL.Human macrophage host defense againstMycobacteriumtuberculosis[J].Curr Opin Immunol,2008,20(4):371-376.
[3]Moehle MS,Webber PJ,Tse T,et al.LRRK2 inhibition attenuates microglial inflammatory responses[J].J Neurosci,2012,32(5):1602-1611.
[4]Gardet A,Benita Y,Li C,et al.LRRK2 is involved in the IFN-γ response and host response to pathogens[J].J Immunol,2010,185(9):5577-5585.
[5]Liu Z,Lee J,Krummey S,et al.The kinase LRRK2 is a regulator of the transcription factor NFAT that modulates the severity of inflammatory bowel disease[J].Nat Immunol,2011,12(11):1063-1070.
[6]Han KA,Yoo L,Sung JY,et al.Leucine-rich repeat kinase 2 (LRRK2) stimulates IL-1β-mediated inflammatory signaling through phosphorylation of RCAN1[J].Front Cell Neurosci,2017,11:125.
[7]张宇晴,王新敏,王婵,等.Mcl-1信号通路阻断剂对H37Rv感染小鼠巨噬细胞凋亡的影响[J].中国病理生理杂志,2015,31(11):2059-2064.
[8]Wandu WS,Tan C,Ogbeifun O,et al.Leucine-rich repeat kinase 2 (Lrrk2) deficiency diminishes the development of experimental autoimmune uveitis (EAU) and the adaptive immune response[J].PLoS One,2015,10(6):e0128906.
[9]Lee H,James WS,Cowley SA.LRRK2 in peripheral and central nervous system innate immunity:its link to Parkinson’s disease[J].Biochem Soc Trans,2017,45(1):131-139.
[10] Bongiovanni B,Mata-Espinosa D,D’Attilio L,et al.Effect of cortisol and/or DHEA on THP1-derived macrophages infected withMycobacteriumtuberculosis[J].Tuberculosis (Edinb),2015,95(5):562-569.
[11] Zhang Q,Jiang X,He W,et al.MCL plays an anti-inflammatory role in mycobacterium tuberculosis-induced immune response by inhibiting NF-κB and NLRP3 inflammasome activation[J].Mediators Inflamm,2017,2017:2432904.
