自体动静脉内瘘术后成熟的彩色多普勒超声评估探讨
2018-04-02赵楠姚磊张浩然于欣欣于艳萍胡静孙福云
赵楠 姚磊 张浩然 于欣欣 于艳萍 胡静 孙福云
建立血管通路开展透析是终末期肾病首选治疗方案,相较于人工移植血管或长期留置中心静脉导管,自体动静脉内瘘(Arteriovenous fistula,AVF)在安全性、便捷性方面具有更为明显的优势[1]。造瘘术前通过彩色多普勒选择吻合血管可提高内瘘术成功率[2],术后通过多普勒动态观察内瘘吻合血管情况及并发症征象,可及时采取处理措施[3]。若术后AVF尚未成熟即实施穿刺透析,患者有着较高的血管损伤、血肿、假性动脉瘤形成风险[4]。影响AVF成熟的因素包括血栓形成、通路狭窄、静脉高流量等,彩色多普勒超声能够早期发现上述变化, 本文重点探讨彩色多普勒在AVF成熟判定中的应用。
1 资料与方法
1.1 一般资料
连续选取2015年8月—2017年2月期间拟建立桡动脉-头静脉瘘[5]患者94例进行前瞻性分析。患者原发疾病包括肾小球肾炎40例,糖尿病肾病36例,多囊肾6例,梗阻性肾病6例,高血压肾病4例,狼疮性肾炎2例。94例患者中,男53例,女41例,年龄28~75岁,平均(52.18±14.37)岁。
1.2 手术方法
局麻后沿左前臂远端、桡动脉走行作一5 cm切口,依次切开皮肤、皮下组织,寻找头静脉、桡动脉并以硅胶管悬吊,行头静脉-桡动脉端侧吻合术[6],吻合口以7-0线缝合,吻合口直径约为8~10 mm。去除动脉阻断后,见头静脉搏动良好、桡动脉远端搏动良好,手指色泽红润、毛细血管充盈征良好后[7],行创面止血、缝合,以无菌纱布覆盖,结束手术。
1.3 彩色多普勒超声检查
患者于术前、术后2周、术后4周、术后6周、术后8周接受彩色多普勒超声检查。使用iU 22彩色多普勒超声检查仪(荷兰Phillips公司),选用L17-5高频探头,探头频率5~17 MHz。患者上肢平放、外展伸直,充分暴露待检部位,记录桡动脉直径(RAD)、桡动脉血流量(RVF)、头静脉直径(CVD)、头静脉血流量(CVF)以及术后头静脉距皮肤距离、头静脉内膜厚度变化,各部位测量3次并取平均值予以记录[8],了解患者桡动脉、头静脉直径及流量变化特点。
1.4 评估价值分析
内瘘成熟情况根据穿刺、透析情况予以判断,判断标准[9]:常规穿刺成功后,以最低350~450 mL/min血流量实施血液透析,成功实施血液透析≥8次,每次透析时长达到3~5 h,即可判定为内瘘成熟。于术后8周根据上述标准判断内瘘成熟情况,比较成熟组、未成熟组近心端桡动脉、术侧肱动脉血流动力学参数变化,参数包括血流量(VF)、收缩期峰值流速(PSV)、舒张期峰值流速(EDV)及阻力指数(RI),其中,VF=平均流速×横截面积。
2 结果
2.1 桡动脉、头静脉直径及流量变化
患者术后2周RAD、RVF、CVD均较术前升高,差异有统计学意义(P<0.05);患者术后4~8周CVF均持续上升,差异有统计学意义(P<0.05);术后2~8周,患者头静脉距皮肤距离、头静脉内膜厚度均未见明显变化(P>0.05)。见表1。
表1 手术前后超声指标变化(±s)
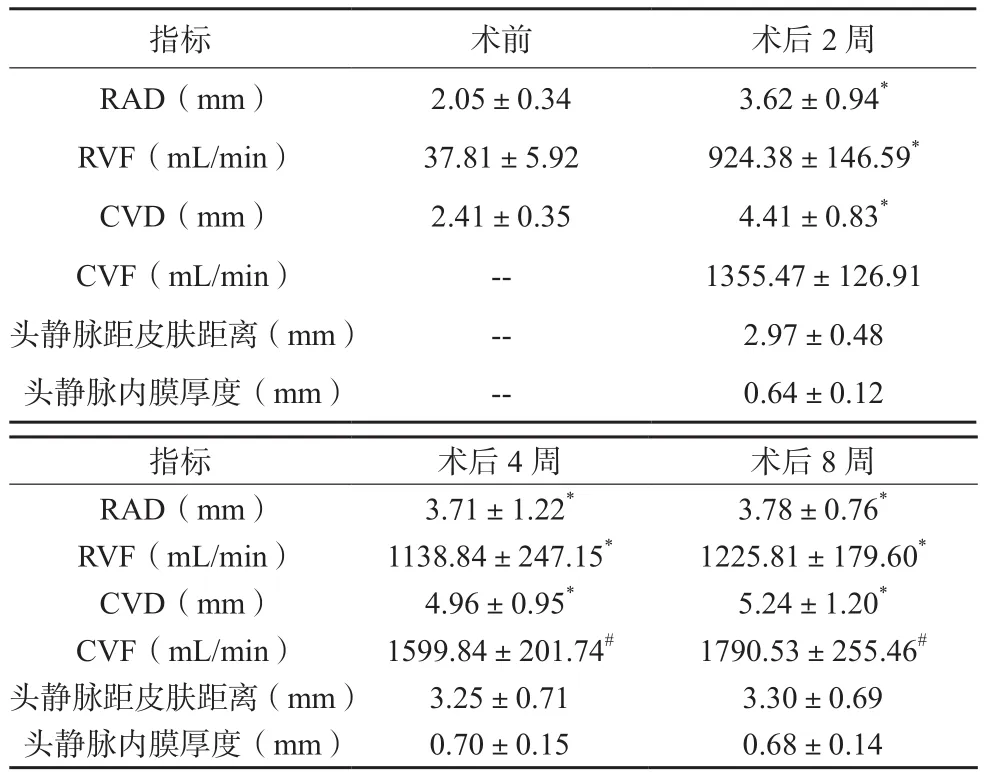
表1 手术前后超声指标变化(±s)
注:与术前比较,*P<0.05;与术后2周比较,#P<0.05
指标 术前 术后2周RAD(mm) 2.05±0.34 3.62±0.94*RVF(mL/min) 37.81±5.92 924.38±146.59*CVD(mm) 2.41±0.35 4.41±0.83*CVF(mL/min) -- 1355.47±126.91头静脉距皮肤距离(mm) -- 2.97±0.48头静脉内膜厚度(mm) -- 0.64±0.12指标 术后4周 术后8周RAD(mm) 3.71±1.22* 3.78±0.76*RVF(mL/min) 1138.84±247.15* 1225.81±179.60*CVD(mm) 4.96±0.95* 5.24±1.20*CVF(mL/min) 1599.84±201.74# 1790.53±255.46#头静脉距皮肤距离(mm) 3.25±0.71 3.30±0.69头静脉内膜厚度(mm) 0.70±0.15 0.68±0.14
2.2 血流动力学参数
术后13例患者AVF未达到成熟标准, 81例患者AVF成熟。术后2周,成熟组近心端桡动脉、术侧肱动脉VF、PSV、EDV均较术前上升,RI均较术前下降,差异有统计学意义(P<0.05),未成熟组术前、术后2周近心端桡动脉、术侧肱动脉血流动力学参数比较,差异无统计学意义(P>0.05)。见表2。
表2 成熟组与未成熟组患者动脉血流动力学变化比较(±s)
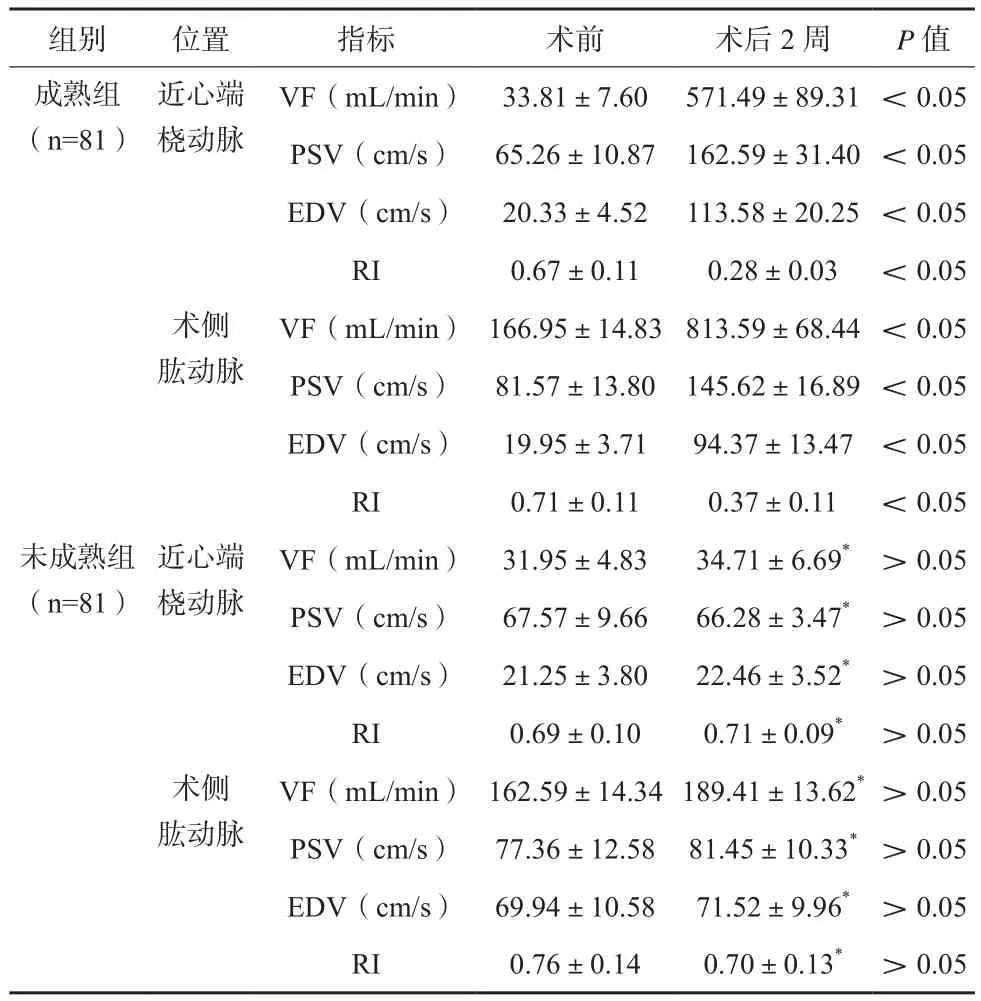
表2 成熟组与未成熟组患者动脉血流动力学变化比较(±s)
注:与成熟组比较,*P<0.05
组别 位置 指标 术前 术后2周 P值成熟组(n=81)近心端桡动脉VF(mL/min) 166.95±14.83813.59±68.44 <0.05 PSV(cm/s) 81.57±13.80 145.62±16.89 <0.05 EDV(cm/s) 19.95±3.71 94.37±13.47 <0.05 RI 0.71±0.11 0.37±0.11 <0.05未成熟组(n=81)VF(mL/min) 33.81±7.60 571.49±89.31 <0.05 PSV(cm/s) 65.26±10.87 162.59±31.40 <0.05 EDV(cm/s) 20.33±4.52 113.58±20.25 <0.05 RI 0.67±0.11 0.28±0.03 <0.05术侧肱动脉近心端桡动脉VF(mL/min) 162.59±14.34189.41±13.62*>0.05 PSV(cm/s) 77.36±12.58 81.45±10.33* >0.05 EDV(cm/s) 69.94±10.58 71.52±9.96* >0.05 RI 0.76±0.14 0.70±0.13* >0.05 VF(mL/min) 31.95±4.83 34.71±6.69* >0.05 PSV(cm/s) 67.57±9.66 66.28±3.47* >0.05 EDV(cm/s) 21.25±3.80 22.46±3.52* >0.05 RI 0.69±0.10 0.71±0.09* >0.05术侧肱动脉
3 讨论
一项流行病学调查报告显示,目前我国慢性肾脏病患病率高达10.8%,全球范围内,慢性肾脏病也已成为影响人类健康的重要疾病[10-11]。鉴于肾源缺乏、肾移植术后排斥反应的不可控性,多数患者生命的维持均需依赖透析治疗[12]。
自体AVF术后准确判断AVF成熟状态,对于适时开展透析治疗、维持血液透析的顺利开展均有着重要意义[13]。AVF成熟后,视诊可观察到皮下明显的扩张静脉、管径较直,触诊时瘘流入段、瘘体及流出段均可触及明显震感,听诊可闻及嗡鸣音,故既往有学者采取物理检查方式判断AVF状态,但其精确程度仍较为有限,且无法为并发症的评估提供参考[14]。相较于物理检查而言,彩色多普勒超声二维模式能够清晰显示头静脉扩张程度,为管径、通路状态的异常判断提供可靠参考,同时,彩色多普勒模式可显示血管流速、血流方向以及管腔是否存在狭窄[15],有望预测AVF成熟度。本研究94例患者均行头静脉-桡动脉端侧吻合术,患者RAD、RVF、CVD均较术前上升,说明AVF建立后,内瘘局部形成高顺应性、低阻力的血流动力环境[16];而术后CVF的持续上升,可能与吻合口远端桡动脉反向血流所致头静脉流量增加有关[17],同时,桡动脉位置较深、管壁较厚、受压变化小,故AVF建成后,尽管桡动脉远端压力显著下降、桡动脉流量大幅上升,RAD及RVF变化仍不及CVD、CVF明显,且头静脉距皮肤距离、头静脉内膜厚度一般可保持稳定。血管重构是内瘘成熟的关键环节,上述变化意味着自体AVF建立后,内瘘局部形成的高顺应性、低阻力的非生理性血流动力环境,促使前臂血管开始经历血管重构过程。
AVF成熟的关键即在于维持足够用于血液透析的血流量,但目前临床尚缺乏AVF成熟的统一判断标准,且不同国家AVF术后透析时间存在差异,如日本约有98%的患者术后2个月即接受穿刺,而这一数字在美国仅为36%。本研究选取术后8周为穿刺时间。为进一步观察彩色多普勒超声评估指标,此次研究就患者血流动力学参数变化进行了观察,结果显示,在头静脉与桡动脉吻合后,成熟的AVF通路RI明显下降,这一变化可使AVF通路获得更多的血流量,而血流量与血液粘滞系数呈反比、与血管半径的4次方及压强差呈正比的特点,也使得AVF近端桡动脉、肱动脉内径呈增大趋势,以维持增高的血流量[18]。
综上所述,彩色多普勒超声可为自体AVF术后成熟度的评估提供可靠参考,可根据RAD、RVF、CVD、CVF以及血流动力参数变化预测AVF成熟度,从而为适时穿刺血液透析的开展奠定基础。
[1] STEINER K, DUTTA P, VON STEMPEL C, et al. Percutaneous Transluminal Angioplasty in Arteriovenous Fistulas: Current Practice and Future Developments[J]. J Radiol Nurs, 2017, 36(3):145-151.
[2] HANSEN P M, OLESEN J B, PIHL M J, et al. Volume flow in arteriovenous fistulas using vector velocity ultrasound[J].Ultrasound Med Biol, 2014, 40(11): 2707-2714.
[3] 彭鑫, 涂波, 黄晓玲. 彩色多普勒超声在动静脉内瘘中的临床应用价值[J]. 临床超声医学杂志, 2015, 17(4): 261-262.
[4] ZAMBOLI P, FIORINI F, D’AMELIO A, et al. Color Doppler ultrasound and arteriovenous fistulas for hemodialysis[J]. J Ultrasound, 2014, 17(4): 253-263.
[5] VISCIANO B, RICCIO E, DE FALCO V, et al. Complications of native arteriovenous fistula: the role of color Doppler ultrasonography[J]. Ther Apher Dial, 2014, 18(2): 155-161.
[6] GOKSU E, YURUKTUMEN A, KAYA H. Traumatic pseudoaneurysm and arteriovenous fistula detected by bedside ultrasound[J]. J Emerg Med, 2014, 46(5): 667-669.
[7] 张园, 王富基. 应用显微外科技术制作动静脉内瘘体会[J]. 解放军医药杂志, 2009, 21(s1):14-14.
[8] VENTURINI M, CRISTEL G, MARZOLI S B, et al. Orbital color Doppler ultrasound as noninvasive tool in the diagnosis of anterior-draining carotid-cavernous fistula[J]. Radiol Med,2016, 121(4): 301-307.
[9] ZHU Y, DING H, FAN P, et al. Predicting the maturity of haemodialysis arteriovenous fistulas with colour Doppler ultrasound: a single-centre study from China[J]. Clin Radiol,2016, 71(6): 576-582.
[10] MUDONI A, CACCETTA F, CAROPPO M, et al. Echo color Doppler ultrasound: a valuable diagnostic tool in the assessment of arteriovenous fistula in hemodialysis patients[J]. J Vasc Access, 2016, 17(5): 446-452.
[11] 刘晓明, 谷颖, 向明, 等. 彩色多普勒超声评估行高位动静脉内瘘术及静脉浅置化患者血管的价值[J]. 贵阳医学院学报,2016, 41(5): 590-593.
[12] BASKAN O, DURDAG E, GEYIK S, et al. Spinal arteriovenous malformation: use of intraoperative color Doppler ultrasonography guidance for surgical resection. Case report[J].Med Ultrason, 2014, 16(4): 386.
[13] AHMED Y, DAVIDSON J, AZAR N. Ultrasound-guided transcutaneous embolization of uterine arteriovenous fistula performed for treatment of symptomatic, heavy vaginal bleeding: case report with brief review of literature[J]. J Med Ultrasound, 2015, 23(3): 146-149.
[14] 朱宇莉, 丁红, 范培丽, 等. 彩色多普勒超声对自体动静脉内瘘成型术前血管的观察和评价[J]. 中国血液净化, 2015, 14(4):246-249.
[15] EVANS A, GAZAILLE R E, MCKENZIE R, et al. Acquired uterine arteriovenous fistula following dilatation and curettage:an uncommon cause of vaginal bleeding[J]. J Radiol Case Rep,2017, 12(2): 287-291.
[16] GEORGIADIS G S, CHARALAMPIDIS D G, ARGYRIOU C,et al. The necessity for routine pre-operative ultrasound mapping before arteriovenous fistula creation: a meta-analysis[J]. Eur J Vasc Endovasc Surg, 2015, 49(5): 600-605.
[17] KOKKALIS E, COOKSON A N, STONEBRIDGE P A, et al.Comparison of vortical structures induced by arteriovenous grafts using vector Doppler ultrasound[J]. Ultrasound Med Biol,2015, 41(3): 760-774.
[18] GROVER S, BOLISETTI S, SANGANI S, et al. Spectrum of vascular abnormalities in color Doppler examination of upper extremities tested for suitability for AV fistula creation in patients of renal failure[J]. Int J Adv Med, 2017, 4(1): 47-50.
