定量超声评估1,25-二羟维生素D3干预前后肾病综合征患儿骨密度变化
2018-04-02张国珍徐志泉罗海伶陈玉雯冯小伟廖锋
张国珍 徐志泉 罗海伶 陈玉雯 冯小伟 廖锋
肾病综合征患儿病理改变包括肾小球基底膜通透性增加、肾小球滤过率降低等[1]。部分患儿还可伴随低钙血症、骨质疏松等代谢异常症状,而长期大剂量糖皮质激素的应用可加剧这一变化,并对成骨细胞、钙代谢等环节造成影响,导致骨吸收增加、骨形成减少[2]。研究发现,糖皮质激素可抑制1,25-二羟维生素D3[1,25(OH)2D3],减少钙吸收,加速钙磷代谢,这可能是导致骨密度变化的主要原因[3]。补充1,25(OH)2D3有望降低糖皮质激素对患儿骨密度的不良影响,维持正常骨骼代谢。故此,设计本研究以验证上述假设。
1 资料与方法
1.1 一般资料
以我院2014年1月至2017年2月收治的93例肾病综合征患儿为研究对象,进行前瞻性对照分析。本临床研究已征得我院医学伦理委员会批准,患儿监护人均知情同意并签署相关协议。入组患儿均为初治,既往无激素治疗史[4],排除合并其他类型肾病及慢性疾病者,以及既往有骨折史者。使用随机数字表将患儿分为维生素D+钙剂组(A组)、活性维生素D组(B组)、活性维生素D+钙剂组(C组),各31例;此外,选取30名健康体检儿童,纳入对照组。各组年龄、性别等基线临床资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方案
3组肾病综合征患儿均口服醋酸泼尼松片,每日2 mg/kg,分次口服,最大剂量不超过60 mg/d,服用4~6周;继之1.5 mg/(kg·d),最高60 mg/d,隔日1次顿服,继续用6周,以后逐渐减量,6个月停药[5]。在此基础上,A组口服维生素D(每日400IU)以及牡蛎碳酸钙(每次750 mg,1次/日)。B组口服骨化三醇胶丸(每次0.25 mg,1次/日)。C组口服骨化三醇胶丸、牡蛎碳酸钙,用法用量同前。
1.3 观察指标
于受试儿童入组时,应用Omnisense 7000型定量超声骨强度仪(以色列Sunlight公司)测定其左胫骨中段超声声速(SOS),按照亚洲儿童数据库为参照标准,根据同年龄、同性别SOS标准值计算出Z值及百分比划分骨强度水平,骨强度评价[6]:严重骨强度不足:Z值<-2;中度骨强度不足:-2<Z值<-1;轻度骨强度不足:-1<Z值<0;骨量正常:Z值>0。分别于治疗前、治疗6个月后,抽取肾病综合征患儿空腹血并取24 h尿液标本,以放射免疫化学发光法测定其血清甲状旁腺激素(PTH),以酶联免疫吸附法测定其25-羟维生素D3,使用ADVIA 1650 全自动生化仪(德国西门子公司)测定其血清碱性磷酸酶(AKP)、白蛋白(ALB)、磷(P)、钙(Ca)以及尿钙浓度。
1.4 统计学分析
对本临床研究的所有数据采用SPSS 22.0进行分析,计数资料采用χ2检验,计量资料以(±s)表示,并采用t检验或F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组骨密度变化
各组受试儿童入组时骨密度组间比较差异无统计学意义(P>0.05);治疗6个月后,各组肾病综合征患儿骨密度均较入组时下降,与治疗前比较差异有统计学意义,3组中A组下降最为明显,其次为B组,组间差异有统计学意义(P<0.05)。见表1。
表1 各组受试儿童骨密度变化比较(Z值,±s)
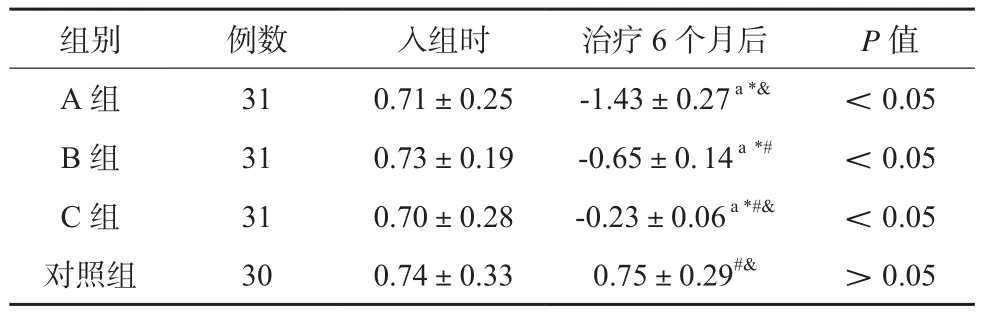
表1 各组受试儿童骨密度变化比较(Z值,±s)
注:与入组时比较,a P<0.05;与对照组比较,*P<0.05;与A组比较,#P<0.05;与B组比较,&P<0.05
组别 例数 入组时 治疗6个月后 P值A组 31 0.71±0.25 -1.43±0.27 a*& <0.05 B组 31 0.73±0.19 -0.65±0. 14 a*# <0.05 C组 31 0.70±0.28 -0.23±0.06 a*#& <0.05对照组 30 0.74±0.33 0.75±0.29#& >0.05
2.2 肾病综合征患儿检测指标变化
3组肾病综合征患儿治疗前25-羟维生素D3、ALB、PTH、AKP、P、Ca及尿钙,各组间比较差异无统计学意义(P>0.05)。治疗6个月后肾病综合征患儿血清25-羟维生素D3、ALB、PTH、Ca及尿钙均较入组时上升, 血AKP、P较入组时下降,各组治疗前后比较差异均有统计学意义(P<0.05)。治疗6个月后C组血清25-羟维生素D3、Ca升高最为明显,其次为B组,C组25-羟维生素D3与A、B组比较差异有统计学意义,C组血钙与A组比较差异有统计学意义,A组尿钙水平较其他两组明显增高,差异均有统计学意义(P<0.05)。3组肾病综合征患儿治疗后各组间ALB、P、AKP、PTH比较差异无统计学意义(P>0.05)。见表2。
3 讨论
肾病综合征致病因素复杂,部分患儿可进展至慢性肾病甚至终末期肾病[7-8]。最新研究发现,1,25(OH)2D3与肾病综合征患儿各项生化指标均具有相关性,如肌酐与肾小球滤过率的下降,肾脏合成1,25(OH)2D3减少,而肾小管毛细管通透性增强所致维生素D结合蛋白大量丢失可加剧1,25(OH)2D3流失,形成恶性循环[9]。此外,亦有学者指出,肾病综合征患儿骨质疏松的发生发展也与1,25(OH)2D3进行性下降有关[10]。因此,上调1,25(OH)2D3水平,有望改善患儿预后质量、预防骨质疏松等骨性并发症的发生。
此次研究入组时各组受试儿童骨密度均未见明显差异,可能与肾病综合征患儿肾功能变化不明显、病程短尚未累及骨质有关。而在治疗6个月后,各组血25-羟维生素D3、ALB及Ca水平升高,但各组肾病综合征患儿骨密度均显著下降,且A组患儿骨密度已降至中度骨强度不足范围,说明长期口服糖皮质激素虽然能降低尿蛋白,但对患儿骨密度造成明显影响,其机制一方面为激素造成胃肠钙离子重吸收减少、抑制成骨细胞生长,刺激破骨细胞生成[11-12],另一方面,激素的抗维生素D效应可导致钙吸收减少、尿钙排泄增加,并引发继发性甲状旁腺功能亢进,增加骨重吸收[13]。因此,在血清指标及尿钙变化的观察中,可以发现,各组患儿治疗6个月后PTH、尿钙均上升而血P下降。
与B组、C组相比,A组骨密度下降、血清指标及尿钙变化最为明显,其原因与维生素D的吸收与作用机制有关,正常情况下,维生素D进入体内后需在肝脏及肾脏酶的作用下完成活化过程,发挥生理作用,而肾病综合征患儿肾功能的受累可导致维生素D吸收受限,进而造成体内活性维生素D水平无法满足维持骨代谢需求,使得糖皮质激素对骨骼的影响无法得到有效控制[14-15]。1,25(OH)2D3为维生素D的活性形式,人体吸收后可直接发挥作用,故可有效抵抗糖皮质激素长期应用所致骨代谢异常,同时,1,25(OH)2D3还具有滋养肠粘膜作用,对于上调钙吸收能力、激活钙结合蛋白基因、抑制PTH RNA的合成与分泌、促进骨盐沉着亦有着积极意义[16-17],得益于上述优势,本研究B组、C组血清指标及血钙变化得到了更为有效的控制。此外,本研究结果还显示,在补充1,25(OH)2D3的基础上,强调钙剂补充,不仅不会造成尿钙排泄上升,还可进一步抑制患儿骨密度降低趋势,1,25(OH)2D3可与钙吸收相互促进[18]。
表2 肾病综合征患儿血清指标及尿钙变化比较(±s)
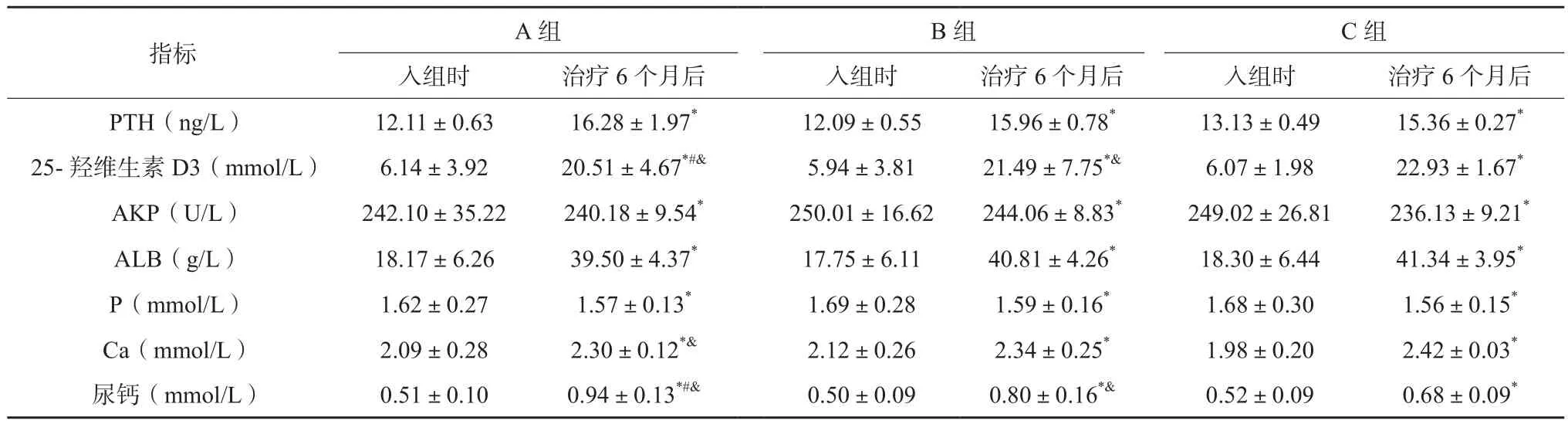
表2 肾病综合征患儿血清指标及尿钙变化比较(±s)
注:与入组时比较,*P<0.05;与B组比较,#P<0.05;与C组比较,&P<0.05
指标 A组 B组 C组入组时 治疗6个月后 入组时 治疗6个月后 入组时 治疗6个月后PTH(ng/L) 12.11±0.63 16.28±1.97* 12.09±0.55 15.96±0.78* 13.13±0.49 15.36±0.27*25-羟维生素 D3(mmol/L) 6.14±3.92 20.51±4.67*#& 5.94±3.81 21.49±7.75*& 6.07±1.98 22.93±1.67*AKP(U/L) 242.10±35.22 240.18±9.54* 250.01±16.62 244.06±8.83* 249.02±26.81 236.13±9.21*ALB(g/L) 18.17±6.26 39.50±4.37* 17.75±6.11 40.81±4.26* 18.30±6.44 41.34±3.95*P(mmol/L) 1.62±0.27 1.57±0.13* 1.69±0.28 1.59±0.16* 1.68±0.30 1.56±0.15*Ca(mmol/L) 2.09±0.28 2.30±0.12*& 2.12±0.26 2.34±0.25* 1.98±0.20 2.42±0.03*尿钙(mmol/L) 0.51±0.10 0.94±0.13*#& 0.50±0.09 0.80±0.16*& 0.52±0.09 0.68±0.09*
综上,长期大量糖皮质激素治疗可造成肾病综合征患儿骨密度下降,而1,25(OH)2D3可抵抗这一变化,治疗期间积极补充1,25(OH)2D3及钙剂,能改善骨代谢、预防骨密度下降。但补充过量可能造成骨骼畸形、结石发生风险上升,应注意剂量调整。本研究不足在于病例为初治、激素疗程短,随访时间短、标本量少。绝大多数肾病综合征患儿因复发等因素往往疗程超过6个月,后续尚需大样本、随机、长期对照研究进一步验证。
[1] AGGARWAL A, YADAV A K, RAMACHANDRAN R, et al.Bioavailable vitamin D levels are reduced and correlate with bone mineral density and markers of mineral metabolism in adults with nephrotic syndrome[J]. Nephrology, 2016, 21(6):483-489.
[2] CHOUDHARY S, AGARWAL I, SESHADRI M S. Calcium and vitamin D for osteoprotection in children with newonset nephrotic syndrome treated with steroids: a prospective,randomized, controlled, interventional study[J]. Pediatr Nephrol, 2014, 29(6): 1025-1032.
[3] BANERJEE S, BASU S, SEN A, et al. The effect of vitamin D and calcium supplementation in pediatric steroid-sensitive nephrotic syndrome[J]. Pediatr Nephrol, 2017, 32(11): 2063-2070.
[4] CIANFEROTTI L, CRICELLI C, KANIS J A, et al. The clinical use of vitamin D metabolites and their potential developments:a position statement from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis(ESCEO) and the International Osteoporosis Foundation (IOF)[J]. Endocrine, 2015, 50(1): 12-26.
[5] 中华医学会儿科分会肾脏病学组.儿童常见肾脏疾病诊治循证指(一).中华儿科学杂志[J].2009,47(2):167-170.
[6] KALKWARF H J, ZEMEL B S, GILSANZ V, et al. The bone mineral density in childhood study: bone mineral content and density according to age, sex, and race[J]. J Clin Endocrinol Metab, 2007, 92(6):2087-2099.
[7] SELEWSKI D T, CHEN A, SHATAT I F, et al. Vitamin D in incident nephrotic syndrome: a Midwest Pediatric Nephrology Consortium study[J]. Pediatr Nephrol, 2016, 31(3): 465-472.
[8] ESMAEEILI M, AZARFAR A, HOSEINALIZADEH S.Calcium and vitamin D metabolism in pediatric nephrotic syndrome; an update on the existing literature[J]. Int J Pediatr,2015, 3(2.1): 103-109.
[9] PARK H W, TSE S, YANG W, et al. A genetic factor associated with low final bone mineral density in children after a long-term glucocorticoids treatment[J]. Pharmacogenomics J, 2017, 17(2):180-185.
[10] LEE D, SEMEAO E. Bone Health in Pediatric Inflammatory Bowel Disease[M]//Pediatric Inflammatory Bowel Disease.Springer International Publishing, 2017: 299-314.
[11] LEONARD M B. Glucocorticoid-induced osteoporosis in children: impact of the underlying disease[J]. Pediatrics, 2007,119 Suppl 2:S166.
[12] FEBER J, GABOURY I, NI A, et al. Skeletal findings in children recently initiating glucocorticoids for the treatment of nephrotic syndrome[J]. Osteoporos Int, 2012, 23(2):751-760.
[13] RIBEIRO D, ZAWADYNSKI S, PITTET L F, et al. Effect of glucocorticoids on growth and bone mineral density in children with nephrotic syndrome[J]. Eur J Pediatr, 2015, 174(7): 911-917.
[14] KOŞAN C, AYAR G, ORBAK Z. Effects of steroid treatment on bone mineral metabolism in children with glucocorticoidsensitive nephrotic syndrome[J]. West Indian Med J, 2012,61(6):627.
[15] CHEN Y, WAN J X, JIANG D W, et al. Efficacy of calcitriol in treating glucocorticoidinduced osteoporosis in patients with nephrotic syndrome: an open-label, randomized controlled study[J]. Clin Nephrol, 2015, 84(5): 262-269.
[16] BACHRACH L K. Diagnosis and treatment of pediatric osteoporosis[J]. Curr Opin Endocrinol Diabetes Obes, 2014,21(6): 454-460.
[17] DUQUE G, MACORITTO M, DION N, et al. 1,25(OH)2D3 acts as a bone-forming agent in the hormone-independent senescence-accelerated mouse (SAM-P/6)[J]. Am J Physiol Endocrinol Metab, 2005, 288(4):E723-730.
[18] SCHIPPER L G, FLEUREN H W H A, VAN DEN BERGH J P W,et al. Treatment of osteoporosis in renal insufficiency[J]. Clin Rheumatol, 2015, 34(8): 1341-1345.
