bFGF在兔口腔溃疡模型中的表达
2018-03-30陈琪罗程陈红苏松付文广谢鑫郑思琳
陈琪 罗程 陈红 苏松 付文广 谢鑫 郑思琳
口腔溃疡(oral ulcer)在黏膜疾病中占据首位,不论性别、年龄、人种均可发生,是术后、肿瘤等患者的常见并发症。疼痛具有反复性、灼痛感等特征,阻碍进食、睡眠,从而导致营养不良、抵抗力下降,严重影响患者的生存质量[1-2]。目前的治疗方法有针灸、冷敷、光子照射等,治疗药物多种,但目前没有疗效明确的治疗方法与药物[3]。而基因治疗是目前尚未广泛应用又极具前景的治疗方式。所以,我们尝试从相关基因入手,碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)一种促进细胞生长的多肽生长因子,具有修复完善骨组织、血管、神经的作用,能够刺激内皮细胞增殖和新生血管的生成。那么它在溃疡组织中是如何表达呢?目前尚无明确的研究,因此,本项目拟研究在口腔溃疡兔口腔颊黏膜组织中bFGF的表达情况,尝试为口腔溃疡治疗提供新的思路。
1 材料与方法
1.1 动物
新西兰兔72 只, SPF级, 体重3 000~3 500 g,雌雄各半,购于泸州医学院实验动物中心,许可证号:SYXK(川)2013-065。
1.2 药品
口腔溃疡散(北京同仁堂股份有限公司同仁堂制药厂生产), 3 g/瓶(国药准字Z11020184, 产品批号: 15100065)。涂于溃疡处, 2 次/d, 疗程7 d。
1.3 试剂与仪器
Rabbit anti-bFGF、 羊抗兔二抗(CST公司, 美国); SP kit、DAB kit、First Strand cDNA Synthesis Kit(Roche公司, 瑞士); 病理切片机、紫外凝胶系统、紫外分光光度计(Bio-rad公司, 美国)。
1.4 方法
1.4.1兔口腔溃疡动物模型制备新西兰大白兔随机分为3 组,每组24 只:正常黏膜组(对照组),不做任何处理;口腔溃疡模型黏膜组(模型组),用直径为8 mm的玻棒蘸取浓度为40%的冰醋酸置于兔左右两侧距口角2 mm颊膜处烧灼60 s,生理盐水冲洗1 min,使局部成灰白色,直径8 mm的白色损害, 24 h后经病理检查证实兔口腔溃疡动物模型建立成功[3]。口腔溃疡模型治疗组(治疗组),造模成功后,每天给予口腔溃疡散涂抹, 2 次/d, 疗程7 d。观察动物的精神状态、饮食状况及皮毛的变化等一般情况。在第3、 5、 7 天取各组口腔颊黏膜组织,每组各取6 只。
1.4.2实验步骤 取各组口腔颊黏膜组织: ①HE染色切片检测组织的炎症细胞、血管数目,上皮增生情况; ②RT-PCR检测口腔颊部黏膜组织中bFGF基因mRNA表达情况,Quantity One软件计算比较RT-PCR产物条带与β-actin条带的吸光度的相对比值,通过分析,最终得出相对表达量; ③石蜡切片后,用免疫组织化学法检测口腔颊黏膜bFGF的平均积吸光度值。采用计算机图像分析技术对免疫组化结果进行半定量分析。通过ImaGe-pro-plus图像系统半定量测定bFGF的表达,蛋白表达在胞浆,呈棕黄色颗粒。每张切片随机取10 个互不重叠的视野(×400)测定积分吸光度值(integral optical density, IOD)和面积累加值(Area),IOD/Area得到平均吸光度值,结果以平均吸光度值表示。
1.4.3观察指标bFGF在兔口腔溃疡颊黏膜组织中的表达情况。
1.5 统计学处理

2 结 果
2.1 兔一般情况
造模组大鼠冰醋酸烧灼后,逐渐出现进食量下降,部分体质量与正常对照组相比明显偏低。对照组大鼠生长较好,未出现死亡病例。24 h后经病理检查证实已建立兔口腔溃疡模型(图 1)。造模成功当天,黏膜上皮破损或糜烂,大量炎细胞浸润。治疗组用药3 d后,炎细胞浸润开始减轻,坏死组织减少,边缘纤维细胞增生;用药5 d后炎症细胞明显减少,无坏死组织,大量成纤维细胞增生;用药7 d后形成癒痕组织。模型组仅在7 d后有愈合的趋向。
图 1口腔黏膜HE染色图片(×400)
Fig 1HE staining of oral mucos(×400)
2.2 RT-PCR检测结果
造模成功当天, bFGF mRNA在正常黏膜组中少量表达(0.34±0.03),与模型组(0.60±0.06)、治疗组(0.60±0.06)比较,差异有统计学意义(P<0.05),模型组与治疗组比较,差异没有统计学意义(P>0.05)。在用药的第3、 5、 7 天, 模型组、治疗组中bFGF mRNA的表达水平逐渐升高,治疗组高于模型组,且差异具有统计学意义(P<0.05)(图 2, 表 1)。
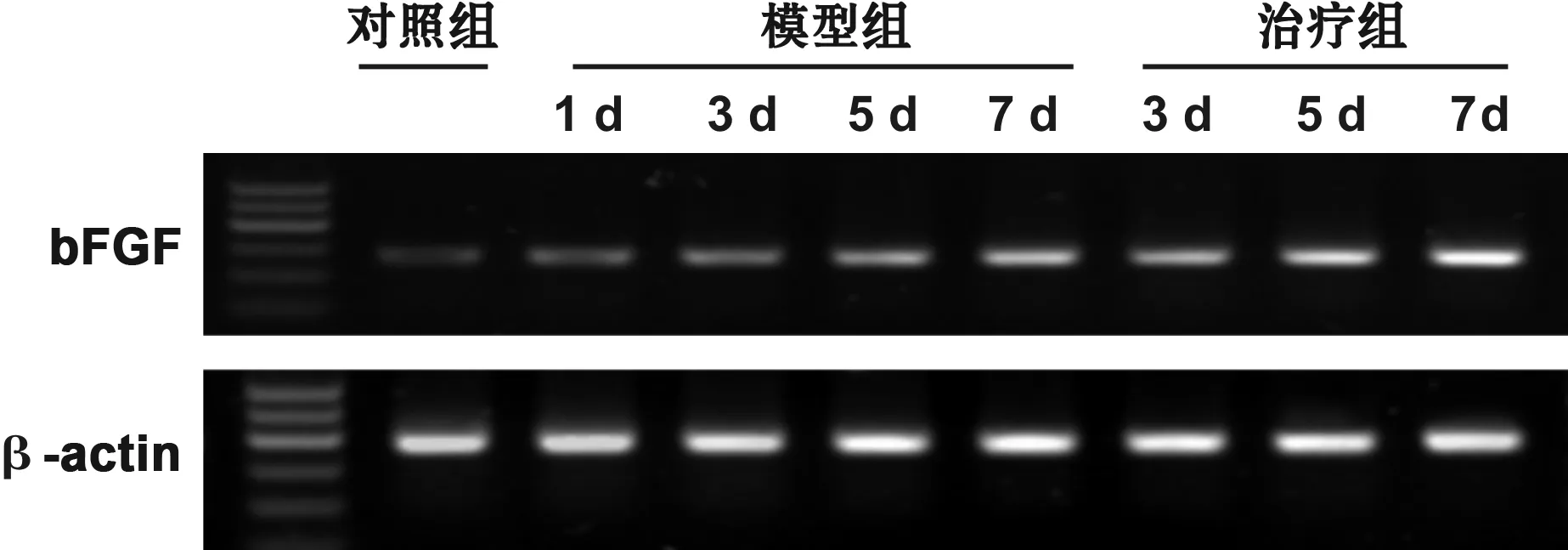
图 2口腔黏膜bFGF mRNA表达
Fig 2The expression of bFGF mRNA in oral mucosa
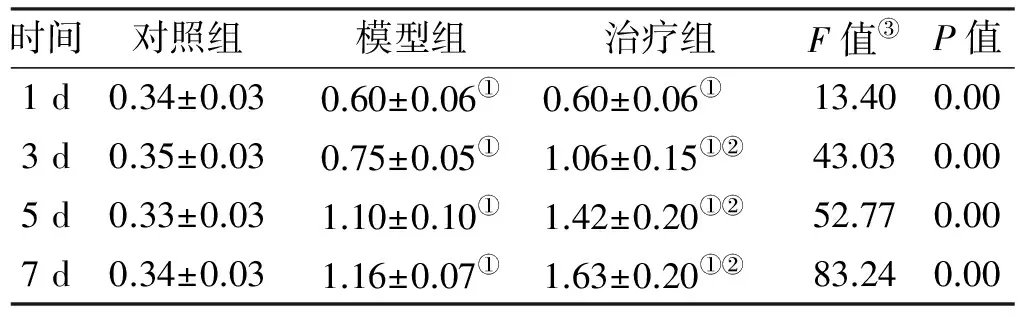
注: ①P<0.05vs对照组; ②P<0.05vs模型组, ③ 采用两因素方差分析对各组和各时间点进行分析,差异有统计学意义后,再通过Duncan检验进行两两比较
2.3 IHC结果
光学高倍(×400)物镜下: bFGF在正常口腔溃疡黏膜的上皮层和真皮层呈弱表达或不表达,阳性表达在胞质。
bFGF在正常黏膜组中少量表达0.01±0.00,模型组第1 天的表达为0.02±0.01, 2 组比较,其差异有统计学意义(P<0.05)。模型组与治疗组比较,差异没有统计学意义(P>0.05)。在用药的第3、 5、 7天, 模型组、 治疗组中bFGF的表达水平逐渐升高,模型组bFGF的蛋白表达量低于治疗组(P<0.01),且差异具有统计学意义(P<0.05)(图 3, 表 2)。

图 3各组bFGF蛋白表达(免疫组化, ×400)
Fig 3The expression of bFGF protein in the groups(Immunohistochemistry×400)
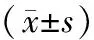

注: ①P<0.05vs对照组; ②P<0.05vs模型组; ③ 采用两因素方差分析对各组和各时间点进行分析,差异有统计学意义后,再通过Duncan检验进行两两比较
3 讨 论
口腔溃疡(oral ulcer,OU)俗称“口疮”,是一种常见的发生于口腔黏膜的溃疡性损伤病症,多见于唇内侧、舌头、舌腹、颊黏膜、前庭沟、软腭等部位,这些部位的黏膜缺乏角质化层或角化较差。可分为轻型复发性阿弗他溃疡和慢性口腔溃疡。不论性别、年龄、人种均可发生,发病时疼痛剧烈,很难根治[4]。目前口腔溃疡的病因及发病机制尚不完全清楚,经研究认为其发病原因有多种,如环境因素、遗传因素、心理因素、病毒感染、机体免疫等[5-6],多合并多种因素。由于口腔溃疡产生的因素较多,目前的治疗存在各种困难[7]。
就目前而言,基因治疗是一种尚未广泛应用又极具前景的治疗方案,可能对口腔溃疡的治疗产生革命性的变化,而bFGF是调控细胞生长、分化、凋亡和机体多种组织和器官形成的重要因子。在皮肤损伤、创面愈合中起着重要作用[8]。那么bFGF是否能促进口腔溃疡创面的愈合呢?因此,bFGF进入了我们的思考范围并引导设计了上述的对比试验,以期能发现一些与口腔溃疡相关的变化。
在创伤愈合过程中,血管再生是一个重要的环节,细胞生长因子对这一过程的发生和发展具有重要的调节作用。bFGF是一种促进细胞生长较强的多肽生长因子,不仅能够刺激内皮细胞增殖和新生血管的生成,还能促进胶原蛋白的合成,肉芽组织的生成,改变免疫应答[9]。Mullane 等[10]发现bFGF通过增加牙髓中的微血管密度,从而促进牙髓损伤的修复。Takamiya 等[11]研究锐器对皮肤损伤后,皮肤组织中出现bFGF蛋白表达,bFGF表达开始于损伤后0.5~1 h。 bFGF分布于体内多种细胞,以自分泌和旁分泌方式促进细胞自身与周围细胞的增殖、分化、蛋白质合成等[9],是最有效的促血管生长因子之一[12]; 如果bFGF的数量异常、功能紊乱,则可能会出现组织、血管、神经的修复、再生障碍,创面愈合受到抑制,而bFGF的存在,可能是口腔溃疡愈合的原因之一,所以bFGF的表达是我们关注的重点。
在本试验中观察发现,通过40%的冰醋酸烧灼兔口腔颊部成功建立兔口腔溃疡模型,并且在实验中通过使用RT-PCR、免疫组织化学等方法进行检测,从而证实口腔溃疡兔的溃疡组织中bFGF出现了明显的变化,治疗组较模型组有明显的增多,随着创面的不断愈合,表达在不断升高,说明bFGF参与了口腔溃疡创面的愈合过程。由此初步考虑如果bFGF的表达增加,从而促进组织、血管、神经等的修复和再生,而溃疡形成当天,bFGF的表达最低,机体处于损伤状态; 如果bFGF的表达持续低下,溃疡创面则得不到恢复。目前所用治疗口腔溃疡的药物存在种类繁多、治疗效果不佳、副作用大等缺点,尚无通过基因治疗口腔溃疡的药物。因此,bFGF基因表达变化的发现,可能为基础研究和临床治疗口腔溃疡提供新的药物治疗靶点[13],找到一种新的治疗手段和方向。
[1]Patton DW, Ali A, Davies R, et al. Oral rehabilitation and quality of life following the treatment of oral cancer[J]. Dent Update, 1994, 21(6): 231-234.
[2]马晓喆, 李言君, 付爱丽, 等. IFN-γ R和sIL-2R在复发性口腔溃疡患者中的表达及意义[J]. 实用口腔医学杂志,2015, 31(2): 94-97.
[3]刘敏, 邢树国, 王勤涛,等. 口腔溃疡含片治疗复发性阿弗他溃疡Ⅲ期临床试验[J]. 实用口腔医学杂志, 2010, 26(5): 664-667.
[4]李前进, 王宇翎, 尹艳艳, 等.一种简便实用的口腔溃疡实验模型[J]. 安徽医科大学学报, 2002, 37(4): 327-328.
[5]Eguia-del Valle A, Martinez-Conde-Llamosas R, López-Vicente J, et al. Salivary levels of tumour necrosis factor-alpha in patients with recurrent aphthous stomatitis[J]. Med Oral Patol Oral Cir Bucal, 2011, 16(1): e33-36.
[6]Boras VV, Lukac J, Brailo V, et al. Salivary interleukin-6 and tumor necrosis factor-alpha in patients with recurrent aphthous ulceration[J]. J Oral Pathol Med, 2006, 35(4): 241-243.
[7]Farid RM, Wen MM. Promote recurrent aphthous ulcer healing with low dose prednisolone bilayer mucoadhesive buccal film[J]. Curr Drug Deliv, 2017, 14(1): 123-135.
[8]Kirby AE, Middlebrooks JC. Unanesthetized auditory cortex exhibits multiple codes for gaps in cochlear implant pulse trains[J]. J Assoc Res Otolaryngol, 2012, 13(1): 67-80.
[9]Lucas C, Stanborough RW, Freeman CL, et al. Efficacy of low-level laser therapy on wound healing in human subjects: A systematic review[J]. Lasers Med Sci, 2000, 15(2): 84-93.
[10]Mullane EM, Dong Z, Sedgley CM, et al. Effects of VEGF and FGF2 on the revascularization of severed human dental pulps[J]. J Dent Res, 2008, 87(12): 1144-1148.
[11]Takamiya M, Saigusa K, Aoki Y. Immunohistochemical study of basic fibroblast growth factor and vascular endothelial growth factor expression for age determination of cutaneous wounds[J]. Am J Forensic Med Pathol, 2002, 23(3): 264-267.
[12]Murakami M, Simons M. Fibroblast growth factor regulation of neovascularization[J]. Curr Opin Hematol, 2008, 15(3): 215-220.
[13]Choi SM, Ryu HA, Lee KM, et al. Development of stabilized growth factor-loaded hyaluronate-collagen dressing(HCD) matrix for impaired wound healing[J]. Biomater Res, 2016, 20: 9.
