低可利用胚胎患者的胚胎移植策略
2018-03-30张文香
文 琴,姜 宏,周 云,张文香
目前,体外受精-胚胎移植(invitrofertilization and embryo transfer,IVF-ET)已成为不孕症的常规治疗手段。随着促排卵方案、培养试剂及实验室技术的不断发展与完善,IVF-ET过程中绝大多数患者均可获得一定数量的优质胚胎,但不同胚胎移植时机对妊娠结局的影响尚存争议。目前国内外多数学者多选择受精后第3天(D3)进行新鲜周期卵裂胚移植,但部分患者由于可利用胚胎数较少,培养至D3往往因胚胎发育阻滞及质量差,导致周期取消率增加,临床结局不理想[1],给患者和临床医师均带来极大的心理负担。该研究对部分低可利用胚胎患者选择D2移植,探讨其临床应用价值。
1 材料与方法
1.1病例资料选择2015年12月~2017年2月在解放军105医院生殖中心接受体外受精或卵母细胞质内单精子显微注射(invitrofertilization or intracytoplasmic sperm injection,IVF/ICSI)治疗、年龄<40岁且可利用胚胎数≤3枚的不孕患者作为研究对象,共191个周期;其中受精后D3行胚胎移植92个周期,受精后D2行胚胎移植99个周期,并对其中至少曾行1次D3移植(共50个周期)的 D2移植组(41个周期)患者进行自身前后对照,比较D3与D2移植组及D2移植与既往D3移植周期的Gn用量和天数、移植日内膜厚度、获卵数、MⅡ(metaphase Ⅱ)率、优胚率、胚胎耗损率(embryo consumption rate,ECR)、胚胎着床率、临床妊娠率、早期流产率及异位妊娠率。
1.2IVF-ET患者采用的促排卵方案包括GnRH-a长方案、短方案及拮抗剂方案;根据卵泡发育速度及血黄体生成素、雌二醇水平酌情调整Gn用量,当2个以上卵泡直径≥18 mm时皮下注射重组人绒促性素(商品名艾泽,德国默克雪兰诺公司)250 μg,36~38 h行超声引导下经阴道取卵术。2~4 h后行常规IVF或ICSI,受精后(44±1)h (D2)或(68±1)h(D3)观察并评估卵裂期胚胎。D2或D3选择2~3枚可利用胚胎进行移植,术后给予常规黄体支持。
1.3胚胎评分根据D2或D3胚胎形态和碎片将胚胎分为4级[2]:Ⅰ级,碎片<5%;Ⅱ级,5%≤碎片<20%;Ⅲ级,20%≤碎片<50%;Ⅳ级,碎片≥50%。以D2卵裂球细胞数目≥4的Ⅰ、Ⅱ级胚胎为优质胚胎,D3卵裂球细胞数目≥6的Ⅰ、Ⅱ级胚胎为优质胚胎。D2卵裂球数目≥2细胞Ⅲ级以上胚胎视为可利用胚胎,D3≥5细胞Ⅲ级以上胚胎视为可利用胚胎。ECR(%)=(卵裂数-移植数)/卵裂数×100%[3]。
1.4妊娠诊断胚胎移植后14 d血β人绒毛膜促性腺激素(beta human chorionic gonadotropin,β-HCG)≥20 mIU/ml为生化妊娠,移植后35 d左右B超下见胚囊确诊为临床妊娠,妊娠12周内的流产及胚胎停止发育诊断为早期流产。
1.5统计学处理采用SPSS 16.0统计软件包建立数据库做统计学分析。定量资料符合正态分布,组间比较采用t检验;不符合正态分布者,组间比较采用秩和检验;分类资料或率的比较采用χ2检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1患者基本情况由表1可见,两组间患者年龄、不孕年限、不孕因素、曾行IVF/ICSI次数、体重指数、基础黄体生成素(baseline luteinizing hormone,bLH)、基础雌二醇(baseline estradiol,bE2)、基础卵泡刺激素(baseline follicle-stimulating hormone,bFSH)及抗苗勒管激素(anti-Müllerian hormone,AMH)等差异均无统计学意义;但D2移植组的窦卵泡数(antral follicle count,AFC)显著低于D3移植组(P<0.05)。
2.2两组临床结局比较由表2可见,D2移植组的获卵数及ECR均显著低于D3移植组(P<0.05),且D2移植组的优胚率显著高于D3移植组(P<0.05),但Gn用量和天数、移植日内膜厚度、MⅡ率、移植胚胎数、胚胎种植率、临床妊娠率、早期流产率及异位妊娠率均与D3移植组间差异均无统计学意义。
2.3D2移植组自身对照比较由表3可见,D2移植组Gn用量、Gn天数、移植日内膜厚度、获卵数、MⅡ率、受精率、移植胚胎数及可用胚胎数与既往D3移植组差异均无统计学意义,但D2移植组的ECR及周期取消率均显著低于既往D3移植组(P<0.05),且胚胎种植率及临床妊娠率均显著高于既往D3移植组(P<0.05)。
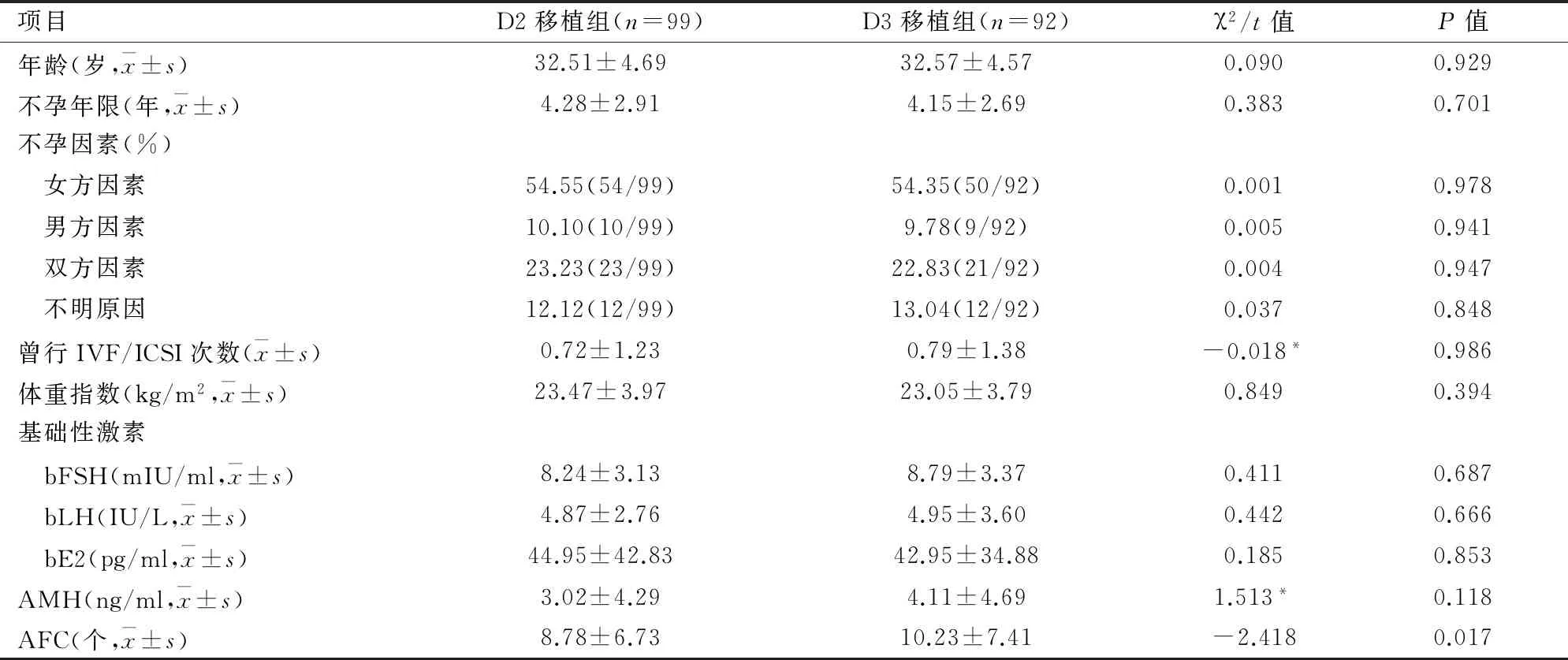
表1 两组患者一般情况的比较
注:*表示秩和检验结果Z值

表2 两组患者临床结局的比较
注:*表示秩和检验结果Z值
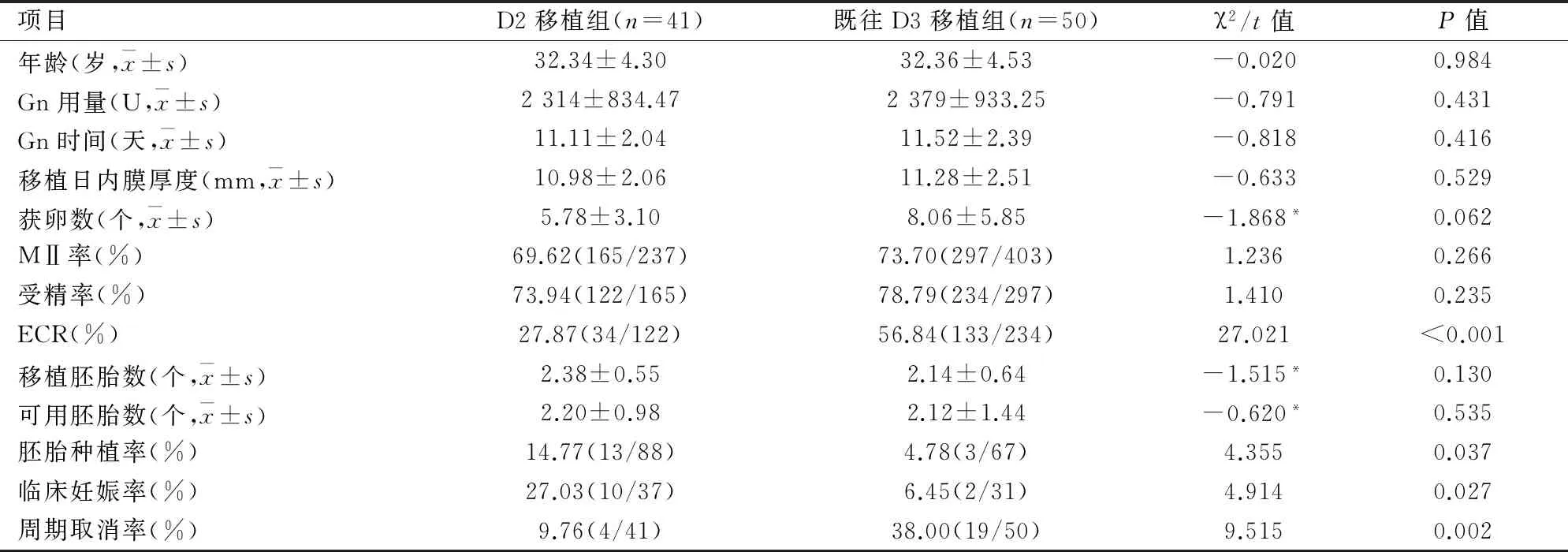
表3 患者D2周期与既往周期自身配对比较
注:*表示秩和检验结果Z值
3 讨论
在体外培养过程中胚胎发育的每一个阶段均可出现发育阻滞,因此通过延长胚胎体外培养时间从D2到D3甚至到D5可以通过胚胎的发育速度及形态学挑选出发育潜能更高的胚胎,改善临床结局[4-5]。但多数胚胎在体外培养环境下处于应激状态,只有那些适应该环境的胚胎能够存活和生长,延长胚胎体外培养时间将增加胚胎损耗,只有部分D3优质卵裂胚(30%~50%)可形成囊胚,因未获得囊胚或囊胚质量差导致的周期取消率增高,故囊胚移植多适用于D3优质卵裂胚较多的患者[6-7]。鉴于胚胎发育阻滞多发生于8细胞前阶段,延长体外培养时间有助于选择发育潜能更高的胚胎,且受精后D3移植胚胎较D2更接近胚胎进入子宫的生理时间,获得更高的种植率,故目前多数学者在新鲜周期仍选择在受精后D3进行胚胎移植[1,8]。
由于人类胚胎在8细胞以前的卵裂取决于卵细胞的质量并受母方贮存信息的控制,而8细胞之后胚胎本身的基因组转录被激活,控制胚胎的进一步发育,因此,无论是D2还是D3胚胎,胚胎基因组都尚未完全启动,D3胚胎优化筛选效果值得怀疑。有研究[9-11]显示,延长培养时间从D2至D3,胚胎评分明显降低,且多核卵裂球明显增多,而多核卵裂球的染色体异常率明显增高,种植率明显降低。另有研究[12-14]显示,D3移植虽有更高的妊娠率,但流产率也相应增加,其活产率低于D2移植组,且将体外发育欠佳的胚胎提前移入体内可改善其发育潜能,表明子宫才是维持胚胎生长发育的最佳环境[9]。此外,体外培养时间与胚胎透明带、表观遗传学及新生儿性别比的改变密切相关[15]。
在IVF促排卵过程中常由于高龄、卵巢低储备及反应性降低、促排卵方案或Gn剂量不足等因素导致获卵数较少,按国家卫生部176号文件(2003)限定的胚胎移植数,在D2移植后并无多余胚胎可供进一步培养、筛选。体外培养环境与体内环境尚存在某些未知的差异,延长胚胎体外培养时间将降低胚胎的发育潜能,增加胚胎损耗率,减少可移植胚胎数[16]。此外,在胚胎体外培养过程中,胚胎对pH值、温度、渗透压、电解质、必需氨基酸、微量元素、能源物质及多种生长因子十分敏感,任何细微的变化都可能导致胚胎损伤,影响其发育潜能,增加胚胎损耗率。因此,延长胚胎体外培养时间并不适用于所有患者,尤其获卵数及可利用胚胎少的患者[16]。Shen et al[7]的结果表明,对于<40岁且D2移植后无剩余胚胎的患者,选择D2移植可降低流产率,提高持续妊娠率。Bahceci et al[16]的RCT研究也证实,对于卵巢低反应患者,选择D2移植其临床妊娠率显著高于D3移植。本研究结果也证实,对<40岁且D2无多余可利用胚胎的患者(≤3枚)选择D2进行全胚胎移植,在卵巢储备及获卵数均显著低于D3移植组的条件下,显著降低了ECR,获得了与D3移植相似的临床结局,再次证实延长胚胎体外培养时间,增加了胚胎损耗,并不能改善临床结局。通过对D2周期与既往D3移植周期自身配对研究,本研究显示D2移植周期在获卵数显著低于既往 D3移植周期的条件下,ECR及周期取消率均显著降低,而胚胎种植率和临床妊娠率显著增高,表明对于D2无多余可移植胚胎(≤3枚胚胎)的患者,选择D2全胚胎移植,可降低ECR及周期取消率,获得更好的临床结局。
[1] 马丽影,李朋粉,项云改,等. D2/D3移植对体外受精-胚胎移植周期妊娠结局的影响[J].生殖医学杂志,2012,21(2):154-7.
[2] Johansson M,Hardarson T,Lundin K. There is a cutoff limit in diameter between a blastomere and a small anucleate fragment[J].J Assist Reprod Genet,2003,20(8):309-13.
[3] 刘 敬,贾 研,耿丽红,等.体外受精—胚胎移植技术中高龄妇女的移植策略的选择[J]. 生殖医学杂志,2013,22(6):426-9.
[4] Blake D A,Proctor M,Johnson N P. The merits of blastocyst versus cleavage stage embryo transfer:a cochrane review[J]. Hum Reprod,2004,19(4):795-807.
[5] 偶 健,王 玮,马燕琳,等. 囊胚培养在植入前遗传学诊断中的价值[J]. 中华医学遗传学杂志,2015,32(3):312-7.
[6] Behr B,Pool T B,Milki A A,et al.Preliminary clinical experience with human blastocyst developmentinvitrowithout co-culture[J]. Hum Reprod,1999,14(2):454-7.
[7] Shen S,Rosen M P,Dobson A T,et al. Day 2 transfer improves pregnancy outcome ininvitrofertilization cycles with few available embryos[J].Fertil Steril,2006,86(1):44-50.
[8] 陈京京,姜 宏,李 攀. 冻融周期囊胚移植的临床价值[J]. 重庆医学,2014,43(34):4610-2.
[9] Laverge H,De Sutter P,Van der Elst J,et al. A prospective,randomized study comparing day 2 and day 3 embryo transfer in human IVF[J]. Hum Reprod,2001,16(3):476-80.
[10] Pickering S J,Taylor A,Johnson M H,et al. An analysis of multinucleated blastomere formation in human embryos[J]. Hum Reprod,1995,10(7):1912-22.
[11] Pelinck M J,De Vos M,Dekens M,et al. Embryos culturedinvitrowith multinucleated blastomeres have poor implantation potential in humaninvitrofertilization and intracytoplasmic sperm injection[J]. Hum Reprod,1998,13(4):960-3.
[12] Gunby J L,Daya S,Olive D,et al. Day three versus day two embryo transfer followinginvitrofertilization or intracytoplasmic sperm injection[J].Cochrane Database Syst Rev,2004(2):CD004378.
[13] Mahdavi A, Qashqaei A, Aleyasin A,et al.Embryo transfer in days 2 to 4 following intracytoplasmic sperm injection:a prospective cohort study[J]. Med J Islam Repub Iran,2015,29:262.
[14] 顾亦凡,陆长富,龚 斐,等.人类发育欠佳胚胎在卵裂期及囊胚期移植后的临床结局比较[J].中国现代医学杂志,2013,23(17):67-71.
[15] 马黔红.辅助生殖技术的新进展[J].中国计划生育和妇产科,2017,9(1):4-7.
[16] Bahceci M,Ulug U,Ciray H N,et al.Efficiency of changing the embryo transfer time from day 3 to day 2 among women with poor ovarian response:a prospective randomized trial[J]. Fertil Steril,2006,86(1):81-5.
[17] Behr B,Wang H. Effects of culture conditions on IVF outcome[J]. Eur J Obstet Gynecol Reprod Biol,2004,115(Suppl 1):S72-6.
