AQP8在胰腺导管腺癌中的表达及其临床意义
2018-03-30赵金钱方恒忠杨旭东朱兴兴胡丕波
赵金钱,陈 炯,方恒忠,杨旭东,朱兴兴,胡丕波
胰腺导管腺癌是最常见病理类型的胰腺癌,占胰腺癌患者的85%以上。胰腺癌具有发病症状隐蔽、早期病灶易出现周围组织浸润和远处器官转移、恶性程度极高、放化疗不敏感等重要的临床及生物学特点,到目前为止,根治性肿瘤切除手术治疗是胰腺癌患者长期存活唯一有效可行的方法,但是此病患者临床确诊时多数已处于中晚期阶段,丧失根治肿瘤手术时机,故该病根治性手术切除率较低、预后极差。而现有的最为广泛使用的胰腺癌早期筛查肿瘤标志物糖抗原CA19-9(Carbohydrate atigen 19-9, CA19-9)在胰腺癌早期阶段常处于正常水平,它并非是胰腺癌特异性肿瘤标志物,在肝胆胰其他类疾病中也可能升高,且胰腺癌中3%~7%的患者为Lewis抗原阴性血型结构,不表达CA19-9,因此在诊断胰腺癌方面,其敏感性和特异性并非理想,早期诊断价值有限,多用于监测胰腺癌术后肿瘤复发、转移或疗效评估。至今为止,该病的早期诊断仍缺乏特异性及敏感性均较高的肿瘤标志物,寻找胰腺癌潜在的肿瘤标志物尤为关键。水通道蛋白家族(aquaporins, AQPs)是一组选择性跨膜转运水分子的膜蛋白,即AQP0-AQP12,AQPs直接参与人类多种肿瘤的发生与发展[1-3],水通道蛋白8(aquaporins8, AQP 8)是AQPs成员之一,但其表达与胰腺癌的临床资料关系国内外鲜有报道,本课题组从AQP8的转录及蛋白质表达水平研究其在胰腺癌组织中的表达,探究其与胰腺导管腺癌临床病理资料的相关关系。
1 材料与方法
1.1病例资料收集安徽医科大学附属省立医院普外科收治行根治性手术切除,并经病理证实为胰腺导管腺癌患者的石蜡包埋的胰腺导管腺癌癌组织(pancreatic duct adenocarcinoma tissue, PC)及其相配对的癌旁正常胰腺组织(non-carcinoma adjacent tissues of pancreatic carcinoma, Non-PC)(距肿瘤组织边缘>2 cm)各87 例(2010年1月~2013年12月)以及连续10例根治性手术切除患者的配对新鲜PC、Non-PC(2016年8月~12月),-80 ℃冻存备用。被研究者临床资料完整,术前均无放化疗。 87 例患者中:男51例,女36例;年龄41~85(63.36±11.48)岁,< 60岁25例,≥60岁62例;胰头部癌63例,胰体尾部癌24例;高分化18例,中低分化69例;直径<2 cm者23例,≥2 cm的64例;TNM分期Ⅰ期40例,Ⅱ期47例;淋巴结转移47例,未转移40例;神经侵犯38例,未被侵犯49例。本研究得到患者的知情同意及医院伦理委员会的批准。
1.2主要试剂TRIzol试剂(美国Invitrogen公司);逆转录试剂盒(美国Thermo公司);AQP8一抗(英国Abcam公司);二抗、免疫组化(immunohistochemistry,IHC)试剂盒(北京中杉金桥生物技术有限公司)。
1.3方法
1.3.1qRT-PCR 分别取PC及Non-PC各50 mg,提取总RNA并作为模板反转录生成cDNA进行qRT-PCR。以GAPDH作为内参照,F:5′-GGGAAATCGTGCGTGACATTAAGG-3′,R:5′-CAGGA AGGAAGGCTGGAAGAGTG-3′,产物大小180 bp;AQP8引物序列,F:5′-GCCTGCTTGTTGGACTGCTC-3′,R:5′-GGAATCCCACGAGCTCTGCT-3′,产物大小94 bp。
1.3.2Western blot 分别将PC及Non-PC充分裂解测总蛋白浓度。上样量各为 50 μl,经变性、电泳、转膜、封闭后,加入稀释一抗(1 ∶1 000),孵育洗涤后加入稀释二抗(1 ∶5 000),显色、定影后观察。
1.3.3IHC 石蜡包埋标本3 μm连续切片,脱蜡、抗原修复后滴加3% H2O2;滴加一抗稀释液(1 ∶200),4 ℃过夜,复温后加入二抗,最后显色、封片。评估标准采用半定量评分法[4](即低倍镜视野下阳性着色细胞百分比及着色程度来进行评分),如下方式分别记分:视野中无染色细胞及染色细胞占视野细胞的1%~10%、11%~50%、>50%分别记为0~3分;切片基本未着色、淡黄色、黄色、棕黄色分别计0~3分,每张切片有两名有经验的病理科医师共同评分,2项得分乘积≥4即定为阳性表达。
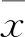
2 结果
2.1PC、Non-PC中AQP8的mRNA表达采用qRT-PCR方法分别检测配对的PC及Non-PC各10例,平均表达水平分别为(16.276±9.190)、(5.847±3.757),AQP8 mRNA 的平均表达量范围分别为 (7.57~32.79)、(1.24~12.00)。PC组 AQP8 mRNA 的表达水平明显高于Non-PC组,差异有统计学意义(t=3.570,P<0.01)。见图1。
2.2PC、Non-PC中AQP8的表达
2.2.1Western blot检测AQP8的表达情况 分别检测PC及Non-PC各10 例,有8例(80%)PC组AQP8的表达明显高于Non-PC组,Non-PC组表达水
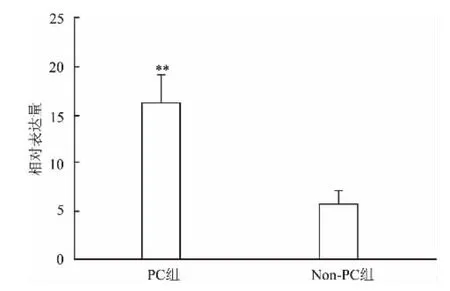
图1 两组中AQP8 mRNA表达水平比较与Non-PC组比较:**P<0.01
平均较低,PC组AQP8平均灰度值为(1.04±0.31),显著高于Non-PC组(0.31±0.13),差异有统计学意义(t=8.426,P<0.001)。见图2。

图2 两组中AQP8的表达水平A:PC组;B:Non-PC组
2.2.2IHC检测AQP8的表达 检测87例PC及相配对的Non-PC,结果显示AQP8主要表达于PC导管细胞的细胞质中,PC组AQP8阳性表达的有69例(79.31%),高于Non-PC组(18.39%),差异有统计学意义(χ2=64.609,P<0.001)。见图3。

图3 AQP8在两组中的表达 × 400A:PC组;B:Non-PC组
2.3AQP8与胰腺导管腺癌患者临床病理资料间的关系IHC显示,AQP8的表达与胰腺导管腺癌的瘤体直径、分化程度、淋巴结转移及TNM分期均有显著相关性(P<0.001)。而与患者其他临床资料之间差异无统计学意义。见表1。

表1 AQP8表达与胰腺导管腺癌临床病理特征的相关性
3 讨论
AQP8是由261个氨基酸编码的水通道细胞质膜蛋白,AQP8在维持细胞和组织器官水电解质平衡方面起重要作用。而AQP8在胰腺导管腺癌的细胞定位与病理生理功能仍鲜为人知,本研究通过IHC检测87例PC与Non-PC中AQP8的表达,结果表明AQP8在PC中强阳性表达,Non-PC导管细胞中几乎不表达,Non-PC腺泡及胰岛细胞团中弱表达,AQP8主要表达于PC导管细胞的细胞质中,且本研究显示AQP8的表达与胰腺导管腺癌的瘤体直径、分化程度、淋巴结转移及TNM分期均有显著相关性,而与患者其他临床资料之间无显著相关性。虽然AQP8在Non-PC腺泡细胞及胰岛细胞团有一定表达,但进一步Western blot及qRT-PCR表明该蛋白质及其mRNA在PC中显著高表达,而Non-PC呈现低表达状态。这提示AQP8在PC中的强阳性表达可能与胰腺导管腺癌的发病原因存在一定的相关性,AQP8的检测有助于评估胰腺导管腺癌的临床病情,是新的胰腺导管腺癌早期诊断蛋白质肿瘤标志物。
AQP8与多种肿瘤的发生发展联系密切。Zhu et al[5]利用免疫组化等方法研究了AQP8在脑星形细胞瘤中表达情况,结果表明AQP8主要表达于脑星形细胞瘤的细胞质中,在高级别星形胶质细胞瘤特别是恶性胶质瘤中显著高表达,这提示AQP8在星形细胞瘤的分化方面起重要作用,可能是星形细胞瘤的一个生物标志物及治疗靶点。Chang et al[6]研究了细胞外信号转导激酶1/2(Erk1/2)及AQP8在宫颈上皮内瘤变、宫颈癌中的表达,结果显示在上述两种组织中Erk1/2及AQP8均较正常宫颈组织显著高表达,而Erk1/2及AQP8的高表达在宫颈上皮内瘤变转变成宫颈癌的过程中起着重要作用,且AQP8的高表达与宫颈癌细胞浸润深度存在相关性,AQP8有可能成为宫颈癌早期诊断潜在的分子标志物。而进一步的以慢病毒为载体通过基因转染方法提高宫颈癌Siha细胞AQP8基因的表达,能增加癌细胞侵袭和局部浸润的能力,进一步揭示了AQP8在肿瘤发生发展中的作用[7]。
AQP8能调整细胞跨膜转运和细胞内线粒体的渗透压及体积变化,Marchissio et al[8]研究发现肝癌 HepG2 细胞系线粒体AQP8能促进线粒体中H2O2的释放,而敲除肝癌细胞线粒体AQP8基因,导致线粒体内H2O2堆积及线粒体功能失调,线粒体及肝癌细胞失去了生存能力,进而引起肝癌细胞坏死而非正常凋亡,这个发现可能对于肝癌细胞的化疗提供新的思路。而AQP8在胰腺导管腺癌组织中显著高表达,也可通过类似调控AQP8的基因表达进一步探索胰腺导管腺癌治疗新策略,因此AQP8有可能成为潜在的胰腺导管腺癌生物治疗靶点。这些文献实验结果都表明AQP8在肿瘤细胞中高表达,有可能成为新的肿瘤诊断与治疗的标志物。
上皮细胞-间充质转化(epithelial mesenchymal transition,EMT)在肿瘤的发生发展过程中发挥重要作用,与肿瘤的侵袭转移关系密切。最新的一项实验研究[3]表明在发生转移的结肠癌组织中AQP8高表达,并且AQP8可以促使EMT的发生,上皮类肿瘤细胞向间质细胞转化,进一步过表达AQP8细胞实验显示,实验组肿瘤细胞穿膜数显著高于对照组(88.0±7.2vs51.6±4.0),这项研究[3]结果提示AQP8可能是通过促进肿瘤细胞EMT的发生,从而加速肿瘤细胞向周围组织扩散和远处转移。
而Wang et al[9]利用IHC方法研究AQP8在结直肠癌组织与癌旁正常组织中的表达情况,结果表明AQP8主要表达于癌旁正常组织,癌组织无明显表达。此实验结果与本文AQP8在PC中高表达而在Non-PC中弱表达截然相反。
综上所述,PC中高表达的AQP8与瘤体直径、分化程度、淋巴结转移及TNM分期显著相关,这揭示了AQP8与胰腺导管腺癌的发生发展关系紧密,其病理切片IHC检测有助于本病患者病情评估,可能是筛查早期胰腺导管腺癌的蛋白质肿瘤标志物,但其在胰腺导管腺癌发生发展中的具体机制目前尚未清楚,可能与AQP8能促进EMT的发生有关。后期课题组将会使用细胞转染及基因敲除技术,进一步探究并阐述AQP8在胰腺导管腺癌发生发展中的作用。
[1] Ma J, Zhou C, Yang J, et al. Expression of AQP6 and AQP8 in epith elial ovarian tumor[J]. J Mol Histol, 2016, 47(2): 129-34.
[2] Shen Q, Lin W, Luo H, et al. Differential expression of aquaporins in cervical precursor lesions and invasive cervical cancer[J]. Reprod Sci, 2016, 23(11): 1551-8.
[3] 朱 旭, 刘颜良, 孟 阳, 等. 水通道蛋白8对结肠癌细胞侵袭转移的影响[J]. 腹部外科, 2017, 30(1): 65-8.
[4] Chen J, Xu H, Zhu X X. Abnormal expression levels of sMICA and NKG2D are correlated with poor prognosis in pancreatic cancer[J]. Ther Clin Risk Manag, 2015, 12: 11-8.
[5] Zhu S J, Wang K J, Gan S W, et al. Expression of aquaporin8 in human astrocytomas: Correlation with pathologic grade[J]. Biochem Biophys Res Commum, 2013, 440(1): 168-72.
[6] Chang H, Shi Y, Tuokan T, et al. Expression of aquaporin 8 and phosphorylation of Erk1/2 in cervical epithelial carcinogenesis: correlation with clinicopathological parameters[J]. Int J Clin Exp Pathol, 2014, 7(7): 3928-37.
[7] Shi Y H, Rehemu N, Ma H, et al. Increased migration and local invasion potential of SiHa cervical cancer cells expressing Aquaporin 8[J]. Asian Pac J Cancer P, 2013, 14(3): 1825-8.
[8] Marchissio M J, Francés D E, Carnovale C E, et al. Evidence for necrosis, but not apoptosis, in human hepatoma cells with knockdown of mitochondrial aquaporin-8[J]. Apoptosis, 2014, 19(5): 851-9.
[9] Wang W, Li Q, Yang T, et al. Expression of AQP5 and AQP8 in human colorectal carcinoma and their clinical significance[J]. World J Surg Oncol, 2012, 10: 242.
