ADAMDEC1对人脑胶质瘤U87细胞生物学行为的影响
2018-03-30郑晓梅刘学良何济民陈礼刚
黄 浩,郑晓梅,刘学良,徐 斌,张 烨,何济民,江 涌 ,陈礼刚,刘 亮
胶质瘤是发生于神经外胚层的肿瘤,占颅内肿瘤的35%~60%,是威胁人类健康的主要恶性肿瘤之一[1]。目前治疗方法以手术治疗为主,辅以放化疗,但手术切除肿瘤后并发症多且重,并且血脑屏障的存在阻止了绝大多数化疗药物进入脑组织,在颅内难以达到有效药物浓度,且常见化疗药物毒性太大,难以达到既消灭胶质瘤又不损伤正常组织的效果,故患者平均生存期通常较短[2]。因此,探索胶质瘤新的有效治疗手段对提高胶质瘤患者的生存质量有重要实际意义。该研究通过体外培养恶性胶质瘤细胞U87MG,并抑制解聚素金属蛋白酶家族癸蛋白1(ADAMDEC1)的表达,探究ADAMDEC1对U87细胞增殖、侵袭、迁移、黏附和凋亡等生物学行为的影响,以期为脑胶质瘤的治疗提供实验基础。
1 材料与方法
1.1细胞及主要试剂人脑胶质瘤U87细胞株购自中国科学院上海细胞库,携带下调ADAMDEC1表达的特异性siRNA(ADAMDEC1-RNAi)的慢病毒及其阴性对照(CONTROL-RNAi)慢病毒购自上海吉凯基因化学技术有限公司。ADAMDEC1-RNAi序列如下:TCCCAGGAATCTTGTGAATTT;CONTROL-RNAi序列如下:TTCTCCGAACGTGTCACGT。新生胎牛血清(FBS)购自杭州四季青生物技术公司;细胞培养液高糖型DMEM购自美国Hyclone公司;Metrigel、流式细胞凋亡检测试剂盒购自美国BD公司;CCK-8试剂购自上海东仁化学科技有限公司;总RNA抽提试剂盒购自上海普飞公司;cDNA反转录试剂盒(M-MLV)购自美国Promega公司;Real-time PCR试剂盒购自广州锐博生物科技有限公司;ADAMDEC1一抗(小鼠)购自英国Abcam公司;GAPDH一抗(兔)购自英国CST公司;二抗(羊抗鼠、羊抗兔)均购自BIOSWAMP公司;Transwell小室购自美国Corning公司。
1.2方法
1.2.1细胞培养及转染 人脑胶质瘤U87细胞株接种在含10% FBS的高糖型DMEM培养液(完全培养基)中,置于37 ℃、5%CO2的培养箱中常规培养,隔2~3 d更换培养基,3~5 d细胞传代。处于增殖期的U87细胞,胰蛋白酶消化后接种于6孔板中继续培养,当细胞密度达20%~30%时换液,加入完全培养基1 ml,加入用Enhanced Infection Solution稀释成1×108TU/ ml的病毒液40 μl,确保复感染指数(multiplicity of infection, MOI)值为20,再加入5 μg Polybrene,轻微晃动混匀后,置于培养箱中培养16 h后再次换液,加入完全培养基2 ml,继续培养56 h。
1.2.2ADAMDEC1 mRNA表达水平的检测 收集稳定转染的人脑胶质瘤U87细胞,TRIzol裂解后,抽提总RNA样品、反转录获得cDNA等操作方法均严格遵照试剂盒说明书进行,后用Real-time PCR(两步法)检测ADAMDEC1基因mRNA的表达情况,其上游引物序列为:AGATCCACGACCATGCTCAG;其下游引物序列为:GCCTCAATAACAGCAACCGA;GAPDH上游引物序列为:TGACTTCAACAGCGACACCCA;下游引物序列为:CACCCTGTTGCTGTAGCCAAA。通过计算2-ΔΔCt来检测ADAMDEC1基因的相对表达水平。
1.2.3ADAMDEC1蛋白表达水平的检测 收集稳定转染的人脑胶质瘤U87细胞,4 ℃裂解细胞,95 ℃以上加热10 min,11 000 r/min离心10 min,取上清液-20 ℃冻存。制胶,上样蛋白,SDS-PAGE凝胶电泳(80 V 40 min、120 V 50 min),转膜(90 V 45 min),5%脱脂奶粉室温封闭2 h,ADAMDEC1鼠抗人一抗单克隆抗体(1 ∶1 000)4 ℃振荡孵育过夜,羊抗鼠二抗(1 ∶10 000)室温下孵育2 h,曝光成像,应用软件Quantity-one分析灰度值。同时测定内参GAPDH的表达。
1.2.4CCK-8法检测细胞增殖 制备未转染U87细胞悬液,以每孔100 μl含4×103个细胞接种于96孔板,待细胞贴壁后,按1.2.1中细胞转染方法转染细胞,16 h后更换为普通完全培养基。于16、24、36、48、60、72 h分别更换为普通完全培养基,每孔加入10 μl CCK-8试剂,培养箱中孵育1 h,用分光光度计测定450 nm波长处各孔吸光度(OD值)。实验重复3次。
1.2.5CCK-8法检测细胞黏附 本实验Metrigel基质胶用无血清高糖型DMEM培养基进行稀释,稀释比例为1 ∶8,稀释后加入96孔板(100 μl/孔)包被基底膜,封口膜密闭后超净工作台中过夜,过夜后吸出孔板内多余的液体,每孔加入50 μl无血清冷DMEM,培养箱内孵育30 min,使基底膜充分水化。稳定转染后的细胞以胰蛋白酶消化,计数并调整细胞浓度,以每孔100 μl含4×103个细胞接种到前述制备好的96孔板中,培养箱中培育3 h,弃去培养基,PBS冲洗2遍,每孔加入90 μl培养基及10 μl CCK-8试剂,继续培养2 h,用分光光度计测定450 nm波长处各孔吸光度(OD值)。实验重复3次。
1.2.6Transwell体外侵袭实验 本实验Metrigel基质胶用无血清高糖型DMEM培养基进行稀释,稀释比例为1 ∶5,取50 μl均匀涂于上室细胞生长表面,37 ℃孵育2 h,吸出上室内多余的液体,加入50 μl无血清DMEM,培养箱内孵育30 min,使基底膜充分水化。胰蛋白酶消化稳定转染的细胞,收集制备细胞悬液,离心后弃去上层培养液,PBS液洗涤2次,无血清DMEM重悬细胞,计数并调整细胞浓度,以每孔100 μl含1×104个细胞加入上室内,下室加入500 μl含15% FBS的新配制的完全培养基。培养箱中培育36 h,取出上室,湿棉签轻轻擦净上室内面Metrigel基质胶及未穿过基底膜的细胞,将上室置于4%多聚甲醛溶液中固定15 min,后再用0.1%结晶紫溶液室温下染色15 min,PBS液清洗3次。Transwell小室轻置于载玻片上,显微镜下观察拍照,随机选取10个200×视野进行细胞计数。实验重复3次。
1.2.7Transwell体外迁移实验 胰蛋白酶消化稳定转染的细胞,收集制备细胞悬液,离心后弃去上层培养液,PBS液洗涤2次,无血清DMEM重悬细胞,计数并调整细胞浓度,以每孔 100 μl含1×104个细胞加入Transwell上室,下室加入500 μl含15% FBS的新配制的完全培养基。培养箱中培育12 h,取出上室,湿棉签轻轻擦净上室内面未穿过基底膜的细胞,染色、拍照方法同侵袭实验。实验重复3次。
1.2.8流式细胞术检测细胞凋亡 用不含EDTA的胰蛋白酶消化处于对数生长周期的稳定转染的细胞,无菌胶头滴管轻轻吹打,尽可能使其分散为单个细胞,1000 r/min离心5 min后弃去上层培养基,PBS液洗涤2次,遵照流式细胞凋亡检测试剂盒说明书添加试剂制备样品,流式细胞仪检测细胞凋亡率。
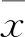
2 结果
2.1细胞转染效率ADAMDEC1-RNAi及其阴性对照CONTROL-RNAi分别转染U87细胞,转染72 h后观察GFP表达情况,荧光率达95%以上,见图1。

图1 U87细胞的转染效率 ×100A:明视野;B:绿色荧光视野
2.2ADAMDEC1基因沉默情况ADAMDEC1-RNAi转染U87细胞后,其细胞内ADAMDEC1 mRNA表达量较其对照CONTROL-RNAi转染U87细胞后明显降低(t=14.611,P<0.01),见图2。
2.3ADAMDEC1蛋白沉默情况ADAMDEC1-RNAi转染U87细胞后,其细胞内ADAMDEC1蛋白表达量较其对照CONTROL-RNAi转染U87细胞后明显降低(t=12.517,P<0.01),见图3。
2.4ADAMDEC1基因沉默表达对U87细胞增殖能力的影响CCK-8法检测结果显示:ADAMDEC1-RNAi组细胞的增殖抑制在转染的第16 h后开始出现,较CONTROL-RNAi组差异有统计学意义(t=7.478、7.753、8.862、5.592、9.002,P<0.05),见图4。

图2 Real-time PCR检测转染后U87细胞ADAMDEC1 mRNA的表达变化与CONTROL-RNAi组比较:**P<0.01
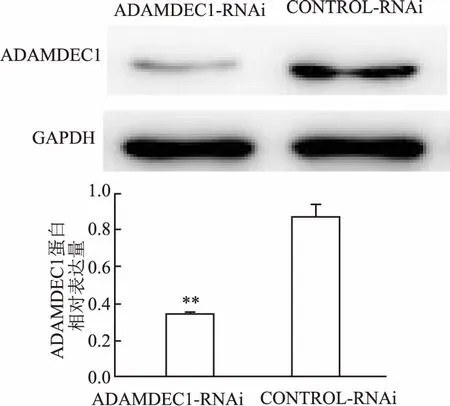
图3 Western blot检测转染后U87细胞ADAMDEC1蛋白的表达变化与CONTROL-RNAi组比较:**P<0.01
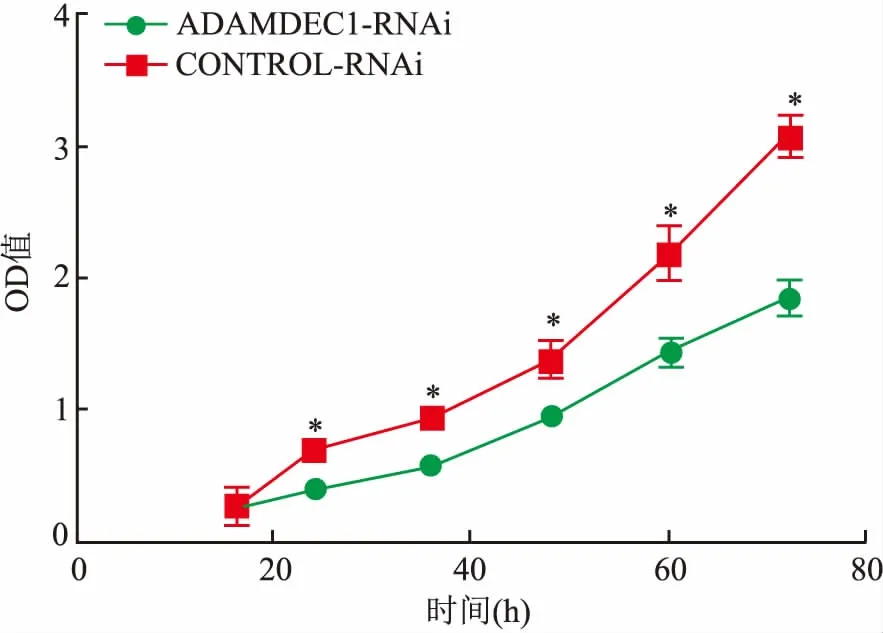
图4 CCK-8法检测ADAMDEC1-RNAi转染后U87细胞的增殖变化与CONTROL-RNAi组比较:*P<0.05
2.5ADAMDEC1基因沉默表达对U87细胞黏附能力的影响CCK-8法检测结果显示:ADAMDEC1-RNAi组细胞的黏附能力较CONTROL-RNAi组差,差异有统计学意义(t=12.697,P=0.006),见图5。

图5 CCK-8法检测ADAMDEC1-RNAi转染后U87细胞的黏附能力变化与CONTROL-RNAi组比较:**P<0.01
2.6ADAMDEC1基因沉默表达对U87细胞体外侵袭能力的影响实验采用Matrigel包被Transwell上室基底膜,通过检测穿过基底膜的U87细胞数量来证明侵袭能力的变化。结果显示:ADAMDEC1-RNAi转染细胞后,细胞水解Matrigel穿过基底膜的数量较CONTROL-RNAi转染组明显减少,差异有统计学意义(t=5.263,P=0.001),见图6、7。
图6 穿过Transwell上室基底膜到达下室的细胞结晶紫染色×100A:ADAMDEC1-RNAi;B:CONTROL-RNAi
2.7ADAMDEC1基因沉默表达对U87细胞体外迁移能力的影响实验采用Transwell小室检测U87细胞的迁移能力。结果显示:ADAMDEC1-RNAi转染细胞后,细胞穿过小室基底膜的数量较CONTROL-RNAi转染组明显减少,差异有统计学意义(t=9.189,P<0.01),见图8、9。
2.8ADAMDEC1基因沉默表达对U87细胞凋亡的影响细胞转染后,流式细胞术检测结果显示:ADAMDEC1-RNAi转染组的细胞凋亡率较CONTROL-RNAi转染组明显增高,差异有统计学意义(t=43.737,P=0.001),见图10、11。

图7 ADAMDEC1-RNAi转染后U87细胞的侵袭能力受到抑制与CONTROL-RNAi组比较:**P<0.01

图8 穿过Transwell上室基底膜到达下室的细胞 结晶紫染色 ×100A:ADAMDEC1-RNAi;B:CONTROL-RNAi

图9 ADAMDEC1-RNAi转染后U87细胞的迁移能力受到抑制与CONTROL-RNAi组比较:**P<0.01

图10 转染后U87细胞的凋亡情况(UR+LR)A:ADAMDEC1-RNAi;B:CONTROL-RNAi

图11 ADAMDEC1-RNAi转染后U87细胞的凋亡增加与CONTROL-RNAi组比较:**P<0.01
3 讨论
神经胶质瘤大多数起源于不同类型的神经胶质,WHO中枢神经系统肿瘤分类根据肿瘤的恶性形态学特征(细胞性质、核分裂、核异型、微血管增殖和坏死等)分为四级,其中三级、四级为高度恶性肿瘤,即便使用手术、放射治疗及化学药物治疗的综合治疗措施,目前仍无法治愈该疾病。因此,有必要进一步探索影响胶质瘤细胞生物学行为的新因素及其可能的作用机制。
恶性肿瘤侵袭、迁移是对生命最具威胁的因素。去整合素—金属蛋白酶(a disintegrin and metalloproteinase,ADAM)家族含有金属蛋白酶和去整合素功能结构域,ADAM可通过去整合素结构域结合整合素,从而能参与细胞—细胞的粘连作用,可降解细胞外基质(ECM),直接黏附ECM并参与调节细胞内外信号通路,降解ECM及基膜,影响细胞与基底膜的相互作用,可对细胞的分化、极性、迁移、增殖等进行调节,降低细胞的凋亡比率[3]。
目前已有研究[4]表明在多种不同类型的恶性肿瘤中,某些ADAM 家族成员表达量增多,如:正常细胞中ADAM 17表达量很少,但在肝癌、胃癌、食管鳞癌、卵巢癌、前列腺癌等人类多种常见恶性肿瘤中表达量明显增高[5-7]。此外, ADAM17的表达量与胶质瘤的恶性程度呈正相关已被研究[8]所证实。ADAMDEC1(ADAM-like,Decysin 1)属于ADAM的另一成员,研究[9]显示人的ADAMDEC1 基因位于 8p12 染色体上,ADAMDEC1具有整联蛋白、金属内肽酶结合的活性,调控细胞附着,整联蛋白介导信号转导途径,参与蛋白水解。同时促进细胞膜中的多种蛋白及细胞外基质、基膜降解,破坏阻止肿瘤细胞侵袭的组织学屏障,对恶性肿瘤的侵袭、迁移等生物学行为起重要的作用[10]。从而可推测ADAMDEC1 基因可能参与了体内肿瘤的侵袭和转移等过程,并有可能成为监测疾病活动的指标,甚至是靶向治疗的靶点。相关研究[11]显示,ADAMDEC1基因在颅咽管瘤中处于高表达状态,且在釉质上皮型及复发的颅咽管瘤中尤其明显,其在肿瘤的发生和发展过程中发挥着重要而复杂的作用。课题组前期研究[12]已经证明ADAMDEC1在高级别胶质瘤中高度表达,对胶质瘤患者术后进行随访,提示胶质瘤组织中ADAMDEC1含量高的胶质瘤恶性程度高,同时患者预后差。说明ADAMDEC1与胶质瘤的恶性程度密切相关。
为进一步探讨ADAMDEC1在胶质瘤发生、进展中的作用,本研究采用慢病毒转染技术特异性抑制U87细胞中ADAMDEC1基因的表达。实验组与对照组进行对比,CCK-8检测提示下调ADAMDEC1表达能够显著抑制U87细胞的增殖和黏附能力;Transwell检测提示下调ADAMDEC1表达能够显著抑制U87细胞的侵袭和迁移能力;流式细胞技术检测提示下调ADAMDEC1表达能够促进U87细胞的凋亡。
综上所述,体外细胞实验显示ADAMDEC1蛋白与U87细胞的恶性生物学行为密切相关。即ADAMDEC1通过促进U87细胞的增殖、黏附、侵袭和迁移能力,抑制U87细胞的凋亡而实现对肿瘤发生、发展的调控,但具体作用机制尚待进一步研究明确,因此ADAMDEC1有望成为胶质瘤基因治疗的潜在靶位。
[1] Jovcevska I, Kocevar N, Komel R.Glioma and glioblastoma-how much do we (not) know?[J].Mol Clin Oncol,2013,1(6): 935-41.
[2] Nobusawa S, Hirato J, Yokoo H. Molecular genetics of ependymomas and pediatric diffuse gliomas:a short review[J]. Brain Tumor Pathol, 2014,31(4): 229-33.
[3] Walker J L,Fournier A K,Assoian R K. Regulation of growth factor signaling and cell cycle progression by cell adhesion and adhesion dependent changes in cellular tension[J].Cytokine Growth Factor Rev,2005,16(5): 395-405.
[4] Wu K, Liao M, Liu B, et al. ADAM-17 over-expression in gallbladder carcinoma correlates with poor prognosis of patients[J].Med Oncol,2011,28(2): 475-80.
[5] Gao M Q, Kim B G, Kang S, et al. Human breast cancer-associated fibroblasts enhance cancer cell proliferation through increased TGF-α cleavage by ADAM17[J].Cancer Lett, 2013,336(1): 240-6.
[6] Ni S S, Zhang J, Zhao W L, et al. ADAM17 is overexpressed in non-small cell lung cancer and its expression correlates with poor patient survival[J].Tumour Biol,2013,34(3): 1813-8.
[7] Shou Z X, Jin X, Zhao Z S. Upregulated expression of ADAM17 is a prognostic marker for patients with gastric cancer[J]. Ann Surg,2012,256(6): 1014-22.
[8] Wu B, Sha L, Wang Y, et al. Diagnostic and prognostic value of adisintegrin and metalloproteinase-17 in patients with gliomas[J].Oncol Lett ,2014,8(6): 2616-20.
[9] Crouser E D, Culver D A, Knox K S, et al.Gene expression profiling identifies MMP-12 and ADAMDEC1 as potential pathogenic mediators of pulmonary sarcoidosis[J].Am J Respir Crit Care Med,2009,179(10): 929-38.
[10] Lund J, Olsen O H, Sørensen E S, et al. ADAMDEC1 is a metzincin metalloprotease with dampened proteolytic activity[J].J Biol Chem,2013,288(29): 21367-75.
[11] Xu J, Liu L, Zheng X, et al. Expression and inhibition of ADAMDEC1 in craniopharyngioma cells[J]. Neurol Res, 2012,34(7): 701-6.
[12] 刘学良,郑晓梅,李学涵,等.ADAMDEC1蛋白在胶质瘤中的表达及其意义[J].西安交通大学学报(医学版),2017,38(4):569-73.
