猪瘟病毒NS4B真核表达载体的构建与表达
2018-03-29王小柱
王小柱
(辽宁省畜产品安全监察所,辽宁 沈阳 110003)
猪瘟(swine fever,CSF),也称猪霍乱,是由猪瘟病毒(CSFV)引起的一种猪急性、接触性传染病,死亡率高达90%。该病以高热和出血为主要临床表现,以小血管壁变性、内脏器官多发性出血、梗塞和坏死等为主要病理特征[1],对养猪业的危害极大,造成严重的经济损失[2-3]。目前,我国CSF在发病及流行特点上出现了新变化,表现为隐性感染范围广,发病无典型症状,免疫猪群免疫后抗体水平低,免疫失败时有发生,成为当前我国猪瘟防制中的一大难题。基于此,很多学者认为其流行现状与CSFV遗传变异有关,因此很有必要进行CSFV流行毒株的序列测定与分析,了解CSFV流行毒株的基因变异情况[4-6]。
猪瘟病毒(Classical swine fever virus,CSFV)是猪瘟的病原体,长4O~6O nm,为有囊膜的单股正链RNA病毒,属黄病毒科瘟病毒属。基因组全长约12.5 kb,仅有一个开放性阅读框架(ORF)[4-8]。NS4B是古典猪瘟病毒的一种非结构蛋白,是一种严重的高致命性疾病病原体。NS4B基因位于基因组偏3’端部分,它在病毒生命周期中的功能尚不清楚。NS4B基因在瘟病毒中较保守,在猪瘟病毒各毒株间有较高的同源性[9-12]。将NS4B基因插入质粒载体pEGFP-N3,构建携带NS4B基因的重组真核表达载体,为进一步研究NS4B基因的功能以及猪瘟病毒的致病机理奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与载体 大肠杆菌DH5α感受态细胞、猪瘟病毒S株、pMD18-T载体、pEGFP-N3质粒。
1.1.2 培养基 LB液体培养基。
1.1.3 试剂 引物、E×Taq DNA聚合酶、琼脂糖,DNA marker、溴化乙锭(EB)检测液。Biospin胶回收试剂盒、TIANpure Midi Plasmid Kit,购自天根生物公司。Ligmix Kit,HindⅢ、BamHⅠ,T4 DNA连接酶购自Takara公司。
1.1.4 仪器 PTC-200型PCR仪(MJ Research公司)、电子天平(型号:ALC-210.3)、松下微波炉(型号:NN-G3641MF)、电泳仪(Bio-Rad公司)、DYY-Ⅲ40B型电泳槽(北京六一仪厂)、离心机5804R(Eppendorf公司)。
1.2 方法与步骤
1.2.1 设计引物 从GenBank中查找猪瘟病毒NS4B基因序列,由MEGA 4.0分析软件对序列进行分析,阅读其框架,根据引物设计原则设计1对引物,在上游引物5'端引入HindⅢ酶切位点和翻译起始密码子ATG;在下游引物5'端引入BamHⅠ的酶切位点和翻译终止密码子TCA,上下游引物5’端加保护碱基(GC)[12]。引物由北京华大基因科技有限公司合成。
NS4B(1 041 bp) 无HindⅢ(AAGCTT)和BamHⅠ(GGATTC)
上游引物:5’ GC AAGCTT ATG gctcagggggatgtgcag 3’
下游引物:5’ GC GGATTC TCA tagctggcggatctttcc 3’
1.2.2 PCR产物处理 引物稀释后进行PCR反应,退火温度为55℃,45 s;延伸温度为72℃,1 min。循环数为33。随后进行电泳PCR产物(90 V,30 min)的切胶回收并与T载体16℃连接过夜。
1.2.3 转化到感受态DH5α 取20 μL连接产物加到含100 μL E.coli感受态细胞的Ep管中,混匀,冰置30 min;42℃热击(水浴锅)90 s,冰置2 min;加入800 μL的LB液体培养基,放在37℃水浴100 min涂平板。37℃倒置培养后选5个单菌落,挑半个菌落,进行菌落PCR检测,100 μL PCR体系与之前相同,分装成5管,每管20 μL(模板为菌落),选条带较清晰的菌落,挑剩下的半个菌落,在20 mL的LB液体培养基中振荡过夜(12~16 h)。提取重组质粒。后扩增提取质粒载体pEGFP-N3。
1.2.4 测序 检测与T载体连接的NS4B基因是否突变。测序结果说明基因未突变,可继续试验。测序由北京华大基因科技有限公司完成。
1.2.5 转化小提 pMD18-T-NS4B重组质粒和质粒载体pEGFP-N3,将酶切后的产物并切胶回收目的片段并将酶切后的NS4B基因与质粒载体pEGFP-N3连接。转化感受态DH5α涂平板,在LB固体培养基含Kan,37℃进行选择性培养。后挑取单克隆扩增。提取pEGFP-N3-NS4B重组质粒并酶切检测。
1.2.6 质粒转染表达 将该质粒转染293T细胞,并用Western Blot检测蛋白表达。
2 结果
对最后提取的重组质粒进行酶切检测,获得NS4B基因片段,表明猪瘟病毒NS4B真核表达载体构建成功。
2.1 各操作过程检测结果 DNAmarker电泳条带由负极到正极为:2 000、1 000、750、500、250和100 bp。NS4B基因长度1 041 bp,pMD18-T载体长度2 960 bp,pEGFP-N3质粒长度4 700 bp。
2.2 00NNSS 44 BB与PPmmdd1188--TT重组载体测序结果 NS4B-pMD18-T质粒测序,基因在T载体上的插入位点425,T载体上的序列做引物。引物M13-F(347~370)、M13-R(478~500)经比对测序峰图,重组载体构建正确。
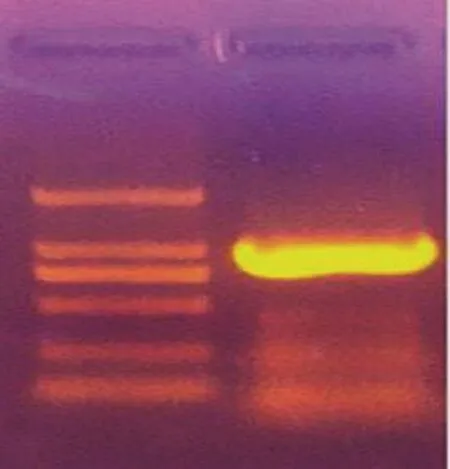
图 1 PCR扩增目的基因电泳图Fig.1 Electrophoretic picture of target gene amplified by PCR

图 2 含有pMD18-T-NS4B重组质粒的菌落PCR电泳结果Fig.2 Electrophoretic picture of Colony PCR with pMD18-T-NS4B plasmid.
图 3 pMD18-T-NS4B重组质粒酶切鉴定Fig.3 Enzyme digestion of pMD18-T-NS4B recombinant plasmid
图 4 pEGFP-N3-NS4B重组质粒酶切结果Fig.4 Enzyme digestion of pEGFP-N3-NS4B recombinant plasmid
2.3 Western BBlloott检测蛋白表达

图 5 Western Blot检测NS4B蛋白表达Fig.5 Detection of NS4B protein expression by Western Blot
3 讨论
猪瘟病毒NS4B基因的研究表明,NS4B可能与病毒致病性有关,具体功能尚不清楚。本试验以猪瘟病毒S株NS4B基因为研究对象,以其与pMC18质粒连接成的重组质粒为模板,克隆NS4B基因,再将其与质粒载体pEGFP-N3质粒载构建真核表达载体,为进一步研究NS4B基因的功能提供前提[13-14]。
在试验中首先进行了PCR扩增,切胶回收目的片段后与T载体连接,转化,提取的重组质粒酶切后,切胶回收目的基因,再与pEGFP-N3质粒连接,转化后,选择性培养基上长出菌落,挑单菌落进行菌落PCR检测,对阳性菌落进行摇菌培养,提取的重组质粒,进行酶切检测,结果表明猪瘟病毒NS4B真核表达载体构建成功。
[1]吴运谱.非洲猪瘟研究进展[J].现代畜牧兽医,2013(6):44-45.
[2]刘志科,张秋雨,杨宁宁,等.一例典型猪瘟病例的临床诊断及分析[J]. 现代畜牧兽医,2017(10):40-45.
[3]罗廷荣,莫扬,吴文德,等.RT-PCR技术检测猪瘟病毒的应用研究[J].中国预防兽医学报,2004,26(4):307-312.
[4]吴旭锦,朱小甫,朱辉.1株山东猪瘟病毒流行毒株全基因组的克隆与序列分析[J].西北农林科技大学学报(自然科学版),2009,37(11):275-278.
[5]刘建玲,张彦明,苏正元,等.逆转录病毒载体介导的猪瘟病毒E2基因的真核表达[J].中国病毒学,2006,21(3):249-252.
[6]王毅,吴海祥,张楚瑜.猪瘟病毒感染性cDNA克隆的构建及其致病性[J]. 病毒学报,2005,21(1):43-47.
[7]范子玲,周玉龙,夏成,等.黑龙江省某猪场散发慢性猪瘟的诊断[J].现代畜牧兽医,2015(12):18-20.
[8]Fernandez-Sainz I,Gladue DP,Holinka LG.Mutations in classical swine fever virus NS4B affect virulence in swine[J].J Virol.,2010,84(3).
[9]黄茜华,张楚瑜.猪瘟病毒石门株NS4B基因的序列测定及分析[J]. 湖北农学院学报,1999,19(1):53-55.
[10]刘占通,舒畅,刘金娥,等.干扰素研究进展[J].中国兽药杂志,2006,40(10):35-38.
[11]舒畅,史大庆,杨瑞,等.猪A干扰素研究进展[J].上海畜牧兽医通讯,2007(6):16-17.
[12]姜虹,李大庆,张运,等.pEGFP—Kallikrein重组真核表达载体的构建及其在兔内皮祖细胞中的表达[J]. 山东大学学报(医学版),2006,44(6):576-579.
[13]周鹏程,陆宇,陈建国,等.猪瘟病毒E2(gp55)基因的克隆表达及其DNA疫苗的初步研究[J].微生物学报,2000,10(3):243-251.
[14]黄涛,汤德元,嵇辛勤,等.猪瘟病毒E2基因的克隆及原核和真核表达载体的构建[J].兽医科技,2009(10):70-72.
