蛹虫草浸提液的抗菌作用初步探究
2018-03-29马新宇李欣南韩镌竹徐方旭王升厚
马新宇,李欣南,韩镌竹,徐方旭,王升厚⋆,叶 齐
(1.沈阳师范大学,辽宁 沈阳 110034;2.辽宁省兽药饲料畜产品安全检测中心,辽宁 沈阳 110016;3.沈阳药科大学,辽宁 沈阳 110016)
蛹虫草(Cordyceps militaris)又名北虫草,为子囊菌门[1],肉座目,麦角菌科、虫草属的模式种[2]。由子座(即草部分,又称子实体)与菌核(即昆虫的尸体部分)两部分组成的复合体。1950年,德国科学家Cunningham从中分离出一种抗菌性物质,3'-脱氧腺苷,定名为虫草素。蛹虫草中除虫草素外,还含有虫草酸、虫草多糖、腺苷等多种生物活性成分[3]。研究表明,蛹虫草具有消炎[4]、抗菌抗病毒、抗肿瘤、抗氧化、提高人体免疫力等作用[5]。
很多学者在蛹虫草的发酵液中发现了抗菌活性物质,如高燕燕等[6]在蛹虫草中提取到了水溶性和脂溶性的抗菌物质,这种抗菌物质初步断定为蛋白质。秦建春等[7]对蛹虫草中的乙酸乙酯萃取物质和正丁醇萃取物质进行对比研究其抗菌作用,结果表明乙酸乙酯萃取物对金黄色葡萄球菌有抑菌作用,而正丁醇萃取物对其无抑菌作用,但文献中没有涉及到蛹虫草浸提液对革兰氏阳性菌和革兰氏阴性菌抑菌作用的对比。本试验选用蛹虫草子实体粉的水提液和乙醇提取液作为研究对象,并通过薄层色谱法分析,初步得到使用不同浓度乙醇对虫草粉进行提取而获得的活性成分不同的结论,接着采用管碟法和微量稀释法,分别对金黄色葡萄球菌和大肠杆菌进行敏感性试验,为进一步研究蛹虫草的抗菌作用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种 标准菌株:ATCC25922大肠杆菌(E.coli);ATCF29213金黄色葡萄球菌(Staphylococcus aureus),均购自中国微生物菌种保藏中心。
1.1.2 仪器 恒温培养箱 memmert 260 INplus;高压灭菌锅SANYU MLS-3780;氮吹仪,上海安谱实验科技股份有限公司;EFAA-DC12-RT;麦氏比浊仪Densimat bioMerieux France;恒温水浴锅,嘉兴市中新医疗仪器有限公司DKS-12;分析天平METTLER TOLEDO AG285;牛津杯放置器,北京先驱威峰技术开发公司 2Y-300G。
1.1.3 药品 新霉素(1 mg含645个单位)购自中国兽医药品监察所130309-200811;黏菌素(1 mg含22782个单位)购自中国兽医药品监察所K0271305;营养琼脂培养基,购自青岛高科园海博生物技术有限公司20160318。无水乙醇、NaCl、乙酸乙酯、正丁醇、二甲亚砜均购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 溶液配制 生理盐水:称取0.85 g的NaCl,加入100 mL无菌水。新霉素工作液:准确称取1 mg新霉素标准物质用3%NaCl定容到50 mL容量瓶中,配置为12.9 U/mL的金黄色葡萄球菌阳性对照药品。黏菌素工作液:准确称取1 mg黏菌素标准物质用3%NaCl定容至25 mL容量瓶中,配置为911.28 U/mL的大肠杆菌阳性对照药品[8]。
1.2.2 蛹虫草活性物质的提取与制备 提取:称取干燥的蛹虫草子实体干粉20 g共6份,分别加入200 mL无菌水及50%、60%、70%、80%、90%乙醇溶液,4℃浸提16~20 h,过滤分装到离心管中,得到水提液和醇提液,使用氮吹仪分别氮吹,将浸提液浓缩为干粉合并,再用10 mL提取溶剂复溶,制备成抑菌活性物质含量为0.001 g/mL浸提液。
使用乙酸乙酯和正丁醇作为提取剂,利用秦建春等文献方法[7],分别进行虫草粉中抑菌活性物质的提取,经氮吹浓缩,乙酸乙酯浸提物用二甲亚砜助溶后用无菌水配成0.001 g/mL提取物的溶液。
1.2.3 薄层色谱法分离抑菌物质 使用毛细管分别吸取蛹虫草水提液以及50%、60%、70%、80%、90%的乙醇提取液并进行点样,晾干后备用。使用无水乙醇、甲醇、丙酮分别作为展开剂,取20 mL左右展开剂于层析缸内,将晾干的硅胶板轻放在层析缸中,约40 min后将硅胶板取出晾干,在366 nm紫外灯下验视[9]。
1.2.4 菌悬液的制备 将标准菌株(E.coli、Staphylococcus aureus)接种于营养琼脂平板上,经生化培养箱培养16~18 h[10]。用无菌棉签挑取新鲜单菌落(E.coli、Staphylococcus aureus)置于生理盐水中,用麦氏比浊仪调菌悬液的浓度为1麦氏,现用现配。
1.2.5 平皿的制备 将1.2.4两种菌悬液分别与48℃的营养琼脂按1:50比例混合均匀,制备好的上层在48℃水浴锅中恒温备用。定量平皿中加入15 mL营养琼脂作为下层,待冷却后,加入5 mL上层,备用。
1.2.6 管碟法药物敏感性试验 将制备好的水提液(50%、60%、70%、80%、90%乙醇的浸提液)(1.2.2)、新霉素工作液(1.2.1)、无菌水(50%、60%、70%、80%、90%乙醇溶液)试样各200 μL加入放置于金黄色葡萄球菌检验用平板上的4个牛津杯中(提取液加入2个);水提液(50%、60%、70%、80%、90%乙醇的浸提液)(1.2.2)、黏菌素工作液(1.2.1)、无菌水(50%、60%、70%、80%、90%乙醇溶液)试样各200 μL加入放置于大肠杆菌检验用平板上的4个牛津杯中(无菌水等加入2个);将平皿放入恒温培养箱,盖好陶瓦盖,37℃培养16~18 h[11]。
将制备好的乙酸乙酯提取液、正丁醇提取液、80%乙醇提取液、二甲亚砜试样各200 μL加入放置于金黄色葡萄球菌检验用平板上的4个牛津杯中,将平皿放入恒温培养箱,盖好陶瓦盖,37℃培养16~18 h。
1.2.7 微量稀释法药物敏感性试验 取空白无菌96孔板,第一排加入1 000 μg/mL的蛹虫草粉浸提物(水提液,50%、60%、70%、80%、90%乙醇的浸提液)(1.2.2),用无菌水依次向右倍半稀释,配置成浓度为 1 000、 500、 250、 125、 62.5、 31.3、 15.6、7.8 μg/mL提取物的浸提液。
用无菌棉签挑取新鲜单菌落(E.coli、Staphylococcus aureus)置于生理盐水中,用麦氏比浊仪调菌悬液的浓度为0.5麦氏,吸取100 μL菌液加入已有10 mL营养肉汤培养基的V型无菌槽中(1:100稀释),用微量移液器吸取混有菌液的营养肉汤50 μL加入到96孔板中,将96孔板置于37℃培养24 h[12]。
2 结果与分析
2.1 薄层色谱法分离结果 不同的展开剂分离物质的效果不同,经多次试验得出乙醇作为展开剂展开效果最好,如图2所示。不同浓度乙醇提取液在薄层色谱板上以无水乙醇作为展开剂,分离出物质的比移值(Rf)不同,说明提取得到的抑菌活性物质不同,但抑菌活性物质的具体成分有待进一步考查。
2.2 蛹虫草浸提液的抗菌活性 图3~14分别为蛹虫草不同浓度乙醇提取液和水提液对金黄色葡萄球菌和大肠杆菌的抑菌圈试验结果,由图可见,水提液对金黄色葡萄球菌和大肠杆菌均无明显抑菌作用,50%、60%、70%、80%、90%乙醇提取液对金黄色葡萄球菌的抑菌作用均大于对大肠杆菌的抑菌作用。
又由表1可知,80%乙醇提取得到的抑菌活性物质对于金黄色葡萄球菌的抑菌作用最大。

图 2 薄层色谱法分离结果Fig.2 Thin layer chromatography separation results
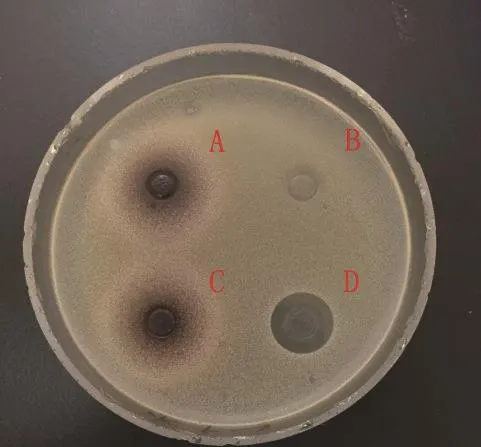
图 3 金黄色葡萄球菌Fig.3 Staphylococcus aureus
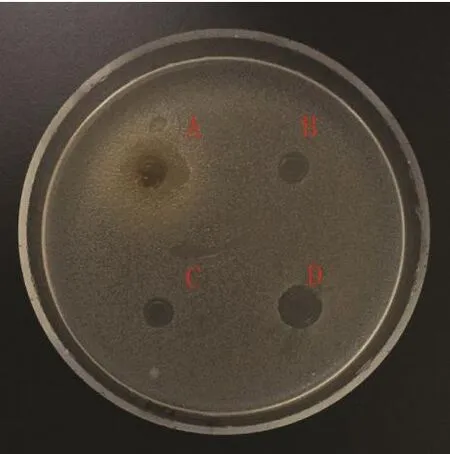
图 4 大肠杆菌Fig.4 Escherichia coli
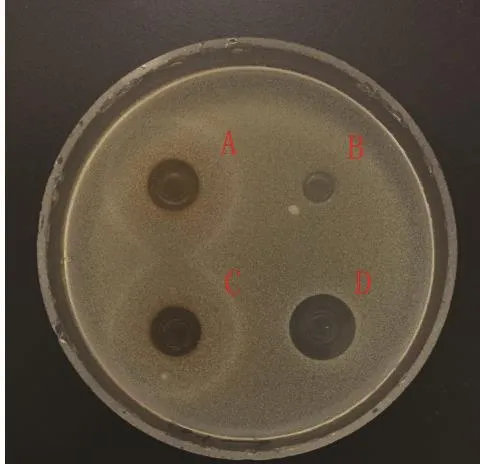
图 5 金黄色葡萄球菌Fig.5 Staphylococcus aureus
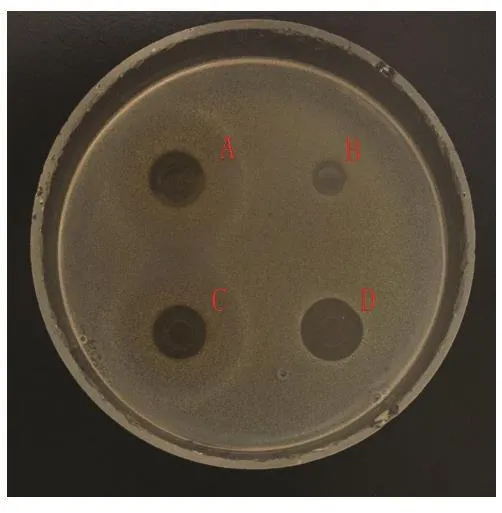
图 6 大肠杆菌Fig.6 Escherichia coli
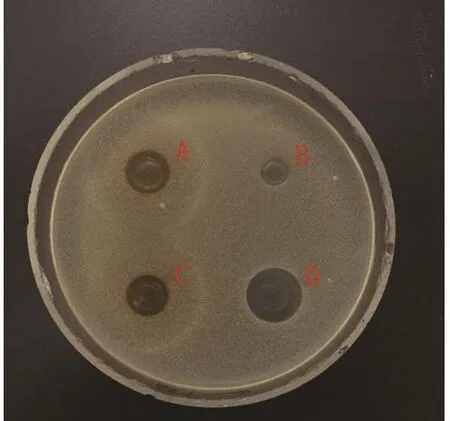
图 7 金黄色葡萄球菌Fig.7 Staphylococcus aureus
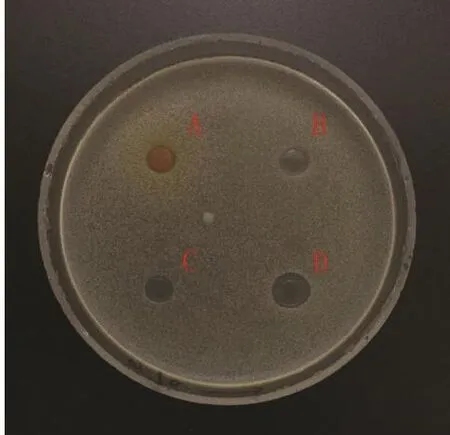
图 8 大肠杆菌Fig.8 Escherichia coli

图 9 金黄色葡萄球菌Fig.9 Staphylococcus aureus

图 10 大肠杆菌Fig.10 Escherichia coli
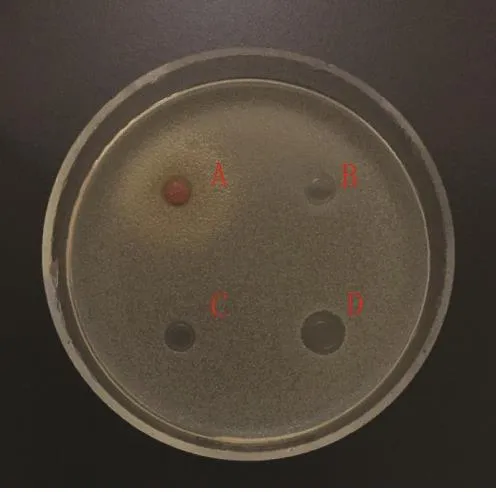
图 11 金黄色葡萄球菌Fig.11 Staphylococcus aureus

图 12 大肠杆菌Fig.12 Escherichia coli

图 13 金黄色葡萄球菌Fig.13 Staphylococcus aureus
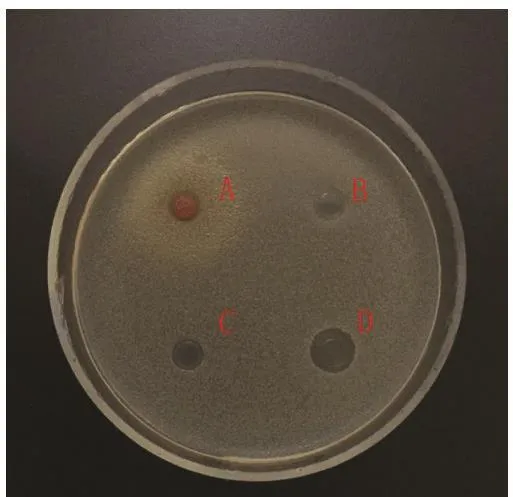
图 14 大肠杆菌Fig.14 Escherichia coli
2.3 乙酸乙酯、正丁醇和8800%%乙醇提取液抑菌活性物质对比 由图15和表2可看出,乙酸乙酯和正丁醇提取到的抑菌活性物质小于80%乙醇提取到的抑菌活性物质对金黄色葡萄球菌的抑菌作用,说明80%乙醇提取液提取到的抑菌活性物质能更好地抑制金黄色葡萄球菌的生长。
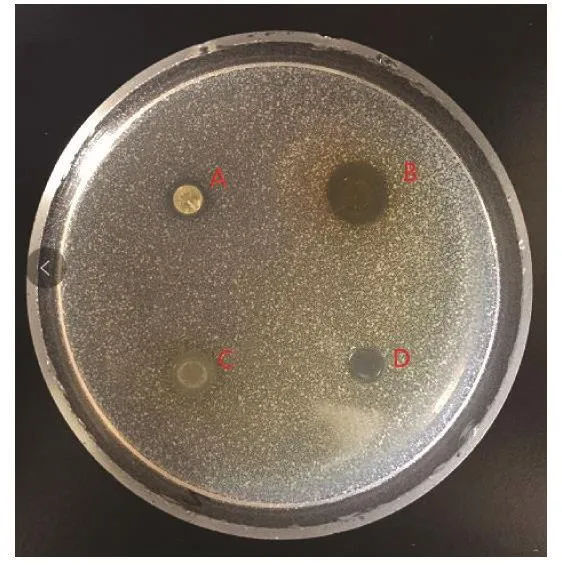
图 15 三种不同浸提液抑菌作用对比Fig.15 Comparison of bacteriostatic action of three different extracts

表 1 抑菌活性物质对金黄色葡萄球菌抑菌性的测定结果Table 1 The results of staphylococcus aureus bacteriostasis by antibacterial active substance

表 2 三种不同浸提液抑菌圈的测定结果Table 2 The results of three different kinds of antibacterial rings were obtained
2.4 微量稀释法药物敏感性试验结果 使用微量稀释法对不同提取液的药物敏感性进行测定,结果如表3所示,可看出80%醇提液对于金黄色葡萄球菌和大肠杆菌的抑菌能力最强,水提液对其抑菌能力较弱,且80%乙醇提取液对于金黄色葡萄球菌和大肠杆菌的最小抑菌浓度分别为250 μg/mL、500 μg/mL提取物。
2.5 提取方法的优化 在虫草粉活性物质提取工艺中,主要影响因素是乙醇浓度、提取时间、提取方式和提取温度。通过筛选确定提取溶解为80%乙醇。因此,进一步对提取时间、提取温度和提取方式进行考察,以提取抑菌活性物质浓度为指标,对提取工艺进行优化。提取温度分别考察了4℃和20℃,结果显示4℃条件下提取抑菌圈直径平均值为12.69 mm,20℃条件下提取抑菌圈直径平均值为12.52 mm,因此4℃温度下进行提取效果最佳;提取方式分别考察了摇床震荡提取和静置提取,结果显示静止条件提取抑菌圈直径平均值为12.46 mm,震荡条件提取抑菌圈直径平均值为12.78 mm,因此震荡提取的效果更佳;提取时间分别考察了16 h和24 h,结果表明16 h就可以达到最佳提取效果。初步确定最佳的抑菌活性物质提取方案为:80%乙醇提取,4℃环境下震荡提取16~24 h。

表 3 微量稀释法药物敏感性试验Table 3 Drug sensitivity test of microdilution method

表 4 提取条件对金黄色葡萄球菌抑菌圈直径的影响Table 4 The effect of extraction conditions on the diameter of staphylococcus aureus mm
3 讨论与结论
本试验结果表明,80%乙醇提取到的抑菌活性物质对革兰氏阳性菌的抑菌作用最大,使用报道中乙酸乙酯和正丁醇提取到的抑菌活性物质分别与80%乙醇提取物进行对比,前两者的抑菌作用均小于80%乙醇提取物。
通过微量稀释法试验也得到证明,80%乙醇提取得到的抑菌活性物质对于金黄色葡萄球菌和大肠杆菌的抑菌作用均最大。同时证明使用80%乙醇提取到的抑菌活性物质对于革兰氏阳性菌的抑菌效果大于革兰氏阴性菌。通过提取条件优化,初步确定最佳提取条件为:80%乙醇提取,4℃环境下震荡提取16~24 h。
本试验从抑菌方面证明,蛹虫草子实体中存在多种抑菌活性物质,使用无菌水对蛹虫草粉进行提取,无法提取到抑菌活性物质;但使用不同浓度乙醇对蛹虫草粉进行提取,获得的抑菌活性成分不同,且对革兰氏阳性菌和革兰氏阴性菌有不同的抑菌效果。因此对蛹虫草粉不同浓度乙醇提取液的应用具有广阔的前景,其抑菌活性物质的成分在后续的研究中会加以关注。
现如今,抗生素的滥用情况十分严重,抗生素不仅会造成环境的污染,也对人体有一定的危害作用[13],一些抗生素已经被禁用,亟需研发纯天然、绿色、环保的抗生素替代品。经过多年的研究,蛹虫草具有消炎、抗菌抗病毒等优点。同时,蛹虫草栽培方法简单,出草时间快,成本低,是活性物质筛选的较为理想的原料之一。但目前尚未从中提取有效的抗菌活性物质,如果能从蛹虫草中提取到天然、绿色、环保的抑菌物质,对于发挥蛹虫草的医疗价值和更大的经济价值作用将具有非凡的意义。
[1] Gi-Ho Sung, Nigel L. Hywel-Jones, Jae-Mo Sung,etal. Phylogeneticclassificationof Cordyceps and the clavicipitaceous fungi[J].Studies in Mycology,2007,57.
[2]孟泽彬,陈林会,韩近雨,等.蛹虫草化学活性成分的研究进展[J]. 分子植物育种,2015,13(9):2147-2154.
[3]李晨曦.蛹虫草有效成分的提取及保健食品的开发[D].南昌:南昌大学,2013.
[4]余伯成,唐永范,唐亮,等.虫草素的药理作用研究进展[J]. 现代药物与临床,2011,26(5):349-352.
[5]刘桂君,周思静,杨素玲,等.蛹虫草中虫草素的研究进展[J]. 食品科学,2013,34(21):408-413.
[6]高燕燕,周礼红,潘肇仪,等.蛹虫草抗菌活性物质的初步研究[J]. 广东农业科学,2013,40(11):183-185+238.
[7]秦建春,李晓明,张鞍灵,等.蛹虫草发酵液抗菌活性初步研究[J]. 西北植物学报,2006,(2):402-406.
[8]中国兽药典委员会.中华人民共和国兽药典(2015年版一部)[M].北京:中国农业出版社,2015.
[9]窦红,张晓鑫,高春平.薄层色谱法检测苏丹红[J].河北工业科技,2009,26(2):90-94.
[10]杨希国,李欣南,李香珍,等.鸡大肠杆菌的分离鉴定及耐药性研究[J]. 现代畜牧兽医,2011,(7):32-34.
[11]李伟革,李应超,赵营,等.微生物管碟法与比浊法测定抗生素含量[J]. 饲料研究,2012,(8):67-68.
[12]孙长贵,张丽君,曾贤铭,等.微量稀释法测定抗真菌剂对酵母菌MIC的评价[J].临床检验杂志,2000,(6):331-332+335.
[13]刘叶,杨悦.我国抗生素滥用现状分析及建议[J].中国现代医生,2016,54(29):160-164.
