实时定量PCR检测流感嗜血杆菌感染实验室诊断方法的建立
2018-03-29王良玉胡文娟窦海伟辛德莉郭东星
蔚 然,王良玉,高 琦,胡文娟,窦海伟,向 莉,辛德莉,郭东星△
(1.首都医科大学附属北京友谊医院/北京热带医学研究所,北京100050 ;2.首都医科大学附属北京儿童医院,北京100050)
流感嗜血杆菌(Hi)为革兰阴性菌,是人类呼吸道黏膜的常见定植细菌。流行病学调查显示北京地区5岁以下急性呼吸道感染患儿2000-2002年呼吸道Hi携带率为26.1%,随着疫苗的应用Hi携带率有所下降,但2010-2012年仍高达16.3%[1]。Hi是儿童时期细菌性脑膜炎、肺炎和菌血症的重要病原菌之一,还可导致儿童中耳炎、上颌窦炎、急性会厌炎、化脓性关节炎和眼内炎等[2],给儿童健康造成很大威胁。由于Hi毒力较强,病情变化快,其导致的小儿肺炎属于较严重的一种类型,病死率没有得到有效控制,各地的诊治方法也无标准,常有漏诊、误诊情况[3]。Hi的早期、快速、准确检测,对疾病的早期治疗、疾病的转归及预后起到非常重要的作用。现有诊断方法,如分离培养、血清学诊断等不能满足临床需要,需不断探索早期、快速诊断Hi感染的新方法。近年来,分子生物学诊断正逐渐成为研究的热点。本研究拟建立一种SYBR-Green染料法实时定量聚合酶链反应(PCR)检测Hi感染的方法,以期实现Hi的临床早期、快速、准确诊断。现报道如下。
1 资料与方法
1.1一般资料 采集2014年9-12月就诊于北京儿童医院的患儿咽拭子标本226份。本研究通过伦理审查,患儿家属均知情同意。菌株:肺炎支原体标准株M129菌株(ATCC29342)、人型支原体标准株(ATCC15488)、阴沟肠杆菌标准株(ATCC700323)、金黄色葡萄球菌标准株(ATCC25922)、肺炎克雷伯菌标准株(ATCC1705)和大肠埃希菌标准株(ATCC25922),含有Hi fucK基因质粒的大肠埃希菌冻存于本研究室。
1.2仪器与试剂 ABI公司Prism@7500型荧光定量PCR仪;高纯度质粒小提试剂盒(康为世纪生物科技有限公司,货号CW0500S,生产批号20121);通用型柱式基因组提取试剂盒(康为世纪生物科技有限公司,货号CW2298S,生产批号40137);PCR荧光染料为ULtra SYBR Mixture(康为世纪生物科技有限公司,货号CW2601M,生产批号10209)。
1.3方法
1.3.1构建标准品 复苏冻存于-80 ℃冰箱的含有Hi fucK基因的大肠埃希菌,构建质粒,采用康为世纪高纯度质粒小提试剂盒提取质粒,实验操作参考产品说明书。对提取的质粒进行定量分析,10倍稀释构建水平为108、107、106、105、104、103、102、10 copy/μL的质粒作为标准品,保存于-80 ℃备用。
1.3.2设计并合成引物 针对Hi的fucK基因设计引物Hi-F/Hi-R,引物序列Hi-F:ATGGCGGGAACATCAATGA;Hi-R:ACGCATAGGAGGGAAATGGTT。引物由美国Invitrogen公司合成,经HPLC方式纯化。
1.3.3绘制标准曲线 以标准品为模板进行染料法荧光定量PCR,绘制标准曲线。荧光定量PCR反应体系:2×Taqman缓冲液10 μL,引物Hi-F/Hi-R各0.3 μL, DNA 模板2.0 μL,ddH2O 8.0 μL,总体积20.0 μL。反应条件:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40 个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。采用ABI公司7500型荧光定量PCR仪的SDS软件分析实验结果并绘制标准曲线。
1.3.4方法学验证 (1)敏感度:将构建的标准品稀释为107、106、105、104、103、102、10 copy/μL,采用和绘制标准曲线时相同的反应体系和反应条件,检测新建的实时荧光定量PCR的敏感度。(2)特异度:以本实验室保存的肺炎支原体、人型支原体、阴沟肠杆菌、金黄色葡萄球菌、肺炎克雷伯菌和大肠埃希菌的DNA作为检测模板,验证新建的实时荧光定量PCR特异度。(3)检验临床标本:采集的226份儿科患儿的咽拭子标本,均采用通用型柱式基因组提取试剂盒提取DNA,实验操作参考产品说明书。用新建的实时荧光定量PCR检测Hi的感染情况,反应体系和条件均参照构建标准曲线时采用的体系和条件。根据标本扩增的Ct值≤38、Tm值与标准品相符,且结合扩增曲线、溶解曲线,判定为阴阳性。
2 结 果
2.1标准曲线 10倍梯度稀释用标准株提取的质粒,108、107、106、105、104、103、102、10 copy/μL的质粒标准品,用Hi-F/Hi-R引物分别扩增标准品,以标准品水平为横坐标,对应的Ct值为纵坐标,采用SDS软件分析实验结果并绘制标准曲线。标准曲线方程:Y=-3.335 976X+35.492 149(R2=0.999);模板量与Ct值具有良好的相关性,能够对模板定量。见图1。

图1 标准曲线
2.2敏感度 10倍梯度稀释用标准株提取的质粒,108、107、106、105、104、103、102、10 copy/μL的质粒标准品,用Hi-F/Hi-R引物分别扩增标准品,检验新建荧光定量PCR的敏感度。新建实时荧光定量PCR可检测拷贝数为10 copy的基因模板。见图2。

注:108、107、106、105、104、103、102、10分别代表标准品模板拷贝量
图2标准品扩增曲线
2.3特异度 大肠埃希菌、阴沟肠埃希菌、金黄色葡萄球菌、肺炎支原体、肺炎克雷伯菌和人型支原体标准株的DNA作为检测模板,验证新建实验室诊断方法的特异度。结果显示以上几种病原体DNA均为阴性,新建实验室诊断方法具有良好的特异度。见图3。

注:A为Hi标准品;B为阴沟肠杆菌标准株;C为大肠埃希菌标准株;D为肺炎支原体标准品;E为金黄色葡萄球菌标准品;F为人型支原体标准品;G为肺炎克雷伯菌标准株
图3 Hi的标准品与其他菌株标准株的溶解曲线
2.4临床标本检测 用新建实时荧光定量PCR检测临床标本提取的DNA,结果显示,226份咽拭子标本Ct值≤38,Tm值与标准品相符;结合扩增曲线、溶解曲线,判定为阳性,阳性检出率为40.70%。PCR阳性产物测序(由生工生物工程股份有限公司完成)并与美国国立生物技术信息中心(NCBI)已发布的Hi菌株的基因序列比对,阳性率为92.3%。见图4。

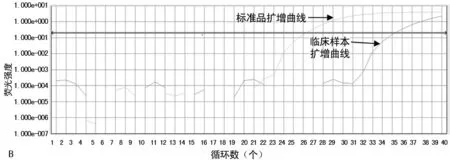
注:A为溶解曲线;B为扩增曲线
图4临床标本、Hi标准品的溶解曲线与扩增曲线
3 讨 论
有研究报道,综合192个国家的流行病学调查显示,肺炎仍是导致儿童死亡的首要病因,其中由Hi引起的死亡占16.0%,我国由Hi感染引起的死亡占21.2%,高于世界平均水平[4-5]。可能由于Hi感染的临床表现及胸部X线征象缺乏特异性,诊断Hi感染往往需要结合实验室诊断方法[6]。对Hi感染的早期、快速、准确诊断对指导临床合理规范用药至关重要。
传统的分离培养被认为是诊断Hi感染的金标准,但培养所需时间较长(36~72 h),难以实现快速鉴定[7],对临床早期诊断的意义不大。该方法受培养条件、标本保存与运输、实验室培养条件等诸多因素影响。有报道称,经改良培养基后,Hi分离率有所提高,也仅为59.9%[8-9]。血清学诊断方法主要通过检测血清中的特异性抗原、抗体滴度的变化等判断病原体感染,有研究报道其敏感度高于分离培养[10]。但血清抗体产生需4~5 d,不能进行快速检测,且容易产生假阴性。因此,血清学诊断方法常用于回顾性诊断,不建议作为确诊依据[11-12]。
分子生物学诊断技术自1990年首次用于Hi的鉴定后,因其快速、敏感、特异、简单等优点,受到国内外学者的广泛关注。目前已报道的分子生物学诊断Hi感染的方法有传统PCR、巢式PCR、多重PCR、高分辨率溶解曲线等[13]。NAKHJAVANI等[14]将PCR用于Hi的检测,并与常规培养法和血清学方法比较,PCR使检出率明显提高。理论上认为实时定量PCR较传统PCR更敏感,并可实时监测,实验过程中即可判断结果。实时定量PCR较巢式PCR,可以减少核酸污染问题,操作更简便。实时定量PCR相较于多重PCR,用时更短,实验条件更易优化,敏感度更高。有研究显示,以实时定量PCR为参考标准,多重PCR的敏感度、特异度分别仅为30.0%、75.0%[15]。
COUGHLAN等[16]研究证实,fucK基因是目前发现的Hi特异度、敏感度最高,应用最广的基因。本研究针对Hi的fucK基因设计引物,保障引物设计的合理性、可行性。相对于探针法,染料法不需要设计特异性探针,成本更低,更简单。荧光定量PCR相对于常规分离培养和血清学诊断更加快速、简易。本方法可检测Hi基因拷贝数为10 copy的样品,相较于商品试剂盒[17],其具有较高的敏感度,且成本较低。采用几种不同常见细菌DNA标本,验证其特异度,本实验中几种病原不存在交叉反应,具有良好的特异度。但所选用的特异性实验菌种较为有限,在后续研究中,还应选择更多的菌种进行实验,对其特异度进一步的验证。完善和优化实验条件后,226份临床标本检出Hi阳性92份,阳性率为40.70%。其PCR阳性产物测序与NCBI已发布的HI菌株的基因序列比对,准确率为92.3%。
综上所述,本研究中建立的实时定量PCR检测Hi的实验室诊断方法具有早期、快速、简便、灵敏的优势,是Hi感染临床诊断、流行病学调查、混合感染判定的可行手段,具有较高的推广应用价值。
[1]王爱华.流感嗜血杆菌感染与耐药[J].中华实用儿科临床杂志,2016,31(4):256-258.
[2]胡俊,王晓蕾,许峰,等.流感嗜血杆菌阳性住院患儿回顾性流行病学调查[J].中国当代儿科杂志,2015,17(6):596-601.
[3]孟亚辉.42例确诊小儿社区获得性流感嗜血杆菌肺炎病临床分析[J].中国农村卫生,2015,8(12):16-17.
[4]RUDAN I,O'BRIEN K L,NAIR H,et al.Epidemiology and etiology of childhood pneumonia in 2010:estimates of incidence,severe morbidity,mortality,underlying risk factors and causative pathogens for 192 countries[J].J Glob Health,2013,3(1):010401.
[5]FANG W,RAN L,YING S,et al.A pilot study of quantitative loop-mediated isothermal amplification-guided target therapies for hospital-acquired pneumonia[J].Chin Med J,2016,129(2):181-186.
[6] 王宏.流感嗜血杆菌肺炎的诊断[J].中外健康文摘,2011,8(25):174-175.
[7]陆伟桃,郭菁,邓晨晖,等.探讨全自动快速微生物检测系统在鉴定流感嗜血杆菌的应用[J].检验医学与临床,2016,13(7):944-945.
[8]杨帅.b型流感嗜血杆菌感染疾病流行病学及防治研究进展[J].中国病毒病杂志,2009,11(6):465-468.
[9]张建明,滕昆仑,卢勉飞,等.不同动物血液对流感嗜血杆菌生长影响的研究[J].中国卫生检验杂志,2016,26(17):2487-2489.
[10]王明清,管娇琼,龙艺,等.b型流感嗜血杆菌多糖间接竞争ELISA检测方法的建立[J].中国生物制品学杂志,2015,28(6):623-627.
[11]张莉滟,陈林,吴忠道.流感嗜血杆菌16S rRNA和p6基因PCR检测结果比较[J].重庆医学,2009,38(23):2960-2962.
[12]周凯,李立群,徐飞,等.小儿下呼吸道流感嗜血杆菌感染的血清分型及耐药分析[J].现代预防医学,2016,43(4):643-645.
[13]PICKERING J,BINKS M J,BEISSBARTH J A,et al.A PCR-High-Resolution melt assay for rapid differentiation of nontypeable haemophilus influenzae and haemophilus haemolyticus[J].J Clin Microbiol,2014,52(2):663-667.
[14]NAKHJAVANI F A,HASHEMI F B,KALANI M T,et al.Detection of haemophilus influenzae type b in cerebrospinal fluid of suspected children with meningitis by pcr[J].Med J Islamic Repub Iran,2005,19(2):181-184.
[15]丁振尧,李红微,郭美丽,等.多重PCR检测浙江沿海地区儿童肺炎细菌性病原研究[J].中国微生态学杂志,2014,26(1):46-50.
[16]COUGHLAN H,REDDINGTON K,TUITE N,et al.Comparative genome analysis identifies novel nucleic acid diagnostic targets for use in the specific detection of Haemophilus influenzae[J].Diagn Microbiol Infect Dis,2015,83(2):112-116.
[17]DE FILIPPIS I,DE ANDRADE C F,CALDEIRA N,et al.Comparison of PCR-based methods for the simultaneous detection of Neisseria meningitidis,Haemophilus influenzae,and Streptococcus pneumoniae in clinical samples[J].Braz J Infect Dis,2016,20(4):335-341.
