CIA模型小鼠体内滤泡辅助性和调节性T细胞数量的动态观察
2018-03-29胡志芳李爱连姜凤良
王 宁,胡志芳,李爱连,姜凤良
(西安医学院 免疫学教研室, 陕西 西安 710021)
类风湿性关节炎(rheumatoid arthritis,RA)是一种多关节滑膜炎性反应为特点的自身免疫性疾病[1]。鸡Ⅱ型胶原蛋白诱导性关节炎(collagen-induced arthritis, CIA)小鼠为人类RA研究的经典动物模型[2]。滤泡辅助性T(T follicular helper,Tfh)细胞可促进淋巴滤泡生发中心的形成、B淋巴细胞的发育和高亲和力抗体的产生,高表达趋化因子受体(C-X-C chemokine receptor type,CXCR)5和协同刺激性因子(inducible costimulatory,ICOS),而滤泡调节性T(T follicular regulatory,Tfr)细胞表达叉头盒蛋白3(forkhead/winged-helix transcription factor box P3, Foxp3)、CXCR5和ICOS,通过抑制Tfh细胞活性、生发中心 B 细胞的类别转换和抗体分泌来维持机体免疫耐受[3]。因此,Tfh和Tfr细胞数量及其比例变化与机体免疫稳态维持和自身免疫性疾病发生均有密切关系。本研究旨在评估Tfh和Tfr细胞数量、比例与CIA病程相关性,探讨其在RA发病机制中的作用。
1 材料与方法
1.1 材料
1.1.1 试剂:鸡Ⅱ型胶原和完全弗氏佐剂(Sigma公司);RPMI 1640(Hyclone公司),胎牛血清(浙江四季青公司),小鼠淋巴细胞分离液(深圳达科为公司),青链霉素混合液(北京博艾尔公司),小鼠Percp-CD4、PE-CXCR5、APC-ICOS、Alexa Fluor 488-Foxp3荧光抗体和IgG同型抗体(Biolegend公司)。
1.1.2 实验动物:SPF级C57BL/6雄性小鼠60只,6~8周龄,体质量为20.0±0.5 g(第四军医大学),许可证编号XJYYLL- 2014435。
1.2 方法
1.2.1 小鼠分组及处理:将小鼠分为对照组、CIA病程早期组、中期组和晚期组共4组,每组各15只。将鸡Ⅱ型胶原(ColⅡ)溶解于0.01 mol/L冰醋酸中,混匀后4 ℃过夜,将完全弗氏佐剂(CFA)与Col Ⅱ等体积混合,研磨至油包水状态。麻醉小鼠后尾跟部皮下注射100 μL。首次免疫后第21天相同方法和剂量进行2次加强免疫。对照组小鼠按照上述方法和时间注入等量0.9%氯化钠溶液。ColⅡ免疫组小鼠足关节红肿变形,提示造模成功。造模后进行疾病观察并进行病情评估,确定再次免疫后8~12 d为病程早期,22~26 d为病程中期,30~35 d为病程晚期,分别处死小鼠,分离脾脏和外周淋巴结。
1.2.2 小鼠病情和关节AI评分:每日观察足爪关节肿胀情况,用关节炎指数(arthritis index, AI)衡量病变情况,病变程度参考以下评分[7]。0级:关节正常,无红肿;1级:关节红但无肿大;2级:关节轻度红肿;3级:关节中度红肿;4级:关节重度红肿伴随功能障碍。每只小鼠病情评分为其四肢关节分数的总和。
1.2.3 流式细胞术检测病情高峰期小鼠脾脏和淋巴结Tfh细胞: 制备脾脏和淋巴结单细胞悬液5×106个细胞,利用锥虫蓝拒染法确定活细胞>95%。Tfr和Tfh细胞数量和比例测定:收集各组细胞,调整细胞量并去除培养基,分别加入:Percp-CD4抗体1.25 μL、PE-CXCR5抗体2.5 μL、APC-ICOS抗体2.5 μL和Alexa Fluor 488-Foxp3抗体2.5 μL,设置同型管和补偿管;混匀,4 ℃放置30 min后彻底洗涤,加200 μL甲醛固定液保存待上机,所测结果使用FlowJo 10软件分析。

2 结果
2.1 CIA小鼠病情评估: 加强免疫后CIA小鼠出现活动力
降低、进食减少和体质量下降,尾根部皮肤渐红肿溃疡,背部皮肤出现片状溃疡;疾病早期AI指数为(1.93±1.32);疾病中期为(5.73±2.12);疾病晚期为(3.14±1.58)。
2.2 CIA小鼠病程中期和晚期脾脏、淋巴结Tfr细胞比例变化:CIA小鼠病程中期脾脏Tfr细胞在CD4+T中所占比例明显低于对照组小鼠(P<0.001);病程晚期所占比例较中期明显升高(P<0.01)(图1,图2A)。病程中期淋巴结Tfr细胞所占比例明显低于对照组小鼠(P<0.01);病程晚期所占比例较中期明显升高(P<0.05)(图1,图2B)。
2.3 CIA小鼠病程中期和晚期脾脏、淋巴结Tfh细胞比例变化:CIA小鼠病程中期脾脏Tfh细胞所占比例明显高于对照组小鼠(P<0.01),也明显高于病程中期小鼠;病程晚期较中期明显降低(P<0.05)(图1,图3A)。病程早期淋巴结中Tfh细胞较对照组明显升高(P<0.01);病程晚期较中期明显降低(P<0.05)(图1,图3B)。
2.4 CIA小鼠病程中期和晚期脾脏、淋巴结Tfr/Tfh比值的比较:CIA小鼠病程早期脾脏Tfr/Tfh开始低于对照组(P<0.05);中期明显降低(P<0.001);CIA小鼠病程晚期脾脏Tfr/Tfh比值较中期明显升高(P<0.01)(图4A)。病程早期淋巴结Tfr/Tfh明显降低(P<0.05),中期降低最为明显,病程晚期淋巴结Tfr/Tfh比值较中期明显升高(P<0.05)(图4B)。
3 讨论
本实验应用人类RA经典动物模型CIA模型,检测小鼠RA病程中脾脏和淋巴结Tfr和Tfh细胞数量比例和变化规律。在病程3个时期中,脾脏和淋巴结中Tfh细胞比例与AI评分趋势始终一致,说明Tfh细胞可能通过激活体液免疫应答参与和促进RA病程进展。此外, Tfr/Tfh稳态对于调节生发中心B细胞以维持免疫平衡至关重要[4]。通过检测RA病程中脾脏和淋巴结Tfr细胞比例,明确其与AI评分和Tfh细胞比例趋势刚好相反,提示RA病程早期和中期Tfr细胞数量比例降低与机体过强异常免疫应答存在密切关联,晚期Tfr细胞参与对异常体液免疫应答的调控过程以维持免疫稳态。

图1 各组脾脏和淋巴结CD4+T 细胞中Tfr和Tfh细胞比例Fig 1 The proportion of Tfr and Tfh in CD4+ T cells in spleen and lymph node of each group

A.Tfr percentage in CD4+T cell of spleen between each group; B.Tfr percentage in CD4+T cell of lymph node between each group;*P<0.05,**P<0.001 compared with control group;△P<0.01 compared with early stage group;#P<0.05 compared with middle stage group
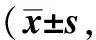

A.Tfh percentage in CD4+T cell of spleen between each group; B.Tfh percentage in CD4+T cell of lymph node between each group;*P<0.01 compared with control group;△P<0.01 compared with early stage group;#P<0.05 compared with middle stage group


A.Thr/Tfh ratio in spleen between each group; B.Tfr/Tfh ratio in lymph node between each group;*P<0.05,**P<0.01,***P<0.001 compared with control group;△P<0.01 compared with early stage group;#P<0.01 compared with middle stage group
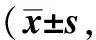
本实验用CIA小鼠系统性对病程中Tfh和Tfr细胞变化规律进行分析,明确Tfh和Tfr细胞通过动态调控参与RA病理进程阶段,此研究不仅对于评估RA患者体内体液应答水平具有一定参考价值,而且为Tfh和Tfr成为可行性细胞治疗靶点提供研究基础。
[1] Barhamain AS, Magliah RF, Shaheen MH,etal. The journey of rheumatoid arthritis patients: a review of reported lag times from the onset of symptoms[J].Open Access Rheumatol, 2017,28:139- 150.
[2] Kurkó J,Besenyei T,Laki J,etal.Genetics of rheumatoid arthritis-a comprehensive review[J].Clin Rev Allergy Immunol, 2013,45:170- 179.
[3] Ye L, Jiang B, Deng J,etal.IL- 37 alleviates rheumatoid arthritis by suppressing IL- 17 and IL- 17-triggering cytokine production and limiting Th17 cell proliferation[J].J Immunol, 2015,194:5110- 5119.
[4] Park HJ, Kim DH, Lim SH,etal. Insights into the role of follicular helper T cells in autoimmunity[J]. Immune Netw, 2014, 14:21- 29.
