siRNA靶向抗酶抑制剂下调前列腺癌细胞PC3中鸟氨酸脱羧酶表达
2018-03-29王艳林吴红艳
金 涛,李 倩,欧 洁,王艳林,吴红艳, *
(1.三峡大学人民医院(宜昌市第一人民医院); 2.三峡大学医学院 肿瘤微环境与免疫治疗湖北省重点实验室; 3.三峡大学医学院 免疫学系, 湖北 宜昌 443002)
鸟氨酸脱羧酶(ornithine decarboxylase,ODC)是多胺合成的关键酶[1- 2]。细胞内ODC活性增加与细胞转化及肿瘤形成密切相关[3]。
哺乳动物ODC的调控非常复杂[3]。细胞内存
在一种天然的ODC 非竞争性蛋白抑制因子,即抗酶(antizyme,AZ)。AZ与ODC单体的结合可促进ODC亚基以非泛素化形式被26S 蛋白酶体降解,降低ODC活性[4- 5]。
抗酶抑制剂(antizyme inhibitor,AZIN)也参与对ODC的调控[6- 7],它可通过封闭AZ来稳定ODC水平。AZIN 能与AZ 高亲和性结合为杂二聚体,且AZIN-AZ 的亲和力远大于AZ-ODC 的亲和力。所以AZIN 能竞争性结合AZ-ODC 复合体中的AZ,释放被AZ 捕获的ODC 亚基,恢复ODC 的酶活性。
AZIN在乳腺癌、肝癌及皮肤癌等多种肿瘤中表达上调[6],本研究在确认前列腺癌细胞高表达AZIN的基础上,拟通过siRNA(small interfering RNA)干扰AZIN的表达水平,探讨其对ODC表达水平及对前列腺癌细胞增殖的影响,为抗肿瘤治疗提供新策略。
1 材料与方法
1.1 细胞、组织及试剂
PC3细胞(中国典型培养物保藏中心);正常前列腺组织和前列腺癌组织分别来自前列腺癌根治术患者及意外死亡者;AZIN(Proteintech公司); siRNA-AZIN序列:oligo- 877:5′-GGAACCGGAUUU GCUUGUUTT-3′(正义),5′-AACAAGCAAAUCCGG UUCCTT-3′(反义);oligo-1006:5′-GGAGUGAAU AUCCUGACAUTT-3′(正义),5′-AUGUCAGGAUA UUCACUCCTT-3′(反义)(上海吉玛制药技术有限公司);Trizol和BCA蛋白浓度检测试剂盒(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 细胞培养:用含10%小牛血清的RPMI1640培养基在37 ℃和5% CO2条件下培养人前列腺癌PC3细胞系。
1.2.2 Western blot检测AZIN的表达: 分别提取各组织及前列腺癌PC3细胞的总蛋白,用BCA蛋白浓度检测试剂盒测蛋白浓度,取等量蛋白进行10% SDS-PAGE电泳,随后将蛋白转印到PVDF上,用含5%脱脂奶粉的TBST溶液室温封闭1 h,4 ℃一抗孵育过夜,TBST洗膜3次,用相应的辣根过氧化物酶标记的二抗室温孵育1 h,TBST洗膜3次后ECL显色发光检测相应条带。β-actin作为内参照。
1.2.3 细胞转染及分组: 当人前列腺癌PC3细胞系增殖至80%时,用lipofectamine2000试剂严格按照步骤进行转染,实验分组:未转染的PC3细胞、AZIN-siRNA- 877转染组、AZIN-siRNA- 1006转染组和 Scrambled siRNA转染组。转染48 h后进行RNA干扰效率的检测。
1.2.4 RT-PCR检测细胞AZ、AZIN和ODC mRNA表达水平: 用Trizol试剂裂解细胞,提取总RNA,通过cDNA合成试剂盒反转录合成cDNA。分别扩增AZ、AZIN、ODC及β-actin。AZ的上游引物为5′-C CTCCACTGCTGTAGTAACCCG-3′,下游引物为5′-C CAAAAAGCTGAAGGTTCGGA-3′;AZIN的上游引物为5′-ATGTGTGTTTGACATGGCTGGAG-3′,下游引物为5′-GAGGCTCATCTTCCTTGTATTTCTTG-3′;ODC的上游引物为5′-AAAGCAAAGTTGGTTTTGCGG ′, 下游引物为5′-CCTTGGCATCTGAGCGAGTA-3′。β-actin的上游引物为5′-GGCATCACACTTTCTACA ACG-3′, 下游引物为5′-GGCAGGAACATTAAAGG TTTC-3′。PCR反应条件为在94 ℃预变性5 min后开始循环,然后94℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,30个循环后,再于72 ℃延伸5 min结束扩增。所得的PCR产物经1.5%琼脂糖凝胶电泳检测分析。
1.2.5 Western blot检测细胞AZ、AZIN和ODC 蛋白表达水平: 细胞转染48 h后分别提取各组细胞的总蛋白,用BCA蛋白浓度检测试剂盒测蛋白浓度,去等量蛋白进行10%SDS-PAGE电泳,随后将蛋白转印到硝酸纤维膜上,用含5%脱脂奶粉的TBST溶液室温封闭1 h,4 ℃一抗孵育过夜,TBST洗膜3次,用相应的辣根过氧化物酶标记的二抗室温孵育1 h,TBST洗膜3次后ECL显色发光检测相应条带。β-actin作为内参照。
面对脑卒中这个人类共同的敌人,华山医院作为领头羊,将继续坚持“全程化、精细化、高效化、绩效化和让社会公众放心满意”的目标,不断深化与完善上海市脑卒中预防与救治服务体系建设,为保障市民健康贡献自己的力量。
1.2.6 MTT检测细胞增殖: 将处于对数增殖期的PC3细胞计数后接种于96孔板,转染siRNA,每组设4个复孔,转染4 h后换成完全培养基,37 ℃继续培养24、48和72 h,弃上清液,加MTT溶液,使其终浓度为200 mg/L,37 ℃孵育4 h后加DMSO 150 μL,振荡混匀后测量570 nm处的吸光度值,分别得到24、48和72 h数据。
1.3 统计学分析
实验数据用SPSS(version 10.0)软件进行统计学分析。采用均数比较的t检验处理实验结果,比较各组资料差异的显著性。
2 结果
2.1 前列腺癌组织及前列腺癌细胞AZIN表达量增加
与正常前列腺组织相比,前列腺癌组织及前列腺癌PC3细胞AZIN的蛋白表达量明显增加(P<0.05)(图1)。
2.2 siRNA-AZIN在mRNA水平下调AZIN表达
相对于空白组(no siRNA)和阴性对照组(scramble siRNA),oligo- 877(siRNA1)和 oligo- 1006(siRNA2)均可降低AZIN RNA表达水平(P<0.01)(图2)。

A:AZIN protein expression was detected by Western blot, 1.normal prostate tissue, 2.prostate cancer tissue, 3.prostate PC3 cells; B: relative expression of AZIN;*P<0.05 compared with normal prostate tissue

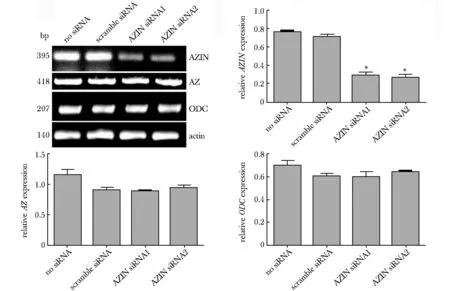
*P<0.01 compared with no siRNA and scramble siRNA图2 siRNA-AZIN在mRNA水平下调AZIN表达Fig 2 siRNA-AZIN down regulated the mRNA level of n=3)
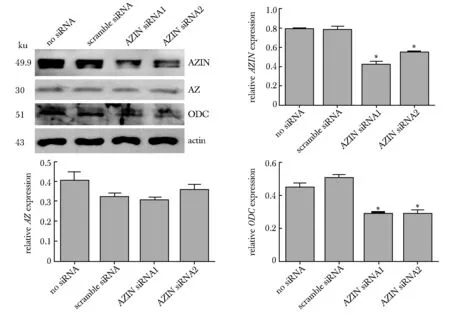
*P<0.05 compared with no siRNA and scramble siRNA图3 siRNA-AZIN在蛋白水平下调AZIN和ODC的表达Fig 3 siRNA-AZIN down regulated the protein level of AZIN and n=3)
2.3 siRNA-AZIN在蛋白水平下调AZIN和ODC的表达
相对于空白组(no siRNA)和阴性对照组(scramble siRNA),oligo- 877(siRNA1)和 oligo- 1006(siRNA2)均可降低AZIN蛋白表达水平(P<0.05),且使ODC的表达水平降低(P<0.05)(图3)。
2.4 AZIN表达下调影响前列腺癌PC3细胞的增殖能力
相对于空白组(no siRNA)和阴性对照组(scramble siRNA),oligo- 877(siRNA1)和 oligo- 1006(siRNA2)转染组细胞增殖能力减弱,且随着时间的延长,siRNA组增殖能力明显减弱(P<0.05)(图4)。
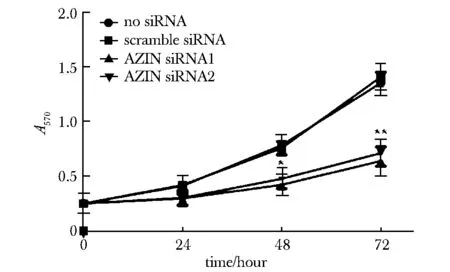
*P<0.05, **P<0.01 compared with no siRNA and scramble siRNA图4 AZIN表达下调影响前列腺癌PC3细胞的增殖Fig 4 Expression of AZIN down-regulates the prolifer-
3 讨论
ODC表达上调和多胺在细胞的积聚与肿瘤细胞转化密切相关[8]。ODC的表达受多种因素的调节,其中ODC/多胺/AZ负反馈调节通路发挥重要作用。细胞内的AZ活性受到AZIN的调控,因为AZIN与AZ的亲和力比AZIN和ODC的亲和力高,可使ODC从ODC和AZ的复合物中解离出来。最终导致ODC的产生量增加,此外,AZIN还可稳定新合成的ODC。
本实验结果发现,siRNA下调AZIN的表达后,AZ在mRNA和蛋白水平的表达都无明显变化,可能是AZIN降低了AZ的活性,但对AZ的表达量无明显影响,但AZIN的表达下调使ODC的表达量降低,最终抑制前列腺癌PC3细胞的增殖。
总之,本结果表明,用siRNA-AZIN可有效减少前列腺癌细胞中AZIN的表达水平,最终导致ODC表达量的降低及细胞抑制。提示调节AZIN可作为肿瘤,尤其是前列腺癌治疗的潜在靶标。
[1] 吴红艳,黄亚,王艳林. 多胺的合成代谢与肿瘤治疗[J]. 基础医学与临床,2016, 36:1578- 1581.
[2] Ramani D, De Bandt JP, Cynober L. Aliphatic polyamines in physiology and diseases [J]. Clin Nutr, 2014, 33:14- 22.
[3] Nowotarski SL, Woster PM, Casero RA. Polyamines and cancer: implications for chemotherapy and chemoprevention [J]. Expert Rev Mol Med, 2013, 15:e3. doi: 10.1017/erm.2013.3.
[4] Bercovich Z, Snapir Z, Keren-Paz A,etal. Antizyme affects cell proliferation and viability solely through regulating cellular polyamines [J]. J Biol Chem, 2011, 286:33778- 33783.
[5] Olsen RR, Zetter BR. Evidence of a role for antizyme and antizyme inhibitor as regulators of human cancer [J]. Mol Cancer Res, 2011, 9:1285- 1293.
[6] Qiu S, Liu J, Xing F. Antizyme inhibitor 1: a potential carcinogenic molecule [J].Cancer Sci, 2016, 21. doi: 10.1111/cas.13122.
[7] Silva TM, Cirenajwis H, Wallace HM,etal. A role for antizyme inhibitor in cell proliferation [J]. Amino Acids, 2015, 47:1341- 1352.
[8] Shukla-Dave A, Castillo-Martin M, Chen M,etal. Ornithine decarboxylase is sufficient for prostate tumori-genesis via androgen receptor signaling[J]. Am J Pathol, 2016, 186:3131- 3145.
新闻点击
心力衰竭蛋白质与早期脑部损伤有关
据美国WebMD医学新闻网(2016- 12- 17)报道,一篇新研究认为,特定心脏病蛋白质的高血中浓度与脑部损伤相关。
N端前B型利钠胜肽(NT-proBNP)是应对心脏壁压力而释放到血液中的一种蛋白质。当心力衰竭恶化时,血中的NT-proBNP值上升,当心力衰竭状况缓解时,此数值则降低。
之前的研究发现,心脏病和脑部疾病之间有关联,但是不清楚NT-proBNP的作用。
荷兰的研究者探讨近2 400名中年与年长的无痴呆症心脏病患者,发现血中NT-proBNP值与MRI测得的脑部损伤之间有明确关联,但是,这篇研究并未证实这个蛋白质的浓度较高时会引起脑部损伤。
这篇研究在线发表于2016年12月7日的《放射医学》(Radiology)。
