羟基红花黄色素A减轻大鼠心肌细胞缺氧/复氧损伤
2018-03-29沈冰冰朱启仁王志荣张卓琦
沈冰冰,张 松,朱启仁,王志荣,张卓琦*
(1.徐州医科大学, 江苏 徐州 221000; 2.徐州医科大学附属医院 心内科, 江苏 徐州 221000)
随着冠状动脉搭桥术、经皮冠状动脉内成形术等血管再通术的迅速开展,冠心病再灌注治疗出现了一个飞跃。但心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)也成为阻碍缺血心肌从再灌注疗法获得最佳疗效的主要难题,如何减轻MIRI成为医学界新的挑战[1]。据报道激活磷酸肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路可以防止神经元凋亡和保护大脑免受缺血再灌注损伤[2]。丝氨酸/苏氨酸蛋白激酶(Akt)通过PI3K依赖通路可以促进脑缺血后细胞的存活[3]。活化的Akt可以磷酸化几个下游靶标包括糖原合酶激酶3b(GSK3b),该激酶在丝氨酸9(ser9)被Akt磷酸化并失活[4]。羟基红花黄色素A(hydroxysafflor yellow A,HSYA)是从化合物红花中分离获得的,具有各种生物活性,包括抗氧化、抗炎性反应作用、抗血小板聚集、抗肿瘤和抗心肌损伤作用[5]。研究表明HSYA可通过抑制线粒体通透性转换孔的开放保护大鼠心肌细胞I/R损伤[6]。
本实验进一步探讨是否可以通过调控PI3K/Akt/GSK3β信号通路保护心肌细胞缺氧/复氧(anoxia/reoxygenation,A/R)损伤。
1 材料与方法
1.1 材料与试剂
清洁级新生1~3 d的SD大鼠乳鼠,雌雄不限[徐州医科大学实验动物中心,许可证号:SCXK(苏)2015- 0009]。HSYA(大连美仑公司,批号A1228AS,HPLC≥98%),Ⅰ型胶原酶(Sigma公司);高糖DMEM培养基、胎牛血清(Gibco公司);total Akt, phospho-Akt (Ser473), GSK3β 和 phospho-GSK3β(Ser9)一抗(CST),Bax、Bcl- 2一抗(Santa Cruz公司)和兔β-actin抗体(Bioworld公司),二抗(碧云天公司);凋亡检测试剂盒(南京凯基公司);乳酸脱氢酶(LDH)试剂盒(南京建成公司)。
1.2 方法
1.2.1 细胞分离培养及分组处理:分离大鼠的乳鼠心肌细胞,孵育48 h,待细胞贴壁后,分为:对照组(Con组)、缺氧复氧组(A/R组)、HSYA处理组(A/R+H组)、 PI3K抑制剂(LY294002)处理组(A/R+L组)和HSYA+ LY294002处理组(A/R+H+L)。正常对照组细胞一直置于CO2培养箱中。A/R组行缺氧10 h,复氧2 h。HSYA加药处理组在缺氧液中加入20 μmol/L HSYA[7],LY294002处理组在缺氧液中加入10 μmol/L LY294002[7]。
1.2.2 细胞培养上清液LDH释放量的测定:根据LDH试剂盒操作步骤进行,用酶标仪在450 nm测各组A值,带入公式算出LDH含量(U/L)。
1.2.3 流式检测细胞凋亡:参照细胞凋亡检测试剂盒使用说明操作,用流式细胞仪检测。
1.2.4 Western blot检测Bcl- 2、Bax、 Akt和p-Akt(Ser473)、GSK3β和p-GSK3β(Ser9)的蛋白表达水平:分组处理完毕后收集各组细胞,加入细胞裂解液,收集蛋白;经BCA法测浓度后,行聚丙烯酰胺凝胶电泳(SDS.PAGE),按半干转方法转移至PVDF膜,封闭后,加入一抗4 ℃孵育过夜,洗膜后二抗室温孵育1 h,再洗膜后,显色。用Image J图像分析蛋白条带。
1.3 统计学分析
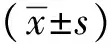
2 结果
2.1 HSYA可降低各组的LDH释放量
与对照组比较,A/R后LDH的释放量增加(P<0.001),与A/R组比较,A/R+H组LDH释放量降低(P<0.001),与A/R+H组比较, A/R+L组、A/R+H+L组LDH释放量增加(P<0.001)(图 1)。
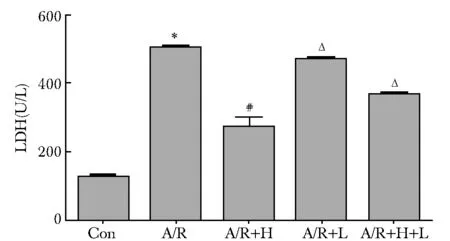
*P<0.001 compared with the Con group;#P<0.001 compared with the A/R group; ΔP<0.001 compared with the A/R+H group图1 原代心肌细胞LDH释放量的改变Fig 1 Change in the LDH release of primary cardiomy-
2.2 HSYA处理可降低A/R后心肌细胞的凋亡率
与对照组比较,A/R后细胞的凋亡率增加(P<0.001);与A/R组比较,A/R+H组凋亡率降低(P<0.001),与A/R+H组比较,A/R+L组、A/R+H+L组细胞凋亡率增加(P<0.001)(图2)。
2.3 Western blot检测Bcl- 2、Bax、 Akt、p-Akt(Ser473)、GSK3β和p-GSK3β(Ser9)的蛋白表达水平
2.3.1 A/R后各实验组凋亡相关蛋白表达水平的比较:与对照组相比,A/R后促凋亡蛋白Bax表达增加(P<0.001),而抗凋亡蛋白Bcl- 2表达减少(P<0.001);与A/R组相比,A/R+H组Bax蛋白表达减少(P<0.001),而Bcl- 2蛋白表达增加(P<0.001);与A/R+H组比较,A/R+H+L组Bax蛋白表达增加(P<0.001),而Bcl- 2蛋白表达明显减少(P<0.001)(图3,4)。
2.3.2 A/R后各实验组Akt和p-Akt(Ser473)、GSK3β和p-GSK3β(Ser9)蛋白表达水平的比较:与对照组相比,A/R后p-Akt(Ser473)、p-GSK3β(Ser9)蛋白表达减少(P<0.001);与A/R组相比,A/R+H组p-Akt(Ser473)、p-GSK3β(Ser9)蛋白表达增加(P<0.001);与A/R+H组比较,A/R+H+L组p-Akt(Ser473)、p-GSK3β(Ser9)蛋白表达降低(P<0.001)(图5,6)。
3 讨论
心血管疾病是全世界死亡的主要原因,并且仍然是现代社会的主要杀手之一。它可以由多种因素启动,包括缺血/再灌注损伤。细胞凋亡是细胞死亡的生理过程,在各种生物系统中发挥关键作用,这一直是被认为为缺血/再灌注损伤的启动和进展提供了重要的分子基础[8]。红花黄色素是从红花的花瓣中提取出的天然黄色素,为查耳酮类化合物。研究发现红花黄色素具有扩张冠状动脉、改善心肌缺血、抑制血栓形成、抑制细胞凋亡、抗氧化、抗感染和脑保护[9]等多种药理功能。HSYA是红花黄色素的主要成分,研究发现,在大鼠中,HSYA可通过PI3K/Akt/GSK3β信号通路发挥抗凋亡作用来保护脑缺血再灌注损伤[10]。但PI3K/Akt/GSK3β信号通路在心肌细胞中的具体作用机制,目前尚无报道,本实验通过培养原代心肌细胞模拟MIRI损伤来研究该通路在心肌细胞中的作用机制。实验中通过检测各组细胞的上清液的LDH的释放量和各组细胞的凋亡率,结果显示A/R后LDH释放量和凋亡率增加,而加用HSYA处理后,LDH和凋亡率降低,而加入PI3K的抑制剂LY294002后这种作用消失,表明HSYA可减少心肌细胞的凋亡,而这种保护作用可能是通过PI3K这条途径发挥作用的。

*P<0.001 compared with the Con group;#P<0.001 compared with the A/R group; ΔP<0.001 compared with the A/R+H group

*P<0.001 compared with the Con group;#P<0.001 compared with the A/R group;ΔP<0.001 compared with the A/R+H group图3 各组凋亡蛋白Bax表达水平的比较Fig 3 Comparision of the protein expression of
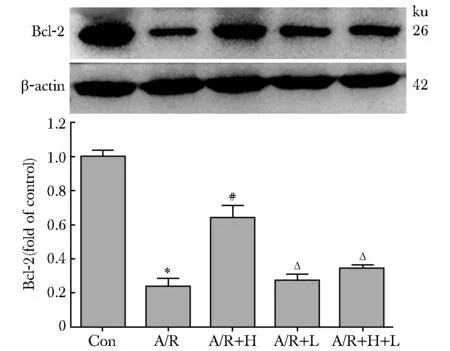
*P<0.001 compared with the Con group;#P<0.001 compared with the A/R group;ΔP<0.001 compared with the A/R+H group图4 各组凋亡蛋白Bcl- 2表达水平的比较Fig 4 Comparision of the protein expression of
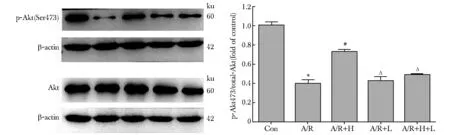
*P<0.001 compared with the Con group;#P<0.001 compared with the A/R group;ΔP<0.001compared with the A/R+H group

*P<0.001 compared with the Con group;#P<0.001 compared with the A/R group;ΔP<0.001compared with the A/R+H group
本实验结果显示A/R后促凋亡蛋白Bax表达增多,而抗凋亡蛋白Bcl- 2表达减少;HSYA处理后,可减少促凋亡蛋白表达,增加抗凋亡蛋白表达;而加入抑制剂LY294002后, HSYA的抗凋亡作用消失,表明HSYA可减少心肌细胞的凋亡,并且是通过激活PI3K这条通路发挥作用的。
PI3K/Akt是细胞内重要的信号传导通路之一,其在细胞的凋亡、存活、增殖以及细胞骨架的变化等中发挥着重要的生物学功能。PI3K下游有多种效应分子,Akt 处在这一通路的中心环节,是 PI3K 直接靶点和最主要的靶酶。只有磷酸化的 Akt才能发挥抗凋亡蛋白合成及促细胞生存等功能[11]。一项研究显示在HSYA诱导的脑缺血再灌注损伤抗凋亡作用中,GSK3β是PI3K/Akt信号通路的一个重要的下游因子[10]。本实验Western blot检测表明, A/R后Akt(Ser473)、p-GSK3β(Ser9)蛋白表达明显减少;而经HSYA处理后,p-Akt(Ser473)、p-GSK3β(Ser9)蛋白表达增加,加入抑制剂LY294002后该作用消失,证实HSYA的这种保护作用可能是通过激活PI3K/Akt/GSK3β这条通路发挥的。
[1] 刘伊娜, 朱健华, 吴翔, 等.羟基红花黄色素A抗心肌细胞缺氧复氧损伤的线粒体相关机制[J].江苏大学学报(医学版),2013,23:313- 316.
[2] Zhang J, Deng Z, Liao J,etal.Leptin attenuates cerebral ischemia injury through the promotion of energy metabolism via the PI3K/Akt pathway[J].J Cereb Blood Flow Metab,2013,33:567- 574.
[3] Cantley LC.The phosphoinositide 3-kinase pathway[J].Science,2002,296:1655- 1657.
[4] Martin M, Rehani K, Jope RS,etal.Toll-like receptor-mediated cytokine production is differentially regulated by glycogen synthase kinase 3[J].Nat Immunol,2005,6:777- 784.
[5] Wu Y, Wang L, Jin M,etal.Hydroxysafflor yellow A alleviates early inflammatory response of bleomycin-induced mice lung injury[J].Biol Pharm Bull,2012,35:515- 522.
[6] Liu YN, Zhou ZM, Chen P.Evidence that hydroxysafflor yellow a protects the heart against ischaemia-reperfusion injury by inhibiting mitochondrial permeability transition pore opening[J].Clin Exp Pharmacol Physiol,2008,35:211- 216.
[7] 许爱斌,刘建国,张健,等.羟基红花黄色素A对心肌细胞缺血_再灌注损伤的保护作用[J].中国循证心血管医学杂志,2015,7:663- 665.
[8] Pratap J, Imbalzano KM, Underwood JM,etal.Ectopic runx2 expression in mammary epithelial cells disrupts formation of normal acini structure: implications for breast cancer progression[J].Cancer Res,2009,69:6807- 6814.
[9] 杨晓媛,任玉芳.红花黄色素药理作用研究进展[J].热带医学杂志,2015,15:421- 424.
[10] Chen L, Xiang Y, Kong L,etal.Hydroxysafflor yellow A protects against cerebral ischemia-reperfusion injury by anti-apoptotic effect through PI3K/Akt/GSK3beta pathway in rat[J].Neurochem Res,2013,38:2268- 2275.
[11] 李钢,杨双强.PI3K/Akt通路在硫化氢后处理保护心肌细胞缺氧复氧损伤中的作用[J].第三军医大学学报,2011,33:1803- 1807.
