白藜芦醇靶向mTORC2/Rictor抑制HUVECs的增殖迁移及管腔形成
2018-03-29李明珠刘丽乔刘卓琦
李明珠,刘丽乔,刘卓琦,王 群
(南昌大学 1.第一临床医学院; 2.基础医学院 生物化学与分子生物学教研室; 3.第一附属医院 心胸外科,江西 南昌 330006)
冠状动脉旁路移植术是外科治疗心血管疾病的重要手段[1]。自体大隐静脉是手术最常见的选择[2],但其远期通畅率并不理想,术后1年有超过20%的静脉出现再狭窄,该比例在术后10年提升至60%[3]。临床上主要用2类抗增殖剂来预防再狭窄:雷帕霉素靶蛋白抑制剂和紫杉醇及其衍生[4]。
哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin, mTOR) 是生长因子和细胞因子下游的主要信号传导通路,参与调控细胞存活、增殖和分化;其存在两种结构和功能不同的多蛋白复合物mTORC1和mTORC2[5],两者的活性分别由特异性辅助因子(包括Raptor和Rictor)调节[6]。它们对mTOR抑制剂的敏感程度不同是长期使用mTOR抑制剂导致不良反应的主要原因之一[7],靶向抑制mTOR通路是提高再狭窄治疗效果和减轻毒性反应的新思路。
小型酚类化合物白藜芦醇(resveratrol, Res)广泛存在于葡萄、花生和藜芦等多种植物中,因其天然无毒等特点,近年来颇受中老年慢性病患者的青睐,在食品、药品及保健品领域应用广泛。白藜芦醇还具有心血管保护功能[8- 9],有望成为一种对抗移植物再狭窄的备选药物[10]。本研究以腺病毒为载体,介导人脐静脉内皮细胞Rictor基因过表达,观察白藜芦醇对HUVECs增殖、迁移及体外管腔形成的影响。
1 材料与方法
1.1 材料
白藜芦醇(纯度99%,Sigma公司);用DMSO溶解配成100 mmol/L的原溶液, -20 ℃避光保存,实验前以RPMll640培养液稀释至使用浓度50 μmol/L;人脐静脉内皮细胞(ATCC公司);GV341载体体系、HEK 293T细胞系和TOP10感受态细胞(上海吉凯公司);pBHG lox ΔE1,3 Cre(Microbix公司);限制性核酸内切酶(NEB公司);Taq DNA多聚酶(Sinobio公司);LipofectamineTM2000 (Invtrogen公司);In-FusionTMPCR 克隆试剂盒(Clontech公司);兔抗人Rictor单克隆抗体(CST公司);辣根过氧化物酶标记的鼠抗兔和兔抗鼠抗体(Santa Cruz公司);CCK- 8试剂盒(日本同仁公司)。
1.2 方法
1.2.1 Rictor重组穿梭质粒的构建:利用cDNA文库,参照人源Rictor (NM_152756) 基因序列相关信息设计PCR引物,Rictor-P1:5′-AGGTCGACTCTAGA GGATCCCGCCACCATGGCGGCGATCGGCCGCGGCC GCTCTCTGAAGAACC-3′;Rictor-P2:5′-TCCTTGTA GTCCATACCGGATTCAGCAGATGTATCAACTATAGG TTGCTTTGGTG-3′。利用上述引物进行PCR扩增,产物经2%琼脂凝胶电泳回收目的基因片段。BamHⅠ/AgeⅠ双酶切回收的DNA片段与GV314载体(图1A),用In-fusionTM PCR克隆反应体系,42 ℃ 15 min连接。产物转化TOP10感受态细胞,对抗性克隆进行测序分析,将正确克隆菌液扩大培养、抽提。

图1 GV314载体(A)和辅助包装质粒(B)图谱 Fig 1 Profiles of vector GV314 (A) and helper plasmid (B)
1.2.2 重组腺病毒载体的包装、扩增:用AdMax腺病毒包装体系,将上述重组质粒与辅助包装质粒pBHG lox ΔE1, 3 Cre(图1B)混合,通过脂质体试剂LipofectamineTM2000共转染293T细胞,用Cre/loxP重组酶切割系统获得重组腺病毒。293T细胞培养于含10%胎牛血清的DMEM培养基,转染前2 h更换为无血清培养基,后与DNA/ LipofectamineTM2000复合液混合,培养6 h后更换为完全培养基。约10 d大部分细胞出现病变效应,经-70 ℃/37 ℃反复冻融,收集重组腺病毒初始液重复感染293T细胞2次,按照纯化试剂盒的步骤收集病毒,命名为Ad-Rictor(pAV-MCMV/Rictor-GFP- 3FLAG)。阴性对照组Ad-Null(pAV-MCMV/-GFP)构建方法同上。
1.2.3 Rictor过表达腺病毒感染HUVECs:常规培养HUVECs,选择对数增殖期的细胞分别用Ad-Null和Ad-Rictor感染,48 h后通过荧光显微镜观察空细胞、Ad-Null及Ad-Rictor感染的细胞;提取各组细胞的总蛋白,进行SDS-PAGE电泳分离、转膜、封闭,以1∶1 000比例加入一抗4 ℃孵育过夜,二抗以1∶5 000浓度室温孵育2 h。以GAPDH为内参抗体,实验重复3次。
1.2.4 检测白藜芦醇干预对HUVECs生物学行为影响:实验分为正常细胞对照组(control)、空载体阴性对照组(Ad-Null)、Rictor过表达组(Ad-Rictor)和白藜芦醇干预组(Ad-Rictor+Res)。
CCK- 8试剂盒检测HUVECs增殖活力。细胞按照实验分组接种于96孔板(1.0×104个细胞/ mL)常规孵育24 h,每孔加入10 μL CCK8试剂。酶标仪检测450 nm光波处的每孔吸光度值A,各重复孔取均值。
划痕检测HUVECs迁移能力。取对数期HUVECs制备细胞悬液(稀释浓度约8×104个/mL)接种于6孔板,待细胞增殖至90%汇合以上,用微量移液器枪头均匀地在每孔中十字划线,洗净死细胞后加入等体积含或不含白藜芦醇的培养基,常规培养动态检测24 h。
体外成管实验检测HUVECs管腔形成能力。24孔板预冷,每孔加入200 μL液化的Matrigel胶,平衡20 min后凝固备用。取对数期细胞制备细胞悬液,细胞板计数后加或不加白藜芦醇,并稀释细胞约5×104个/mL;铺好胶的24孔板每孔加入800 μL细胞悬液,常规培养48 h后拍照。每孔分别取5个部位(上、下、左、右及中间)拍照计算成管数量。
1.3 统计学分析
2 结果
2.1 目的基因Rictor扩增结果
PCR产物电泳图可见一约5 168 bp的特异性条带,与目的基因Rictor一致(图2)。
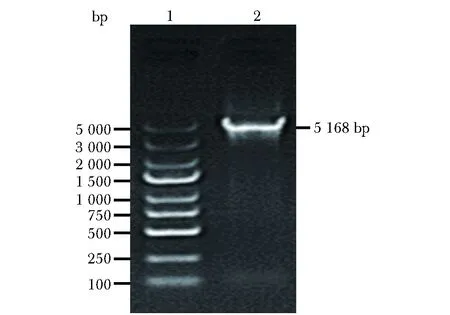
1.DNA ladder; 2.DNA fragment图2 Rictor基因克隆电泳图Fig 2 Amplification of Rictor gene
2.2 重组腺病毒感染HEK 293T细胞
荧光显微镜观察,被感染的细胞可检测到绿色荧光蛋白发出的荧光,说明Rictor过表达腺病毒载体构建成功,感染效率较高(图3)。
2.3 重组腺病毒感染HUVECs并上调Rictor蛋白表达
荧光显微观察HUVECs发现大量被Ad-Null和Ad-Rictor感染的细胞发出绿色荧光,而对照组未检测到荧光(图4)。Ad-Rictor组在相对分子质量200 ku处可见显著的Rictor蛋白表达条带; 而对照组、Ad-Null组蛋白条带均表达微弱(图5)。

图3 荧光显微镜观察Ad-Rictor感染293T细胞Fig 3 Fluorescent microscopy of 293T cells infected with Ad-Rictor

图4 Ad-Rictor感染HUVECs的荧光鉴定Fig 4 Fluorescence identification of HUVECs infected with Ad-Rictor
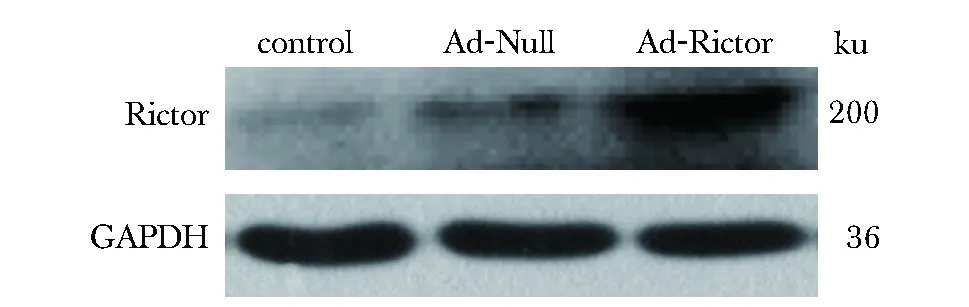
图5 各组Rictor蛋白表达情况Fig 5 Protein expression of Rictor between groups
2.4 各组HUVECs细胞增殖情况比较
CCK- 8结果显示,Ad-Rictor组细胞增生数量明显高于对照组和Ad-Null组(P<0.05);而Ad-Rictor+Res细胞数量不仅明显低于Ad-Rictor组(P<0.05),与对照组相比也有降低(P<0.05)(图6)。

*P<0.05 compared with control group; △P<0.05 compared with Ad-Rictor group图6 各组HUVECs细胞增殖情况Fig 6 Proliferation activities of HUVECs between
2.5 各组HUVECs细胞迁移能力比较
划痕实验显示,Ad-Rictor组迁移距离与对照组相比有显著增强;Ad-Rictor+Res组细胞定向迁移能力比Ad-Rictor组有明显降低(P<0.05),与对照组和Ad-Null组差异不大(图7)。
2.6 各组HUVECs细胞体外管腔形成能力比较
血管生成实验显示,相比于对照组和Ad-Null组,Ad-Rictor组成形管腔数量明显增高 (P<0.05);Ad-Rictor+Res组成形管腔数量显著低于Ad-Rictor组 (P<0.05)(图8)。
3 讨论
旁路移植手术是闭塞性动脉疾病最常用的血运重建技术,短期内非常有效,但静脉移植物长期暴露于动脉环境会引起结构性血管壁重塑和内膜增厚,移植术后早期的不良静脉重塑是移植再狭窄的重要病理基础[3]。课题组在前期转录组测序数据的基础上寻找基因的突破口,发现mTOR2参与了静脉移植物的早期重塑,表现为此通路中Rictor基因表达增强,这是在正常静脉中看不到的[11]。相对于mTORC1,对雷帕霉素不敏感的mTORC2对血管内皮细胞的调节作用更为关键[6];敲除mTORC2的重要组成部分Rictor可以明显抑制血管内皮细胞增殖和血管生成,但不影响mTORC1信号通路[6,12]。

A.cell wound scratch assay; B.analysis of migration distance in each group图7 各组HUVECs的迁移能力Fig 7 Migration of HUVECs between n=3)

A.microscopic observation of tubular structure(×200); B.the analysis of the number in each group;*P<0.05 compared with control group;△P<0.05 compared with Ad-Rictor group

本实验靶向mTORC2通路构建Rictor过表达腺病毒载体,使其感染研究对象HUVECs。观察到Ad-Null和Ad-Rictor均具有较高的感染效率,其中在HUVECs的感染效率可达89%;Ad-Rictor能成功上调重组蛋白Rictor表达水平,说明过表达Rictor腺病毒载体构建成功。同时,本研究发现HUVECs的增殖、迁移和血管形成能力随之显著增强,进一步证明Rictor是调节血管内皮细胞生物学行为的关键因子。
本研究构建的Ad-Rictor体外模拟了静脉重塑中内皮细胞的Rictor过表达状态,后加入白藜芦醇的干预,发现HUVECs的增殖率、体外迁移距离和管腔形成数量均下降。白藜芦醇对AMPK/mTOR信号通路的调节在其他细胞中已得到验证[13- 14],本研究证明了白藜芦醇对血管内皮细胞的调节作用亦与mTOR2通路有关,表现为抑制内皮细胞在Rictor过表达状态下的过度增殖、迁移以及血管形成能力。
综上所述,白藜芦醇可以靶向mTORC2/Rictor抑制血管内皮细胞的增殖、迁移及管腔形成能力,提示白藜芦醇可抑制静脉内皮细胞增生和血管异生,有望成为一种有效预防移植后再狭窄并避免全身毒性反应的天然药物,为改善旁路移植术后长期结局提供新的治疗思路。
[1] Weintraub WS, Grau-Sepulveda MV, Weiss JM,etal. Comparative effectiveness of revascularization strategies[J]. New England J Med, 2012, 366:1467- 1476.
[2] Shuhaiber JH, Evans AN, Massad MG,etal. Mech-anisms and future directions for prevention of vein graft failure in coronary bypass surgery[J]. Eur J Cardiothorac Surg, 2002, 22:387- 396.
[3] de Vries MR, Simons KH, Jukema JW,etal. Vein graft failure: from pathophysiology to clinical outcomes[J]. Nat Rev Cardiol, 2016, 13:451- 470.
[4] Habib A,Finn AV. Antiproliferative drugs for restenosis prevention[J]. Interv Cardiol Clin, 2016, 5:321- 329.
[5] Kurdi A, De Meyer GR,Martinet W. Potential therapeutic effects of mTOR inhibition in atherosclerosis[J]. Br J Clin Pharmacol, 2016, 82:1267- 1279.
[6] Wang S, Amato KR, Song W,etal. Regulation of endothelial cell proliferation and vascular assembly through distinct mTORC2 signaling pathways[J]. Mol Cell Biol, 2015, 35:1299- 1313.
[7] 刘丽乔,王群. mTOR抑制剂抗动脉粥样硬化的研究进展[J]. 基础医学与临床,2017,37:265- 269.
[8] Chen ML, Yi L, Jin X,etal. Absorption of resveratrol by vascular endothelial cells through passive diffusion and an SGLT1-mediated pathway[J]. J Nutr Biochem, 2013, 24:1823- 1829.
[9] Xia N, Forstermann U,Li H. Resveratrol and endothelial nitric oxide[J]. Molecules, 2014, 19:16102- 16121.
[10] Zhu Y, Takayama T, Wang B,etal. Restenosis inhibi-tion and re-differentiation of TGFbeta/Smad3-activated smooth muscle cells by resveratrol[J]. Sci Rep, 2017, 7:41916.
[11] Wang Q, Wan L, Liu L,etal. Role of the mTOR signalling pathway in experimental rabbit vein grafts[J]. Heart Lung Circ, 2016, 25:1124- 1132.
[12] Zheng NN, Ding XD,Zhang HP. Targeting rictor inhibits mouse vascular tumor cell proliferation and invasioninvitroand tumor growthinvivo[J]. Neoplasma, 2013, 60:41- 45.
[13] Tillu D, Melemedjian OK, Asiedu M,etal. Resveratrol engages AMPK to attenuate ERK and mTOR signaling in sensory neurons and inhibits incision-induced acute and chronic pain[J]. Mol Pain, 2012, 8:5- 13.
[14] Qin N, Wei L, Li W,etal. Local intra-articular injection of resveratrol delays cartilage degeneration in C57BL/6 mice by inducing autophagy via AMPK/mTOR pathway[J]. J Pharmacol Sci, 2017, 134:166- 174.
