亲和吸附材料特异性清除外源性内毒素有效性的研究
2018-03-29向勇平刘理金张金红周立冬杨建明刘爱兵
向勇平,崔 辉,刘理金,张金红,刘 丹,于 杰,周立冬,杨建明,刘爱兵*
(1.锦州医科大学武警总医院研究培养基地,北京 100039; 2.武警总医院医学实验中心,北京 100039;3.灾害救援医学北京市重点实验室,北京 100039; 4.天津市阳权医疗器械有限公司,天津 300350;5.天津市港口医院,天津 300350)
内毒素血症(endotoxemia,ETM)是由于细菌释放大量的内毒素进入机体循环系统,或输入含有大量内毒素感染的液体,从而引发的一种病理表现[1]。内毒素血症可致全身炎症反应综合症(systemic inflammatory response syndrome,SIRS)、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、弥漫性血管内凝血(disseminated intravascular coagulation,DIC)等严重病症。研究表明,血液中内毒素浓度的增高与休克事件的发生有关,进入血液的内毒素浓度越高休克发生可能性越大[2]。机体有细菌存在或有高度可疑感染灶所释放内毒素可致的全身炎症反应综合征(SIRS),病死率约为30%~60%[3]。血液灌流(hemoperfusion,HP)技术可以通过吸附作用清除血液中的内毒素、净化血液,以达到治疗相应疾病的效果。Shoji[4]对多例MODS患者多次进行灌流治疗后,患者内毒素水平从治疗前的76 ng/L降至21 ng/L。先前有研究显示,不同的灌流材料对内毒素的清除作用不同[5]。本实验采用本课题组研发的高分子亲和吸附材料,制备一次性血液灌流器,特异性清除实验犬体内高内毒素,用以验证该亲和吸附材料对清除高内毒素血症的有效性和特异性,为临床上治疗内毒素血症提供新方法。
1 材料和方法
1.1 实验动物
普通级比格犬(性别不限)15只,由军事医学科学院实验动物中心提供,无孕,1~2岁,体重(39±1.8) kg [SCXK (军) 2012-0002]。在军事医学科学院实验动物中心[SYXK (军) 2012-004]饲养1周后进行实验,实验前12 h禁食不禁水,实验过程中按照实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
内毒素(Sigma);内毒素检测鲎试剂盒(厦门鲎试剂实验厂有限公司);TNF-α、IL-1β、IL-6、IL-8 ELISA试剂盒(上海酶联)。心电监护仪(深圳迈瑞ipM12);大型动物麻醉机(北京众实迪创ZS-M);ELX808酶标仪(厦门鲎试剂生物科技有限公司);DTX880酶标仪(美国贝克曼)。
亲和吸附材料及灌流器:本课题组由天津市阳权医疗器械有限公司研发低密度聚合物特异亲和高分子吸附材料,制成一次性使用血液灌流器(DHC-II-340型),该灌流器供本课题犬血液灌流使用。
1.3 实验方法
1.3.1 内毒素动物模型的建立
犬禁食12 h,在麻醉前15 min给予0.25 mL阿托品肌肉注射,并使用氯胺酮4 mg/kg加胃复安10 mg肌肉注射进行诱导麻醉,待犬昏迷后取仰卧位固定四肢,麻醉机维持麻醉。在左颈静脉处静脉留置针穿刺以备抽取血液标本。钝性分离左侧股静脉,进行静脉插管,内毒素0.45 mg/kg溶于生理盐水100 mL,经静脉在30 min内完成输注。
1.3.2 灌流通路的肝素化
启动血泵,用生理盐水300 mL+肝素10 mg,以100 mL/min的速度冲洗灌流器,排除管道内的空气,进行灌流通路的肝素化,最后用生理盐水250 mL+肝素50 mg在灌流通路中闭式循环10 min后备用。
1.3.3 血液灌流
钝性分离犬右侧股动脉,连接灌流导管、血泵和灌流器,形成闭合体外循环通路。由血泵提供动力,血液经过灌流器后返回体内。造模后45 min治疗组用本课题组研发的灌流器灌流,对照组不用该灌流器。灌流开始后用肝素泵持续并追加肝素12 mg/h,在灌流结束前30 min停止使用肝素。灌流120 min后,采用空气回血法让血液流回犬体内,缝合伤口。
1.3.4 测定指标
(1)内毒素检测:分别于灌流开始前、灌流120 min时抽取静脉血2 mL,经离心后取血清,用动态浊度法测定犬血液中内毒素水平。内毒素清除率计算方法:R(%)=(C0- Ct)/C0× 100%,C0、Ct分别为内毒素的初始浓度及t时间吸附后的浓度。
(2)细胞因子测定:用ELISA法测定灌流开始(造模后45 min)、灌流120 min血清中的细胞因子(TNF-α、IL-1β、IL-6、IL-8)的水平。
(3)生命体征监测:实验过程中监测犬的生命体征,包括体温(body temperature)、脉率(pulse rate,PR)、呼吸频率(respiratory rate,RR)、收缩压(systolic arterial pressure,SAP),记录灌流开始(造模后45 min)、灌流60 min、灌流120 min实验动物的生命体征。
1.4 统计学方法

2 结果
2.1 内毒素清除效果
造模成功后,治疗组在灌流开始前、灌流120 min后血液内毒素水平分别为(118.63±27.98)、(0.039±0.009) EU/mL,对照组在灌流开始前、灌流120 min后血液内毒素水平分别为(117.16±22.95)、(131.98±7.01) EU/mL。治疗组灌流开始与灌流120 min比较,差异有显著性(P< 0.05),内毒素平均清除率R=94.07%;对照组灌流开始、灌流120 min比较,差异无显著性(P> 0.05)。
2.2 对细胞因子的清除效果
治疗组、对照组灌流开始、120 min时血清中细胞因子测定结果见表1。
从表1中看出治疗组灌流120 min后血清中各细胞因子(TNF-α、IL-1β、IL-6、IL-8)的水平都有显著下降,与灌流开始时比较差异有显著性(P< 0.05);对照组中各指标灌流120 min后都有所上升,且与灌流开始比较差异有显著性(P< 0.05)。
2.3 对生命体征的影响
两组灌流中,分别记录灌流开始、灌流60 min、灌流120 min三个时间点的生命体征,数据见表2。

Tab.1Clearance effect of cytokines before and after perfusion

治疗组(n=10)Treatmentgroup对照组(n=5)Controlgroup灌流开始Beginningofperfusion灌流120minAfterperfusionfor120min灌流开始Beginningofperfusion灌流120minAfterperfusionfor120minTNF⁃α153±027013±006∗153±006226±015∗IL⁃1β1282±166070±036∗1305±0181512±018∗IL⁃65477±398162±080∗5458±0196254±093∗IL⁃8025±032001±000∗028±006073±093∗
注:与灌流开始相比,*P< 0.05。
Note. Compared with the beginning of perfusion,*P< 0.05.
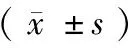
Tab.2Changes of vital signs during perfusion

治疗组(n=10)Treatmentgroup对照组(n=5)Controlgroup灌流开始Beginningofperfusion灌流60minAfterperfusionfor60min灌流120minAfterperfusionfor120min灌流开始Beginningofperfusion灌流60minAfterperfusionfor60min灌流120minAfterperfusionfor120min体温(℃)Bodytemperature385±0.94375±0.84∗369±0.63∗387±019388±009∗392±026∗呼吸频率(每分钟次数)Respiratoryrate(timesperminute)290±1.13250±1.38∗270±0.69∗300±110320±148350±130∗脉率(每分钟次数)Pulserate(timesperminute)850±4.10800±4.58840±3.34870±297890±179∗920±158∗收缩压(mmHg)Systolicarterialpressure1630±11.251580±11.511600±11.551630±3051630±1921640±130
注:单因素方差分析,*P< 0.05。
Note. Single factor analysis of variance,*P< 0.05.
从表2看出,治疗组灌流开始时实验犬体温最高,随着灌流治疗的延续体温逐渐下降,灌流60 min、120 min与灌流开始比较差异有显著性(P< 0.05);灌流60 min、120 min的呼吸频率与灌流开始比较差异有显著性(P< 0.05)。对照组体温、脉率随着灌流的进行逐渐上升,灌流60 min、120 min分别与灌流开始比较差异有显著性(P< 0.05);呼吸频率随灌流的进行逐渐上升,灌流开始与灌流120 min比较差异有显著性(P< 0.05)。两组在灌流中收缩压都保持平稳。
3 讨论
随着材料技术和免疫学的快速发展,吸附材料的发展也日新月异,在医学上的应用也展现出不错的前景。目前,由于膜吸附材料具有脂溶性,对清除高分子溶质、脂溶性好或蛋白结合的毒物作用有限;聚乙烯基咪唑对人体产生不良反应;多粘菌素B容易从载体上脱落加重肾的负担。本课题组选择亲水单烯和疏水芳香双烯单体制得“双亲性”大孔共聚物,再引入间隔臂将此共聚物与含大量氨基酸的配基相连制成“双亲型”亲和吸附材料,这种吸附材料无毒、无味、可降解且具有良好的血液相容性,也能够高效地清除血液中的内毒素及内毒素作用下机体产生的炎症介质,并且能够在使用中具有良好的稳定性。
本课题组研发的亲和吸附材料所制成的一次性灌流器,在犬内源性内毒素血症的研究中已取得极好的效果[6]。本实验将其应用于犬的外源性内毒素血症的清除治疗中,并探讨该材料清除内毒素的有效性。本实验治疗组对内毒素的平均清除率可达94.07%,对清除内毒素作用机体产生的炎症介质也作用十分显著。对照组中内毒素及相应细胞因子的水平保持上升。研究证明,当机体受内毒素刺激后,机体的单核巨噬细胞系统和炎性反应细胞被激活,会释放大量的炎性因子,如TNF-α、IL-1β、IL-6、IL-8等最终导致瀑布样炎症级联反应[7-8]。目前的研究认为,TNF-α、IL-1β、IL-6、IL-8等炎症因子所导致的瀑布样炎症级联反应与体内内毒素的浓度密切相关[9-10],因此阻断瀑布样炎症级联反应,是关于高内毒素血症的靶标治疗[11]。本实验治疗组通过血液灌流,清除血液中的内毒素,及时阻止炎症因子的释放,从而达到减少内毒素对机体单核巨噬细胞系统和炎性反应细胞的刺激,进一步加大了本实验清除内毒素的有效性。内毒素可直接作用于下丘脑体温调节中枢或白细胞,使其释放内源性致热原,引起发热反应[12]。治疗组中犬的体温随着体内内毒素的清除而下降是因为减少了致热原的产生而阻断了发热反应;在灌流过程中呼吸频率、收缩压等生命体征有轻微的波动,但都在正常范围之中趋于平稳。对照组中犬的体温、脉率、呼吸频率都有相应的变化,可能是体内内毒素水平持续升高所导致的,但收缩压保持平稳,说明内毒素及灌流治疗对血压没有影响,待进一步的探讨。
实验结果表明,本课题研发的高分子亲和吸附材料能高效地清除血液中内毒素及内毒素作用机体产生的炎症因子,可以及时降低内毒素对机体的危害。
[1] 蒋庆军. 内毒素检测在内毒素血症治疗中的应用 [J]. 现代中西医结合杂志, 2008, 17(33): 5229-5232.
[2] Shimizu T, Obata T, Sonoda H, et al. Diagnostic potential of endotoxin scattering photometry for sepsis and septic shock [J]. Shock, 2013, 40(6): 504-511.
[3] 严静. 成人严重感染与感染性休克血流动力学监测与支持指南(2006) [J]. 中国实用外科杂志, 2007, 27(1): 7-13.
[4] Shoji H. Extracorporeal endotoxin removal for the treatment of sepsis: endotoxin adsorption cartridge (Toraymyxin) [J]. Ther Apher Dial, 2003, 7(1): 108-114.
[5] Anisimova NY, Gromova EG, Kuznetsova LS, et al. Dynamics of elimination of bacterial endotoxins and cytokines from the blood of tumor patients with sepsis in hemoperfusion using carbon adsorbents [J]. Bull Exp Biol Med, 2011, 151(5): 622-624.
[6] 向勇平, 崔辉, 刘丹, 等. 亲和吸附材料特异性清除肠源性内毒素有效性和安全性探讨 [J]. 中国实验动物学报, 2018, 26(1): 52-56.
[7] Chen J, Zhu RL, Nakayama M, et al. Expression of the apoptosis-effector gene,Bax, is up-regulated in vulnerable hippocampal CA1 neurons following global ischemia [J]. J Neurochem, 1996, 67(1): 64-71.
[8] Ohashi H, Kawasaki N, Komatsu H, et al. Microdialysis detection of lactate in subcutaneous tissue as a reliable indicator of tissue metabolic disorders in an animal sepsis model [J]. J Smooth Muscle Res, 2011, 47(1): 37-46.
[9] 任珊, 赵鹤龄. 拯救脓毒症运动: 2012严重脓毒症和脓毒症性休克管理指南要点 [J]. 河北医药, 2013, 35(8): 1233-1236.
[10] Vanden Berghe T, Demon D, Bogaert P, et al. Simultaneous targeting of IL-1 and IL-18 is required for protection against inflammatory and septic shock [J]. Am J Respir Crit Care Med, 2014, 189(3): 282-291.
[11] Modell JH, Gravenstein N, Morey TE. Body temperature change during anesthesia for electroconvulsive therapy: implications for quality incentives in anesthesiology [J]. Anesth Analg, 2008, 107(5): 1618-1620.
[12] Janelidze S, Hu BR, Siesjö P, et al. Alterations of Akt1 (PKBα) and p70S6Kin transient focal ischemia [J]. Neurobiol Dis, 2001, 8(1): 147-154.
