高糖对人脐静脉内皮细胞CD26的表达及MBL补体途径的影响及作用机制
2018-03-29颜晓勇
潘 登,颜晓勇
(1.中山大学附属东华医院 风湿免疫科,广东 东莞 523000;2.遵义医学院附属医院 肾病风湿科,贵州 遵义 563099)
糖尿病肾病(Diabetic Nephropathy,DN)是糖尿病的主要并发症及死亡原因之一。最近研究证明,炎性反应在DN的发病机制中起关键作用[1-2]。CD26是一种分布于内皮细胞、肾小管上皮细胞及T细胞等多种细胞的跨膜糖蛋白[3],其可与甘露糖结合凝集素(Mannan binding lectin,MBL)相结合[4-5],与DN的发生发展密切相关[6]。本实验通过检测高糖刺激下体外培养的人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVEC)的CD26、MBL、C3、MAC及IL-6和NF-kB的表达,探讨CD26对人脐静脉内皮细胞MBL补体途径及微炎症状态的影响及其作用机制。
1 材料与方法
1.1 实验材料与试剂 人脐静脉内皮细胞(ATCC,美国),低糖DMEM培养基(Gibco,美国),兔抗人CD26多克隆抗体(ab28340),兔抗人MBL单克隆抗体(ab133629),兔抗人C5b-9多克隆抗体(ab55811),兔抗人C3多克隆抗体(ab97462)(Abcam公司,美国),人CD26引物,人IL-6引物,人NF-kB引物(四川生工科技有限公司),RNA逆转录试剂盒(TAKARA公司,大连)等。
1.2 主要仪器 超净工作台(苏州净化有限公司),二氧化碳培养箱(Thermo,美国),离心机(Eppendorf,德国),高压蒸汽灭菌器(SANYO,日本),pH滴定仪(Jenway,美国),酶标仪(LISTEO,美国),Realtime PCR扩增仪(Biorad,美国)等。
1.3 实验方法
1.3.1 实验分组 对照组(加入葡萄糖5.5 mmol/L);高渗组(加入葡萄糖5.5 mmol/L和甘露醇24.5 mmol/L);高糖组(加入葡萄糖30 mmol/L)。
1.3.2 免疫组化法检测细胞的CD26、MBL、C3和MAC的表达 将分组培养的细胞加入4%多聚甲醛固定30 min,设PBS组为阴性对照,加入一抗(CD26 1∶200、MBL 1∶100、C3 1∶100、MAC 1∶200),孵育24 h,复温,吸走一抗,加入1∶200的组化二抗,37 ℃孵育30 min后,显色,返蓝,封片剂封片。于显微镜下观察各组蛋白表达。
1.3.3 Western Blot检测HUVEC的CD26、MBL、C3及MAC的蛋白水平量 将分组培养的细胞离心后加入裂解液、酶抑制剂及蛋白抽提试剂,离心取上清。用BCA蛋白质定量试剂盒,制作标准曲线,并根据OD值计算待测样品蛋白浓度。配胶、转膜,以GAPDH为内参,加入一抗(CD26 1∶1 000、MBL 1∶1 000、C3 1∶2 000、MAC 1∶200),后用TBST清洗加入二抗室温孵育2 h。用化学发光法显影,并用Image J图像分析软件行灰度值分析。
1.3.4 qRT-PCR检测细胞中CD26、IL-6和NF-kB mRNA表达 将分组培养的细胞离心分离后,加入Trizol裂解细胞,后移至EP管中,静置后离心,取上清加0.5 mL异丙醇混匀离心,加1 mL预冷的75%乙醇震荡后,离心弃上清,加0.1%DEPC水50 μL吹打至溶解,提取总RNA,配制qRT-PCR的反应体系,扩增目标基因。qRT-PCR引物序列见表1。反应条件:第1步:95 ℃预变性2 min;第2步:95 ℃变性15 s,60 ℃退火30 s;第3步:72 ℃延伸1 min, 40个循环。以Ct值为统计参数,按2-ΔΔCt法计算mRNA的相对表达情况。
表1 qRT-PCR引物序列

GeneSequenceIDForwardprimerReverseprimerCD26NM_001935.3AAGTGGCGTGTTCAAGTGTTCTTCTGGAGTTGGGAGACIL-6NM_000600.3CTTCGGTCCAGTTGCCTTCTGTGAGTGGCTGTCTGTGTGNF-kBNM_001165412.1CTGAGTCCTGCTCCTTCCAACTTCGGTGTAGCCCATTTGTβ-actinNM_001101.3TGGCACCCAGCACAATGAACTAAGTCATAGTCCGCCTAG

2 结果
2.1 免疫组化法及Western Blot检测HUVEC的CD26、MBL、C3、MAC的蛋白表达 在HUVEC中CD26、MBL、C3、MAC主要表达于胞膜和胞浆,见图1。与对照组及高渗组相比,高糖组CD26、MBL、C3及MAC的蛋白相对表达量均明显增高(P<0.05,见图2,表2)。

A:CD26;B:MBL;C:C3;D:MAC。图1 各指标的免疫组化表达(200×)

图2 各组各指标的蛋白印迹图

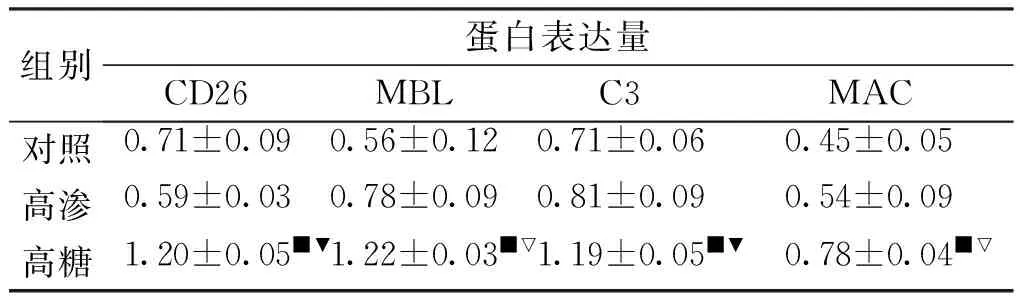
组别蛋白表达量CD26MBLC3MAC对照0.71±0.090.56±0.120.71±0.060.45±0.05高渗0.59±0.030.78±0.090.81±0.090.54±0.09高糖1.20±0.05■▼1.22±0.03■▽1.19±0.05■▼0.78±0.04■▽
与对照组比较:■P<0.01;与高渗组比较:▽P<0.05,▼P<0.01。
2.2 qRT-PCR检测HUVEC的CD26、IL-6和NF-kB mRNA表达 与对照组及高渗组相比,高糖组CD26、IL-6、NF-kB的mRNA相对表达量均增加(P<0.05,见表3)。

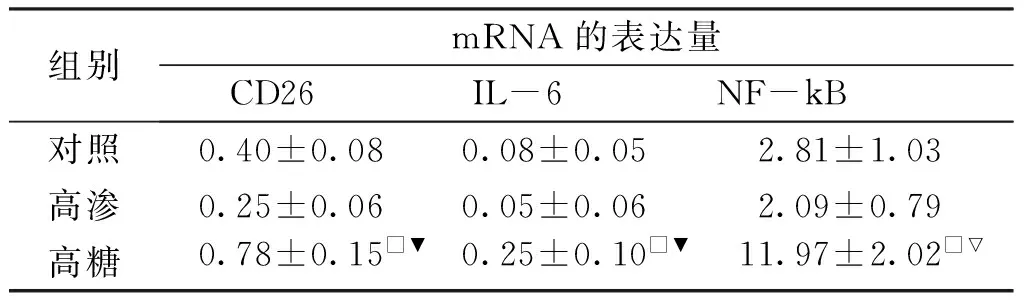
组别mRNA的表达量CD26IL-6NF-kB对照0.40±0.080.08±0.052.81±1.03高渗0.25±0.060.05±0.062.09±0.79高糖0.78±0.15□▼0.25±0.10□▼11.97±2.02□▽
与对照组比较:□P<0.05;与高渗组比较:▽P<0.05,▼P<0.01。
2.3 相关性分析
2.3.1 CD26 Western Blot蛋白表达量与MBL呈正相关(r=0.825,P<0.01);与C3呈正相关(r=0.869,P<0.01);与MAC亦呈正相关(r=0.828,P<0.01)。
2.3.2 CD26的qRT-PCR mRNA相对表达量与IL-6呈正相关(r=0.858,P<0.01);与NF-kB亦呈正相关(r=0.794,P<0.05)。
3 讨论
DN是终末期肾病的主要病因及死亡原因之一[7],是多种发病机制综合作用的结果。因此,研究DN的发生发展机制及其相关治疗方案,将为人类的健康带来巨大收益。CD26作为一种重要的促炎细胞因子可以与MBL相结合,进而激活甘露糖结合凝集素补体途径[8],介导相关炎症反应的发生,进而引起肾脏细胞及组织的损伤[9]。
本实验免疫组化结果显示:在HUVEC中CD26、MBL、C3、MAC主要表达于胞膜和胞浆。Western Blot结果显示:与对照组及高渗组相比较,高糖组人脐静脉内皮细胞CD26、MBL、C3、MAC的蛋白表达量是升高的(P<0.05),而对照组与高渗组相比较,各指标蛋白表达量均无统计学意义(P>0.05),CD26分别与MBL、C3、MAC蛋白表达量呈明显正相关(P值均<0.01)。由此可以看出,高糖条件下,HUVEC的CD26表达增高,其作为MBL的配体与其相结合,激活甘露糖结合凝集素补体途径,进而介导炎症反应的发生,引起细胞及组织的损伤。
qRT-PCR结果显示:与对照组及高渗组相比较,高糖组HUVEC中CD26、IL-6、NF-kB的mRNA表达量是升高的(P<0.05);对照组与高渗组相比较,各指标mRNA的相对表达量均无统计学意义(P>0.05)。且CD26分别与IL-6、NF-kB的mRNA表达量呈正相关(P值均<0.05)。由此我们可以得出:高糖作用下,细胞的CD26、IL-6、NF-kB mRNA的相对表达量是增加的,CD26除了通过激活MBL补体途径,促进和扩大后续炎症反应外,也可能通过直接作用于致炎因子IL-6及NF-kB,从而加重炎症反应的发生,引起肾组织的损伤。
本实验研究了高糖作用下的HUVEC中MBL补体激活途径对细胞炎症反应的影响及其作用机制。而CD26作为一个具备免疫调节作用的粘附分子,在此炎症反应的发生发展过程中占据着重要地位。人脐静脉内皮细胞在高糖作用下细胞内的CD26的表达量是升高的。而大量的CD26可通过激活细胞内的甘露糖结合凝集素补体途径,介导炎症因子IL-6、NF-kB的产生。另外,CD26还有可能通过作用于内肽酶Meprin β及高迁移率族蛋白1等多种蛋白[10-11],使细胞中炎症因子IL-6及NF-kB的表达增加,加重DN者的组织损伤。目前,CD26对DN炎症状态的影响及作用机制还有待于进一步研究。
[1] Feigerlová E,Battaglia-Hsu S F.IL-6 signaling in diabetic nephropathy:From pathophysiology to therapeutic perspectives[J].Cytokine & Growth Factor Reviews,2017,37:57-65.
[2] Li F,Zhang N,Li Z,et al.Toll-like receptor 2 agonist exacerbates renal injury in diabetic mice[J].Experimental and Therapeutic Medicine,2017,13(2):495-502.
[3] Panchapakesan U,Mather A,Pollock C.Role of GLP-1 and DPP-4 in diabetic nephropathy and cardiovascular disease[J].Clin Sci,2013,124:17-26.
[4] Li J,Zhao W.Dipeptidyl peptidase-Ⅳ: potential implications beyond blood glucose control[J].Chinese Journal of Clinical Nutrition,2015,23(4):244-249.
[5] Kawasaki N,Lin C W,Inoue R,et al.Highly fucosylated N-glycan ligands for mannan-binding protein expressed specifically on CD26 (DPPVI) isolated from a human colorectal carcinoma cell line,SW1116[J].Glycobiology,2009,19(4):437-450.
[6] Mikhail N.Use of dipeptidyl peptidase-4 inhibitors in patients with type 2 diabetes and chronic kidney disease[J].Postgrad Med,2012,124(4):138-144.
[7] Hung C C,Lin H Y, Hwang D Y,et al.Diabetic retinopathy and clinical parameters favoring the presence of diabetic nephropathycould predict renal outcome in ratients with diabetic kidney disease[J].Sci Rep,2017,7(1):1236-1241.
[8] Axelgaard E,Østergaard J A,Thiel S,et al.Diabetes is associated with increased autoreactivity of mannan-binding lectin[J].J Diabetes Res,2017,2017(2):1-13.
[9] Kagal U A,Angadi N B,Matule S M,et al.Effect of dipeptidyl peptidase 4 inhibitors on acute and subacute models of inflammation in male Wistar rats: An experimental study[J].Int J Appl Basic Med Res,2017,7(1):26-31.
[10]Arnold P,Boll I,Rothaug M,et al.Meprin ometalloproteases generate biologically active soluble interleukin-6 receptor to induce trans-signaling[J].Sci Rep,2017,7(3):1-11.
[11] Ugrinova I,Pasheva E.HMGB1 Protein: A therapeutic target inside and outside the cell[J].Adv Protein Chem Struct Biol,2017,107:37-76.
