基因编辑扫除异种器官移植障碍
2018-03-28柯普哲
柯普哲
当人体的某种器官遭受严重病变,器官移植往往是唯一延续生命的方法。但是器官的合法来源只能依靠志愿者捐献,全世界大约只有不到10%的患者能等到合适的器官,而大多数患者只能在排队等待器官的过程中绝望而逝。几十年前就有人提出,既然人体器官如此稀缺,能否用动物的器官代替?别说,还真有科学家打起了猪器官的主意,不过要将猪器官成功移植到人体内,并让其长期存活,面临着重重障碍。要克服这些障碍,就需要基因编辑技术的帮忙。
猪器官异种移植的障碍
据美国器官募集和移植网络(OPTN)数据,截至2017年末,美国等待器官移植的患者接近12万,而器官捐献数量仅为1.6万例。10多年来,美国每年完成器官移植手术和器官捐献的数量基本维持在同一水平,但等待器官移植的患者数量却从15年前的不足8万,增加至目前的近12万。有研究预测,中国等待器官移植的患者多达150万人,而器官捐献数量不到2万例,器官移植供需矛盾更为突出。
早在100多年前,就有医生尝试将兔子、猪、山羊、绵羊和猴子等动物的器官移植到人体内,虽然这些实验均告失败,但是这种异种器官移植的努力一直没有停止。最近几十年,有科学家发现,猪的器官大小、生理结构等与人类非常相似,而且猪容易飼养、繁殖周期短、病原体容易控制,因此将猪视为异种器官移植的理想供体。
异种器官移植路线图
但是猪的器官移植到人体内,同样遭遇失败。原来人体与其他动物一样,在漫长的进化过程中,形成了一套识别和清除外来组织器官的保护机制,即免疫排斥。一旦有外来组织器官进入,人体就会启动免疫排斥反应,识别出外来的细胞、组织或器官,并启动清除程序,严重时,几分钟或数小时内就会因超急性排斥反应,让外来组织器官失活坏死,这是异种器官移植面临的最主要障碍之一。即使没有被超急性排斥反应所破坏,异种器官还将面临急性血管性排斥反应、细胞排斥反应等的多重考验,将相继出现血栓血塞、血管内皮细胞坏死等,导致被植入的异种器官难逃被扫地出门的命运,因此免疫排斥反应是异种器官移植的最大障碍。
除此之外,猪体内存在很多内源性逆转录病毒基因,这些病毒基因可能是远古逆转录病毒感染了猪的祖先后,残留在猪祖先基因组内,变成猪基因组中可稳定遗传的一部分。虽然目前没有临床证据表明,这些病毒基因能够复活,甚至感染人类,但还是有人担心存在这种可能。20年前,英国伦敦大学癌症研究学院的卡莱文·帕特恩等人发现猪肾脏细胞的内源性逆转录病毒基因可在体外感染共同培养的人类细胞。随后,德国慕尼黑大学的研究人员也发现猪的内源性逆转录病毒基因同样可感染狒狒的细胞,因此,猪内源性逆转录病毒被认为是猪异种器官移植临床试验的主要安全风险。
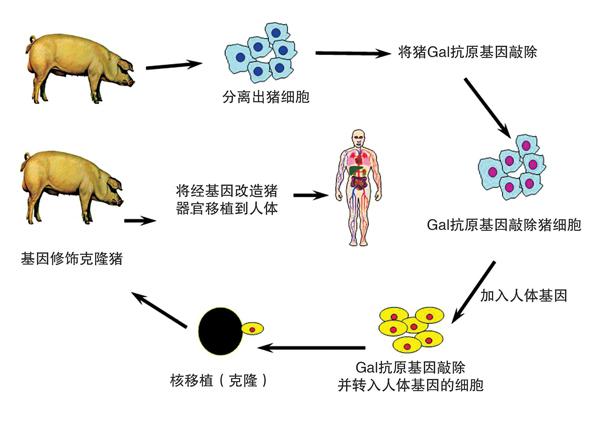
将猪器官伪装起来
据研究发现,要消除人体的免疫排斥反应,不能对人体组织细胞动手脚,只能将猪器官“伪装”成人类的器官,让人体免疫系统误以为是人体自身的器官,以期“蒙混过关”。
猪器官异种移植进展
如何伪装呢?科学家研究发现,除了人类和其他灵长类动物之外,绝大多数哺乳动物的细胞表面都存在一种由α-1,3-半乳糖苷转移酶催化产生的抗原成分,灵长类动物体内天然存在的抗体能特异识别这种抗原,这是引起超急性免疫排斥反应的主要原因。首先,如果利用基因编辑技术,将调控该酶表达的基因破坏掉,猪细胞表面则不会形成这种特异抗原成分;其次,通过转基因技术,让猪的器官上皮细胞表达一些人类的补体调节蛋白,也就是在猪细胞表面添加一些人体细胞的标志,人类和其他灵长类动物则会误认为是同类的器官,也可以避免或减轻超急性排斥反应。
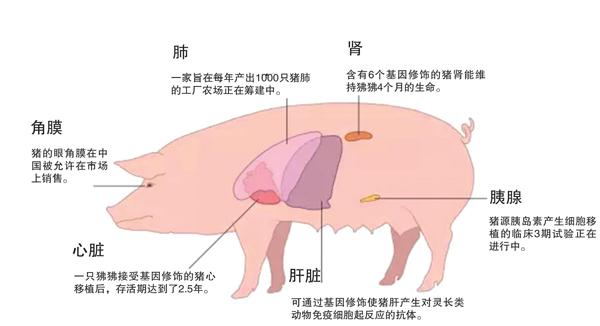
由于基因编辑技术尚不成熟,最早用于异种移植研究的猪器官都是来自携带人源补体调节蛋白基因的转基因猪,包括人衰变加速因子(CD55)转基因猪、膜辅蛋白(CD46)转基因猪和膜反应性溶破抑制因子(CD59)转基因猪等。2000年,英国研究人员将携带有人类基因CD55的转基因猪的肾脏移植到食蟹猴体内,移植物存活时间最长可达到139天。2005年,美国科学家将携带人类基因CD46的转基因猪的心脏移植到狒狒体内,结果移植物的最长存活时间可以达到109 天。这些研究表明,携带人源补体调节蛋白基因的转基因猪器官可以有效克服超急性排斥反应,也具有移植到人体的潜力。
自2001年之后,德国、美国等国的科学家相继培育出了α-1,3-半乳糖苷转移酶基因敲除和转入人体蛋白的转基因猪,并将α-1,3-半乳糖苷转移酶基因敲除猪的肾脏和心脏分别移植到经免疫抑制处理的狒狒体内,最长成活时间分别达到83天和179天。美国国立卫生研究院心胸外科研究项目团队更是将多种人体标志基因转入猪基因组中,同时将猪的α-1,3-半乳糖苷转移酶基因敲除掉,获得基因修饰猪,然后将这种基因修饰猪的心脏移植到狒狒体内,狒狒的平均存活时间近300天,最长可存活900天以上,这表明这种经过基因改造的猪器官能有效克服超急性排斥反应。
不过,目前基因改造猪的器官在灵长类动物体内的存活时间还不够长,所引发的人体免疫排斥反应也比较严重,还需要进一步利用新一代基因编辑技术,开发新的基因改造猪,最大限度减轻免疫排斥反应,以延长猪器官在人体中的存活时间。
全歼远古病毒
尽管猪和其他哺乳动物基因组中均潜伏有远古病毒的残余——内源性逆转录病毒基因,但是有些科学家担心,当猪的器官植入人体后,由于长期共存,猪基因组的内源性逆转录病毒有可能“跳跃”到人体细胞,从而引发不可预知的疾病,因此利用基因编辑技术对这些猪基因组中的内源性逆转录病毒基因一网打尽,是消除异种器官移植安全风险的最好方式。

PERV基因編辑猪
2015年10月,美国哈佛大学遗传学家乔治·丘奇教授团队在国际顶级学术期刊《科学》上首次报道了利用CRISPR/Cas9技术,一次性敲除猪基因组中内源性逆转录病毒编码逆转录酶基因的全部62个拷贝,并证明失活的猪内源性逆转录病毒,对人类细胞的感染能力大幅下降。
2017年9月,乔治·丘奇教授团队再次在《科学》杂志上发表论文,宣布培育出内源逆转录病毒失活的基因敲除猪。乔治·丘奇教授团队对猪基因组进行进一步分析后,发现猪内源性逆转录病毒基因具有功能性的拷贝共有25个,即这25个拷贝中编码逆转录酶的基因较为完整,具有潜在感染能力。只要将这些逆转录酶基因所有拷贝敲除,即可使所有内源性逆转录病毒丧失移动能力而失活。
CRISPR/Cas9系统包括一个负责寻找并结合目的基因序列的向导RNA,即Word软件中的“查找”工具,核酸内切酶Cas9则负责将目的基因序列剪掉,相当于Word软件中的“剪切”工具。该团队研究人员针对25个逆转录酶基因拷贝的核心区域,设计了CRISPR/Cas9系统中的特异性向导RNA,让这些向导RNA与猪胎儿成纤维细胞长时间待在一起,这些向导RNA会逐渐在猪的全基因组中寻找并结合到逆转录酶基因核心区域。随后,与向导RNA相连的核酸内切酶Cas9就会剪除这一区域,这样就获得了25个逆转录酶基因拷贝均被编辑的猪胎儿成纤维细胞。接下来,研究人员将这些基因编辑细胞进行核移植操作,即将这些基因编辑细胞核取出,与去核的卵母细胞融合成克隆胚胎,接着将克隆胚胎移植到代孕的母猪体内进行发育,共出生37个基因编辑克隆猪,其中15头健康存活。目前,研究人员已从基因编辑克隆猪体内分离出细胞,正在进行长期观察,以验证这些基因编辑克隆猪体内失活的内源性逆转录病毒是否还具有感染能力。
一旦确认这些来自内源性逆转录病毒失活基因编辑猪的器官不再具有感染能力,猪异种器官移植的安全风险将基本消除。下一步则需要重点攻克移植免疫排斥反应,扫除这一异种器官移植最后的障碍,异种器官移植时代便指日可待。
