基因编辑技术改写“生命天书”
2018-03-28汤波
汤波
基因编辑是最近十几年发展起来的一种新兴生物技术。优秀的园丁用一把轻便锋利的剪刀,可以修剪出一株株美丽绝伦的花束;科学家用基因编辑工具,可以对任何生物的任何基因进行任意的剪切和修饰,因此基因编辑工具也被人们形象地称为“基因魔剪”。而基因编辑最令人期待的是在治疗艾滋病、遗传病和癌症等恶性疾病方面的巨大应用前景。
细菌的看家本领
研究发现,由于基因突变引起的人类遗传病多达7000种以上,全世界遗传病患者多达3.5亿人。有些人携带突变的基因并不表现出病征,但他们的后代则可能要承受严重病痛的折磨,甚至失去生命,给后代和家庭带来难以治愈的伤痛。
科学家们一直在寻找能解决这一痛苦的终极武器,希望将致病的突变基因“拨乱反正”;要么对携带者或患者本人的致病突變基因进行修正,解除患者的痛苦;要么对父母性细胞的突变基因进行修正,以防止他们的子女遗传其致病基因,从而根除那些致命的遗传病。
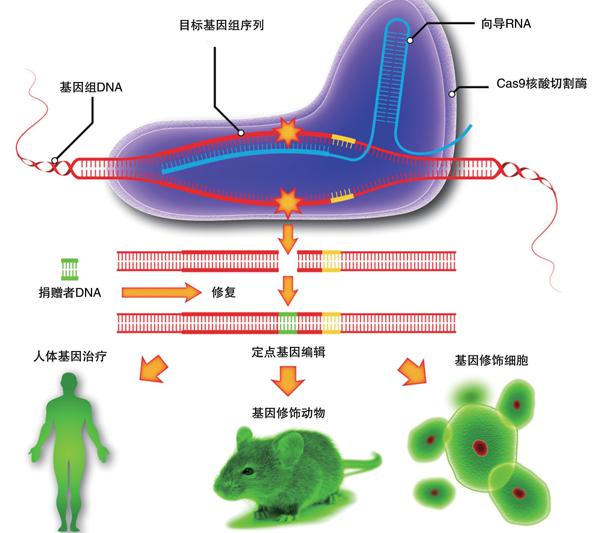
基因编辑技术示意图
几十年来,科学家苦苦寻觅,无奈收效甚微。直到近十几年,科学家从细菌身上找到了一些“基因编辑”工具,让这个根治人类遗传病的美好愿景有望变为现实。基因编辑技术其实是存在于细菌和古菌体内的一种防御系统。病毒在感染细菌和其他生命体之后,会将病毒的遗传物质整合到宿主的基因组中,借助宿主的基因复制过程来繁衍自己的后代,这下可把宿主给害惨了,被病毒感染的宿主轻则大病一场,重则丢了小命。几十亿年来,病毒一直干着这种损人利己的事儿,踏着其他生物的尸体,壮大了自己的队伍。为了对付病毒的侵袭,细菌和古细菌进化出一种能对入侵病毒DNA进行精准删除或改写的本领,而这种本领正是基因编辑。
今天,基因编辑技术看起来似乎“无所不能”,其实它也是一步步不断发展完善起来的。
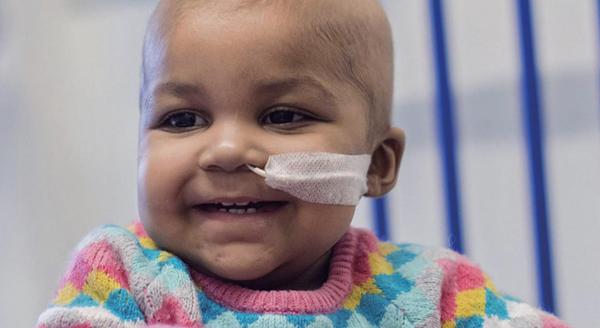
接受基因编辑治疗的1岁白血病女婴菜拉
20世纪90年代,一种名为锌指核酸酶(ZFN)的技术诞生了。锌指核酸酶包括锌指蛋白和核酸内切酶两个组成部分,前者负责识别基因组DNA中特异序列,相当于word软件中的“查找”工具,可以定位到某个特定词语,后者则负责将DNA切断,利用细胞自身DNA损伤修复功能,实现对目的基因的修饰,相当于word软件中的“剪切”工具,能轻松剪切掉这个特定词语。由于ZFN技术能像Word软件编辑文字一样对目的基因进行修改,较之前的同源重组技术大幅提高了基因敲除的效率,从而被称为“第一代基因编辑技术”。随后十多年里,它一直都在生物学界独领风骚。
不过,ZFN技术并不能对基因组中任何位点进行修改,脱靶效应较高,也就是说存在较多的非特异编辑,不仅构建成本高,而且费时费力。到2009年,科学家们又开发出另一种与其类似的基因编辑技术体系,即类转录激活样效应因子核酸酶(TALEN)技术,这是第二代基因编辑技术。该技术只是将识别DNA序列的元件改为TALE 蛋白,虽然TALEN构建起来确实比ZFN容易得多,不过同样也存在较高的脱靶效应。
2012年,美国加州大学伯克利分校的科学家开发出一种全新的基因编辑技术,即2015年被美国《科学》杂志评为十大年度科学突破之首的CRISPR/Cas9技术,这就是第三代基因编辑技术。不同的是,前两种基因编辑技术的“查找”工具是酶类,设计和制作成本较高,而CRISPR/Cas9技术是用一种成簇的、规律间隔的短回文重复序列的RNA来寻找靶向序列。由于设计和制作RNA比蛋白质简单,不仅构建成本得到大幅降低,而且可以精确到单个碱基,脱靶效应也得到了极大的改善。这项技术迅速走红起来,基因编辑技术也像“风暴”一样席卷整个生命科学领域。在短短两三年时间内,几乎所有常见的微生物、植物和动物,甚至是人类细胞和胚胎,都可用这项技术加以遗传改造,展现出各种令人惊喜的前景。其中,基因编辑技术最重要的应用领域是基因治疗。
改造免疫细胞
现今的基因编辑疗法主要有三种,第一种是利用基因编辑技术,将患者自身的免疫细胞、造血干细胞或其他细胞取出并加以修复,然后输回到患者体内,让修复的细胞来治疗艾滋病、白血病、癌症等恶性疾病,疗效显著。

基因编辑免疫治疗示意图
据2014年3月的《新英格兰医学杂志》披露,来自美国宾夕法尼亚大学和美国Sangamo生物技术公司的研究人员进行过一种实验,他们利用锌指酶(ZFN)技术对艾滋病患者CD4-T细胞中的CCR5基因进行编辑,并将这些基因编辑CD4-T细胞注射到12名艾滋病患者体内。
为什么要对免疫T细胞的CCR5基因进行编辑呢?据美国《科学》杂志报道,一个携带艾滋病病毒十多年、后来患有白血病的德国男子蒂莫西·雷·布朗,在为治疗白血病接受捐献者的骨髓干细胞移植之后,体内的艾滋病病毒竟然奇迹般消失了。从2006年到现在,布朗体内几乎检测不到艾滋病病毒的遗传物质,这些病毒更未被复制。之后,医生们给布朗停用了抗艾滋病药物,并宣布布朗成为世界上第一个艾滋病彻底治愈者。后科学家研究发现,在布朗所接受捐献的骨髓干细胞中含有突变的CCR5蛋白,它能有效阻止艾滋病病毒的入侵,这是布朗能战胜艾滋病病毒的最主要原因之一。之后,科学家们根据这一原理,利用基因编辑技术对免疫系统中T细胞或造血干细胞的CCR5基因进行突变,期望建立一套像布朗一样、可复制的艾滋病治愈方法。
被注射基因编辑CD4-T细胞一周后,患者血液中正常CD4-T细胞会大幅增加,多数患者的HIV DNA水平显著下降,其中有一名患者血液中已检测不到HIV RNA。随着这一实验的成功,美国Sangamo生物技术公司已启动了对另外70位艾滋病患者的类似临床试验,有望开辟一条治愈艾滋病的新途径。
2015年11月5日,英国《自然》杂志报道了一个基因编辑技术治疗白血病女婴的案例。这个一岁的女婴名叫莱拉,被诊断患有白血病,之前接受多次常规治疗均告失败。在无计可施之际,莱拉的父母同意伦敦大奥蒙德街医院的医生采用基因编辑新疗法放手一搏。医生们将事先经TALEN编辑的健康捐献者T细胞注射到莱拉血液中,很快莱拉的病情出现好转。之后,莱拉的主治医生还计划对另外10~12个白血病患者采取相同的治疗方法。
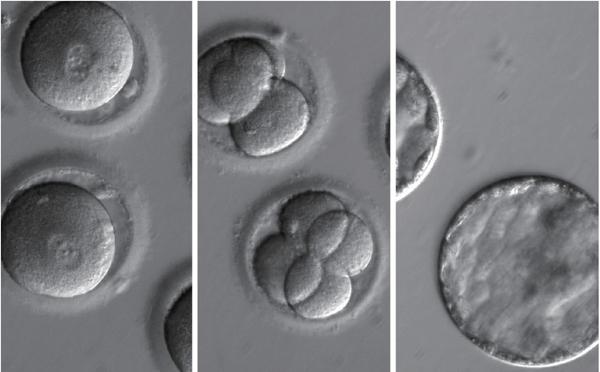
基因编辑胚胎
2016年11月,四川大学华西医院肿瘤科主任卢铀团队在国际上率先开展了一例基因编辑技术治疗转移性非小细胞肺癌的临床试验,以期建立肺癌治疗新方法。另据2018年1月23日报道,杭州市肿瘤医院吴式琇团队已对86名癌症患者实施了CRISPR/Cas9基因编辑免疫治疗,也就是用基因编辑技术改造患者自身的免疫细胞,然后将其输回患者体内,用来对付癌症细胞。接受治疗的人中,有些患者的症状得到显著改善。
剪除遗传病
第二种基因编辑疗法是利用基因编辑技术,先将具有遗传缺陷的生殖细胞或胚胎修正,再将这些修正后的胚胎移植到母亲的子宫中,出生的婴儿将不再遗传父母所患的遗传病。
2015年4月,我国中山大学黄军研究团队首次在学术期刊《蛋白质与细胞》上公布了对人类胚胎进行CRISPR/Cas9基因编辑的消息。不过,研究人员采用的是医院丢弃的问题胚胎,并不能成功孕育出婴儿。该研究的主要目的是对导致β型地中海贫血的突变基因进行基因编辑,以研究治疗或根除β型地中海贫血的可能性。
2016年4月,广东医科大学附属第三医院范勇博士领导的团队公开了第二例基因编辑人类胚胎的研究进展。据他们发表在《辅助生殖与遗传学期刊》的论文内容显示,从2014年4月至9月,研究人员从87名志愿者那里收集了213枚三原核受精卵。三原核受精卵属于人工授精技术中不能正常发育成胎儿的问题胚胎,因此常被用于人类生殖的基础研究。研究人员采用CRISPR/Cas9工具,对这些三原核受精卵中的基因CCR5進行编辑,共获得4个对HIV病毒抵抗力显著增强的突变型胚胎,并在3天时间内对这些胚胎进行了销毁。这项研究同样引起了国际顶级学术期刊《自然》、《科学》以及众多媒体的广泛关注。
2017年8月2日,英国《自然》杂志发表了一篇关于人体胚胎基因编辑的论文,研究人员采用正常人的卵子和携带一种与遗传性心脏疾病“肥厚型心肌病”有关的基因变异的精子体外受精,产生受精卵,在早期胚胎发育阶段利用CRISPR/Cas9基因编辑技术,成功修正了该基因突变。在此项研究中,约有70%的胚胎突变基因得到修正,研究人员计划进一步改进相关技术,使基因编辑的效率提高到90%以上,甚至接近100%,届时将推进这一研究进入临床试验。研究人员声称,这是人类首次对人类胚胎进行安全、准确和有效的基因编辑。
目前,基因编辑技术还在A型和B型血友病、利伯氏先天性黑内障、杜兴氏肌肉营养不良症、β型地中海贫血症、囊性纤维化病和α1-抗胰蛋白酶缺乏症等遗传病治疗方面展现出巨大的应用前景。
当然,对人类胚胎等生殖细胞进行基因编辑还是存在巨大争议,以生殖为目的的基因编辑仍然是绝对的研究禁区。2017年8月3日,美国人类遗传学协会、英国遗传学护士与咨询师协会、加拿大遗传咨询协会、国际遗传流行病协会和亚洲遗传咨询师职业协会等11个机构,在《美国人类遗传学杂志》上联合发布了一项政策声明,呼吁“谨慎而积极”地开展生殖细胞基因编辑,认为应继续推进基础研究,但反对把这项技术用于生殖目的。
修复活体基因
上述基因编辑疗法主要是在胚胎早期对基因进行修正,但是对于那些已经出生或长大成人的遗传病患者就爱莫能助了。幸好,科学家很快开发出了第三种基因编辑疗法,这种疗法将对遗传病患者的突变基因进行直接修复。
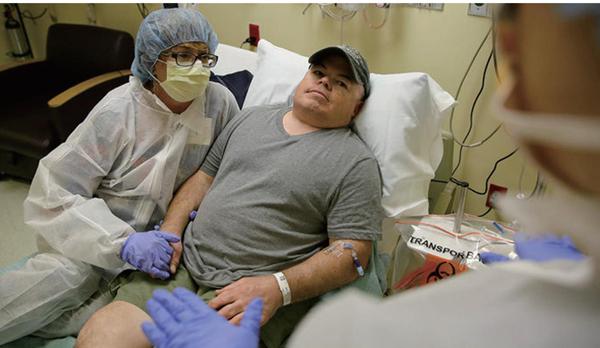
接受基因编辑活体治疗的第一人
2017年11月,美国男子布莱恩·马德成为第一个接受这种活体基因编辑治疗的患者。马德患有一种名为亨特氏综合征的罕见遗传病,该病的发病率为10~17万分之一,主要为男性患者。
每位亨特氏综合征患者细胞内都含有IDS基因致病突变,该基因原本负责合成一种可分解有毒碳水化合物的酶,一旦发生突变,则不能产生足够有活性的酶,那么有毒物质就会在肝脏等器官堆积,进而引发器官衰竭,患者一般都活不过20岁。
科学家向马德体内注射一种含有腺相关病毒(AAV)、锌指核酸酶(ZFN)和正常IDS基因的药物。腺相关病毒负责将锌指酶和正常IDS基因准确递送到马德的肝脏细胞,到达肝脏细胞之后,锌指酶则负责将马德肝脏细胞IDS基因已突变的部分剪掉,换上正常的IDS基因。
科学家希望这种疗法最终能修复马德的肝脏细胞,让其产生正常的酶类,从而分解有毒物质。据科学家介绍,并不需要所有肝细胞都被修复,只需要1%的肝细胞被成功修复,马德的亨特氏综合征就将得到有效治疗。
这些基因编辑技术的临床治疗是否能创造奇迹,且让我们拭目以待。不过,一旦获得突破,基因编辑将为那些饱受遗传病、艾滋病、癌症折磨的患者带来新生的希望,也必将引领人类健康革命。
