乙型肝炎病毒相关性肝癌组织维生素D受体表达情况分析
2018-03-28李玉苓郭文征张卫民孙韬赵彩彦
李玉苓,郭文征,张卫民,孙韬,赵彩彦
肝细胞癌(hepatocellular carcinoma,HCC)是目前世界上第五大常见肿瘤,位列癌症死亡原因的第2位,每年约有一百万人死于HCC[1]。另外,HCC具有发病隐匿、生物恶性程度高、生存期短及对放、化疗均不敏感等特点,预后差,目前临床治疗不乐观。近年来,维生素D( vitamin D,VD)的抗肿瘤作用日益受到重视[2]。研究发现,维生素D可发挥抑制细胞增殖、诱导细胞调亡和分化等抗肿瘤作用[3]。维生素D生物学效应主要由细胞内特异性的维生素D受体(vitamin D receptor,VDR)介导。本研究通过检测HCC患者肝癌组织及其癌旁组织VDR mRNA水平及其VDR蛋白表达,并与正常肝脏组织比较,以探讨维生素D在HCC发生发展中的作用。
1 资料与方法
1.1 一般资料 2013年3月~2014年11月就诊于河北医科大学第三医院接受肝移植的HCC患者10例(均有乙型肝炎肝硬化基础),男7例,女3例;年龄28~72岁,平均年龄(44.3±11.2)岁。诊断符合2011年版《原发性肝癌诊治规范》的诊断标准,分别取HCC患者癌组织及其癌旁组织。所有HCC患者血清HBsAg阳性。排除标准:(1)合并甲型、丙型、丁型、戊型肝炎病毒、EBV、CMV、HIV 感染;(2)伴有酒精性肝病、自身免疫性疾病、药物性肝损伤、心血管疾病;(3)妊娠;(4)其它系统严重疾病患者。另外选取同期肝移植供体4例,男3例,女1例;年龄20~56岁,平均年龄(31.5±11.7)岁,分别取其正常肝组织。
1.2 肝组织VDR检测 采用Power Vision TM二步免疫组化法检测肝脏组织VDR表达。主要步骤如下:(1)脱蜡;(2)抗原修复;(3)在切片上加 3%H2O2,于37℃温育箱中孵育15 min,以封闭非特异性抗原,PBS缓冲液洗5 min×2次;(4)滴加兔抗人VDR多克隆抗体,置于冰箱中4℃过夜,室温下复温30 min,加0.01 M PBS缓冲液洗5 min×2次;(5)滴加山羊抗兔IgG,置于37℃孵育40 min,加0.01 M PBS 缓冲液洗 5 min×2次;(6)加 3,3'- 二氨基联苯胺(3,3’-Diaminobenzidine,DAB)显色,时间约1 min;(7)自来水冲洗,终止显色,加苏木素复染,时间约为2 min,在分化液中浸泡30 s,再在返蓝液中浸泡30 s,常规梯度酒精脱水、二甲苯透明、中性树胶封片,晾干后在显微镜下观察结果,细胞被染成棕黄色为阳性细胞。
1.3 肝组织VDR mRNA水平检测 采用实时荧光定量PCR法(美国Invitrogen公司Trizol试剂),提取肝组织总RNA,逆转录合成cDNA,在Taq DNA聚合酶作用下合成PCR产物。以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)作为内参照基因。GAPDH 上游引物:5’-AACAGCCTCAAGATCAGCAA-3’, 下 游 引 物 :5’-GACTGTGGTCATGAGTCCTTCCA-3’,扩增片段长度 149 bp;VDR 上游引物:5’-ACCAGAAGCCTTT GGGTCTG-3’,下游引物:5’-CGTTCCGGTCAAAG TCTCCA-3’,扩增片段长度110 bp。PCR反应参数:95℃预变性2 min,进入扩增循环,95℃变性15 s,57℃退火 30 s,72℃延伸 30 s,共 40 个循环。根据待测基因与管家基因的Ct值,用 RQ 值(2-ΔΔCt)表示待测基因的相对水平[3]。
1.4 肝组织VDR蛋白表达检测 采用Western blot法,兔抗人VDR多克隆抗体购于艾菲生物技术有限公司(Catalog:AF6159),抗 GAPDH 抗体购于美国Bioworld公司。提取肝组织蛋白,电泳、转膜、封闭后,先后加一抗、二抗,行化学发光反应、曝光、显影,扫描图片。应用Image J软件测定各条带灰度值,以计算VDR蛋白与GAPDH灰度比值作为VDR蛋白的相对表达量。
1.5 统计学处理 应用SPSS 13.0统计软件对数据进行分析。计量资料以(±s)表示,先进行方差齐性检验。对正态分布资料,采用单因素方差分析,组间比较采用 Student-Newman-Keuls法检验,对非正态分布资料,采用Kruskal-Wallis H秩和检验,组间比较采用Mann-Whitney U检验。采用Pearson直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 肝组织VDR蛋白表达情况 VDR在所有HCC患者的癌组织及正常肝脏组织均表达,主要在细胞质表达,细胞核中基本无表达(图1和图2)。

图1 正常肝组织VDR表达情况(Power Vision TM,200×)
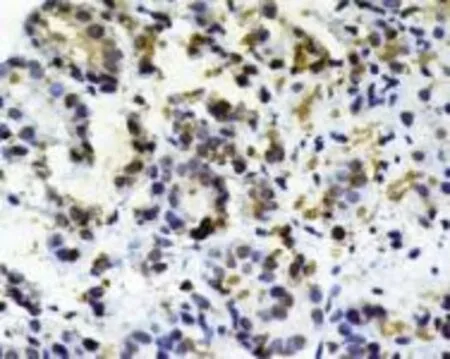
图2 肝癌组织VDR表达情况 (Power Vision TM,400×)
2.2 肝组织VDR mRNA及其蛋白水平比较 10例癌组织VDR mRNA水平为(2.77±0.30),显著高于癌旁肝硬化组织(1.62±0.21)或正常肝组织(1.57±0.19),差异具有统计学意义(P<0.01,图 3);Western blot检测结果显示,HCC组织VDR蛋白表达水平(1.15±0.57)显著高于癌旁肝硬化组织(1.02±0.25)或正常肝脏组织(0.37±0.11),差异具有统计学意义(P<0.01,图 4)。
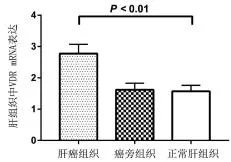
图3 各组肝组织VDR mRNA水平比较
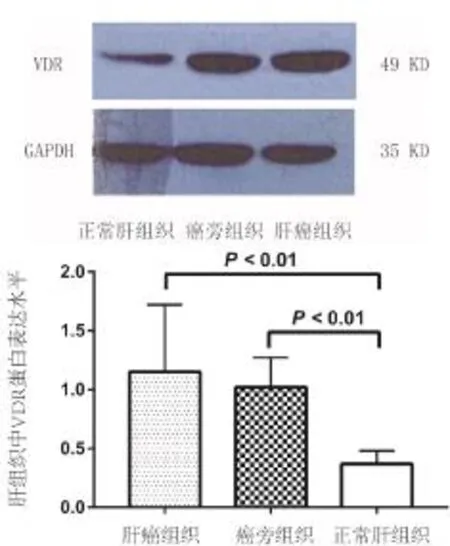
图4 各组肝组织VDR蛋白表达水平比较
3 讨论
VDR是类固醇激素/甲状腺激素受体超家族成员,分为膜受体(menbrance vitamin D receptor,mVDR)和核受体(nuclear vitamin D receptor,nVDR)两类。膜受体主要负责维持钙磷平衡,而核受体本质是一种配体依赖的核转录因子,通过与活性维生素D3结合形成激素-受体复合物,该复合物与相应目的基因启动子区域的作用元件结合,从而启动或抑制该基因的转录活性,调节结构基因的表达,影响组织细胞增殖分化及其相应的生物学功能,这是维生素D发挥作用的基因途径。维生素D生物学作用还有非基因途径,主要表现有以下几方面:促使胰岛B细胞分泌胰岛素,调节肠道上皮细胞对钙离子的吸收,调节成骨细胞中电压门控的钙离子和氯离子通道的开放以及内皮细胞的迁移等。
肿瘤形成是一个复杂的多因素作用的过程,主要由环境因素和基因特性决定[4]。维生素D抗肿瘤已证实的机制主要有以下几方面:(1)调控细胞周期:肿瘤是一类细胞周期疾病,细胞周期的失控是影响细胞恶变的重要因素,维生素D可以将肿瘤细胞阻滞在G0/G1期,导致S期细胞数目下降,致使G0~G1期细胞堆积,而G2~M期的细胞数目相对无变化[5],从而抑制肿瘤细胞增殖;(2)诱导细胞凋亡:细胞调亡是调节细胞正常生长和分裂的重要过程,与细胞周期密切相关。研究发现人类脂肪酸辅酶A连接酶(fatty acid coaligase,FACL)属于脂酸代谢酶家族,FACL可促进花生四烯酸等长链脂酸形成脂酸辅酶A,而花生四烯酸辅酶A可通过激活Caspase-3通路诱导细胞凋亡,并且由于花生四烯酸的堆积,会抑制这种促凋亡作用,以至于停止,因此过度表达的FACL可以降低细胞内花生四烯酸水平,从而阻止促凋亡作用[6];(3)影响生长因子和激素:1,25(OH)2D3及其类似物与VDR结合,形成激素-受体复合物,该复合物作用于靶基因,上调类胰岛素生长因子结合蛋白(insulin-like growth factor binding proteins,IGFBPs)表达,从而降低了类胰岛素生长因子(insulin-like growth factor IGF)活性,阻断IGF促进细胞分裂的作用[7],达到抗肿瘤目的;(4)抑制端粒酶的活性:1,25(OH)2D3 可以明显降低端粒酶的活性,影响肿瘤细胞周期[8],进而对肿瘤细胞增殖产生抑制作用。另外,端粒酶活性的降低能进一步协同1,25(OH)2D3对HCC细胞发挥促凋亡作用;(5)非基因途径:核转录因子p65可以调控细胞内信号转导,而基质金属蛋白酶是作用于肿瘤侵袭转移过程的蛋白水解酶。盛茂林等[9]发现维生素D类似物EB1089发挥抗肿瘤作用是通过非基因途径的雌激素受体α(estrogen receptor,ERα)介导,主要表现为下调核转录因子p65(nuclear transcription factor p65,NF-κB p65)和基质金属蛋白酶 -9(matrix metalloproteinases-9,MMP-9)表达,从而影响细胞内信号转导,抑制肿瘤细胞增殖,促进其凋亡,并且抑制其侵袭转移。另外,DNA损伤及抗氧化酶活性降低可以导致肿瘤的发生,维生素D可以通过阻止DNA损伤、恢复抗氧化酶活性来抑制肿瘤的产生[10]。自吞噬是调控细胞内容物降解和再循环的过程,可以抑制细胞生长。维生素D还可以诱导肿瘤细胞的自吞噬[11],而自吞噬基因编码的蛋白Beclin-1又能增强维生素D诱导的自吞噬作用[12],从而抑制肿瘤细胞生长。
维生素D抗肿瘤作用的发挥主要是通过与细胞核内的VDR结合实现。多项研究表明维生素D对许多组织细胞VDR蛋白有上调作用,但是在VDR mRNA水平的调节却比较复杂,既可以表现为向上调节,也可以无调节作用,对于部分细胞甚至可以产生下调作用,具有明显的组织细胞特异性[13]。VDR属于类固醇激素/甲状腺激素受体超家族成员,广泛分布于机体各组织细胞中,比如癌变的乳腺、垂体、甲状旁腺等部位[14]。不同癌组织VDR表达是有差异的,但目前对肿瘤组织VDR表达水平的意见还未达成一致。关于VDR在癌组织中表达的研究主要集中在乳腺癌和结肠癌。Ditsch et al[15]研究纳入82例乳腺癌患者,分析发现VDR高表达患者与VDR低表达者比,具有更长的整体生存期和无恶化生存期。然而,Eisman[16]研究报道乳腺癌组织VDR表达与正常乳腺组织无明显差异,并且发现约80%乳腺癌组织细胞核中都有VDR表达。检测结肠癌组织VDR时发现,癌组织VDR阳性率为32%,正常粘膜组织为89%[17]。VDR在正常粘膜组织的表达明显高于癌组织,并且VDR均表达于细胞核内。最近的研究发现VDR除存在于细胞核内,在某些细胞还存在于细胞质及细胞膜中[18]。也有研究者先后在多种肝癌细胞系中发现VDR表达[19],提示肝癌细胞可能是维生素D和VDR作用的靶细胞,VDR基因可能是肝癌的易感基因。研究发现与正常肝脏组织比,HCC组织VDR表达增强[20]。在本研究中,我们对HCC组织、癌旁组织和正常肝组织VDR的表达进行了研究,发现它们均有VDR表达,主要定位于细胞质,而细胞核内无表达,提示维生素D可以不通过nVDR影响HCC的发生发展,表明维生素D对HCC可能存在非基因途径,有待进一步研究证实。通过实时荧光定量 PCR检测显示,癌组织VDR mRNA水平明显高于癌旁组织或正常肝脏组织,HCC组织VDR蛋白表达也强于癌旁组织或正常肝脏组织。根据HCC组织、癌旁组织和正常肝组织VDR mRNA及其VDR蛋白表达的差异,推测VDR与HCC的发生、发展存在密切联系。然而,VDR升高是发生在肿瘤之前,还是肿瘤发生后导致VDR的升高,还需要进一步研究。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012.Int J Cancer,2015,136(5):359-386.
[2]曹雨娜,张虹.维生素D抗肿瘤作用的研究进展.中国临床药学杂志,2014,23(2):129-132.
[3]次仁旺拉,琼卓玛,仓决,等.维生素D的生理功能研究进展.西藏医药,2016,37(3):80-82.
[4]Nahon P,Zucman-Rossi J.Single nucleotide polymorphisms and ris k ofhepatocellularcarcinoma in cirrhosis.J Hepatol,2012,57(3):663-674.
[5]Wang QM,Jones JB,Studzinski GP.Cyclin-dependent kinase inhibitor p27 as a mediator of the G1-S phase block induced by1,25-dihydroxyvitamin D3inHL60Cells.Cancer Res,1996,56(2):264-267.
[6]Evans J,Ko Y,Mata W,et al.Arachidonic acid induces brain endothelial cell apoptosis via p38-MAPK and intracellular calcium signaling.Microvasc Res,2014,2862(14):71-75.
[7]崔健,陈虹,黄秉仁,等.维生素D受体最新研究进展.生理科学进展,2011,42(2):95-99.
[8]Seol JQ,Kim ES,Park WH,et al.Telomerase activity in acute myelogenous leukemia:clinical and biological implications.Br J Haematol,1998,100(1):156-165.
[9]盛茂林,许戈良,荚卫东,等.维生素D类似物EBl089对肝癌细胞增殖凋亡侵袭的影响.安徽医科大学学报,2012,47(10):1174-1177.
[10]Anakar MC,Paramasivan SK,Chattopadhyay MB,et al.Alpha,25-dihydroxyvitamin D3 prevents DNA damage and restores antioxidant enzymes in rat hepatocarcinogenesis induced by diethylnitrosamine and promoted by phenobarbital.World J Gastroenterol,2004,10(9):1268-1275.
[11]Singletary K,Milner J.Diet,autophagy,and cancer:a review.Cancer Epidemiol Biomarkers Prev,2008,17(7):1596-1610.
[12]Zhang J,Zhang H,Zhang X,et al.Synergistic effect of retinoic acid and vitamin D analog EB1089-induced apoptosis of hepatocellular cancer cells.Cytotechnology,2013,65(3):457-465.
[13]So JY,Lee HJ,Smolarek AK,et al.A novel gemini vitamin D analog represses the expression of a stem cell marker CD44 in breast cancer.Mol Pharmacol,2011,79(3):360-367.
[14]Townsend K,Banwell CM,Guy M,et al.Autocrine metabolism of vitamin D in normal and malignant breast tissue.Clin Cancer Res,2005,11(9):3579-3586.
[15]Ditsch N,Toth B,Mayr D,et al.The association between vitamin D receptor expression and prolonged overall survival in breast cancer.J Histochem Cytochem,2012,60(2):121-129.
[16]Eisman JA,Suva LJ,Sher E,et al.Frequency of 1,25-dihydroxyvitamin D3 receptorin human breastcancer.CanverRes,1981,41(12):5121-5124.
[17]Shabahang M,Buras R,Davoodi F,et al.1,25-dihydroxyvitamin D3 receptor as a marker of human colon carcinoma cell line differentiation and growth inhibition.Cancer Res,1993,53(16):3712-3718.
[18]Norman AW.Minireview:vitamin D receptor:new assignments for an already busy receptor.Endocrinology,2006,147(12):5542-5548.
[19]Bruyere O,Cavalier E,Souberbielle JC,et al.Effects of vitamin D in theelderlypopulation:currentstatus and perspectives.Arch Public Health,2014,72(1):32.
[20]Deb S,Chin MY,Adomat H,et al.Ginsenoside-mediated blockade of 1α,25-dihydroxyvitamin D3 inactivation in human liver and intestine in vitro.J Steroid Biochem Mol Biol,2014,141:94-103.