鼻息肉组织树突状细胞亚群的初步研究及意义
2018-03-28庄夏衍王挥戈林歆胜李创伟
庄夏衍 王挥戈 林歆胜 李创伟
鼻息肉是耳鼻咽喉科常见的疾病之一,具有发病率较高(我国 2%~8%)[1,2],复发倾向强(术后复发率15%~40%)的特点[3]。流行病学数据显示:鼻息肉高发病率及高复发率,直接或间接增加经济负担,并严重影响患者的生活质量[4]。
大量的研究发现,鼻息肉是由各种免疫细胞及炎症细胞参与的持续慢性炎症反应的疾病[5]。鼻息肉组织中辅助性T细胞 (heleper T cell,Th)发生极化,存在Th1细胞和Th2细胞的绝对数量增多、Th1/Th2比例失衡和Th细胞因子分泌优势发生改变。但究竟什么因素促使Th细胞极化?哪种亚型及细胞因子占优势?目前仍存有分歧,无统一定论。
树突状细胞(Dendritic cell,DC)是目前已知体内功能最强、唯一能直接激活静息T细胞的抗原提呈细胞,在机体免疫系统中处于核心地位。人DCs根据其表型分为两个亚群:髓系DCs(mDCs)和淋巴系 DCs(pDCs)[6,7],也可以根据功能分成两个亚群,诱导 Th1的DCs亚群(DC1s)和诱导 Th2的 DCs亚群(DC2s)。在过去几十年,mDCs和pDCs被认为分别代表 DC1s和 DC2s[8,9]。CD11C和 CD123是区分人类DC1和 DC2的主要标志[10,11],它们在免疫应答中各自起着独特而又互补的作用[8,12]。研究认为,Th细胞的分化是由DC控制的,DC亚群能够推进CD4和CD8的应答,DC1与DC2分别诱导Th细胞分化为Th1和Th2,从而调节 Th1/Th2的偏向[13]。
已有研究证实鼻息肉组织中DC明显增多[14,15]。我们采用连续切片免疫组化方法,检测鼻息肉中CD11c和CD123的表达情况,探讨CD11c+DC(DC1)和CD123+DC(DC2)亚群在鼻息肉发病机理中的意义。
资料与方法
1 一般资料
鼻息肉组:接受鼻内镜手术的鼻息肉患者。共30例,男 16例,女 14例,年龄 18~66岁,平均(37±16)岁。如有以下情况即被排除出此研究:单侧病变、上颌窦后鼻孔息肉、纤毛不动综合征、鼻窦手术史、哮喘史、阿司匹林耐受不良史及全身严重疾病史。术前2周内无全身或局部使用糖皮质激素、免疫抑制剂及任何种类鼻喷剂。
下鼻甲黏膜组:接受鼻中隔矫正术的患者共30例,男 20例,女 10例,年龄 18~59岁,平均(30±12)岁。选择标准:术中正常下鼻甲组织,既往无变应性鼻炎、慢性鼻窦炎、鼻息肉及全身严重疾病史。
2 试剂及仪器
鼠抗人Integrin X(CD11c)、鼠抗人IL-3R(CD123)(Santa Cruz公司产品);DAB显色试剂盒(福州迈新生物技术开发有限公司);PV-6002二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)
3 实验方法
收取标本后修剪成1cm×1cm×1cm大小的组织块,用10%中性福尔马林液固定,石蜡包埋切片。鼻息肉组每张切片HE常规染色。以同一标本两张连续切片分别采用免疫组织化学二步法检测CD11c、CD123。
4 结果观察和判定
在光学显微镜下,观察HE染色后鼻息肉组织内炎性细胞浸润情况(图1,图2)。

图1 鼻息肉组织HE染色(标尺:100μm)

图2 鼻息肉组织HE染色(标尺:100μm)
选择乳腺癌转移淋巴结标本作为阳性对照,以PBS替代一抗作阴性对照。以背景清晰、胞浆染成淡黄色、棕黄色为阳性细胞。每张切片在低倍镜下随机选取DC分布最密集的10个区,更换至高倍镜(HPF×400),计数10个高倍视野内DC的总数代表该标本切片DC的浸润程度。
5 统计学处理
运用SPSS 18.0统计软件进行统计学分析。CD11c、CD123分别在实验组和对照组中表达的阳性率比较采用四格表卡方检验。数据进行正态性检验后,实验组CD11c+DC与CD123+DC的比较采用配对卡方检验和配对样本t检验。均以P<0.05为差异有统计学意义。
结果
1 HE染色光镜观察结果
以淋巴细胞、浆细胞浸润为主的标本达70%,以嗜酸性粒细胞浸润为主的标本仅占30%。
2 CD11c的表达情况
CD11c+DC胞膜有明显微状突起,胞体较大,胞浆呈淡黄色或棕黄色,核多偏位,在鼻息肉组织上皮下基底部和腺体周围分布较多,间质中有少量散在分布(图3)。在对照组中,仅有极少量CD11c+DC在上皮下基底部和腺体周围分布(图4),63.3%的标本甚至没有阳性细胞出现。
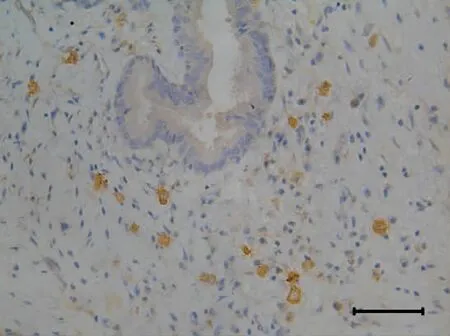
图3 CD11C+DC在鼻息肉组织中的分布(标尺:50μm)

图4 CD11C+DC在正常下鼻甲黏膜中的分布(标尺:50μm)
CD11c在鼻息肉组的表达与对照组比较,差异有高度统计学意义(a=0.05,P<0.01)(表 1)。

表1 CD11c在鼻息肉组织和正常下鼻甲黏膜中的表达情况的比较

图5 CD123+DC在鼻息肉组织中的分布(标尺:50μm)
CD123在鼻息肉组的表达与对照组比较,差异有高度统计意义(a=0.05,P<0.01)(表 2)。

表2 CD123在鼻息肉组织和正常下鼻甲黏膜中的表达情况
3 CD123的表达情况
CD123阳性细胞均具有DC2特殊细胞形态,呈卵圆形,体积较CD11c阳性细胞小,胞质呈棕黄色,核略偏位,在鼻息肉组织上皮下基底部和腺体周围分布较多,间质中有少量散在分布(图5),而在对照组中,仅有极少量分布在血管和腺体周围,有的甚至几乎没有表达(图6)。

图6 CD123+DC在下鼻甲黏膜中的分布(标尺:50μm)
4 CD11c与CD123鼻息肉组织中表达情况的比较
在鼻息肉组织中,CD11c与CD123的阳性表达情况相比较,差异无统计学意义(P>0.05)(表3)。高倍视野下,计数鼻息肉组CD11c+DC的平均数目为109.57/10HPF,CD123+DC计数平均为 89.74/10HPF。鼻息肉组织中CD11c+DC的细胞数明显高于CD123+DC,差异有统计学意义(P<0.05)(表 4)。

表3 鼻息肉中CD11c与CD123表达情况的比较

表4 鼻息肉组织中CD11c+DC与CD123+DC分布情况的比较
讨论
近年来,有研究发现我国鼻息肉的组织病理学特征与全球其他地区存在着显著差异,国内不同地区鼻息肉的免疫病理特征也存在差异。如北京和成都就有所不同,北京鼻息肉患者呈现Th2/Th1/Th17混合免疫模式,而成都的鼻息肉患者以Th2免疫反应为主的比例则非常低。Wang等[16]发现我国鼻息肉组织中以嗜酸性粒细胞浸润为主的仅占30%。Lou等[17]发现我国鼻息肉组织以淋巴细胞及浆细胞浸润为主。我们的实验结果显示,潮汕地区鼻息肉以淋巴细胞及浆细胞浸润为主,约占70%,与上述看法基本一致。这说明不同人种及不同地区间鼻息肉确实存在组织病理学上的差异,需要我们进一步认识这种差异的内在机制。
Th细胞是免疫应答中的核心淋巴细胞,当机体受抗原刺激时,Th0细胞在DC细胞和巨噬细胞的协助下激活,向Thl细胞或Th2细胞转化并分泌多种细胞因子。Th1细胞主要参与细胞免疫应答;Th2细胞主要促进体液免疫应答,其分泌的细胞因子可促使嗜酸性粒细胞的集聚和活化。Thl细胞和Th2细胞及其分泌的细胞因子在鼻息肉发病机理中的作用日益受到重视。大量的研究发现[18-21],鼻息肉组织中Th细胞发生极化,鼻息肉组织中Th1、Th2细胞均显著高于正常鼻黏膜,并存在Th1/Th2比例失衡,Th1细胞百分率明显高于Th2细胞,但是Th2型细胞因子的表达具有普遍优势。炎性细胞和细胞因子相互作用,发挥网络抗炎效应,使鼻黏膜的免疫反应性呈活化和扩大状态,但由于局部炎症反应持续存在,致使炎性细胞在发挥局部保护作用的同时又造成组织的损伤,加重局部的炎症反应,最终形成了鼻息肉。这提示我们,病因的多元性导致了免疫反应的复杂性,鼻息肉是一类由体液免疫和细胞免疫共同参与的多种免疫机制异常的疾病。但究竟什么因素促使Th细胞极化?什么决定了哪种亚型及细胞因子占优势?目前无统一定论。
树突状细胞(DC)是目前已知体内功能最强的、唯一能激活初始型T细胞的专职抗原提呈细胞,是机体免疫应答的始动者[22,23],是机体免疫系统中一类不可缺少的免疫细胞。DC能调节机体对抗原产生相应的免疫应答类型:细胞免疫或T细胞依赖的体液免疫(Th1/Th2型免疫反应)。Rissoan等[8]认为,DC亚群才是决定Th细胞向Th1细胞或Th2细胞分化的主要驱动力。DC1/DC2比值的变化直接影响Th1/Th2细胞的分化,DC1/DC2能通过细胞因子精细地调节Th1/Th2细胞的应答平衡,维持机体内环境的稳定。同时,DC亚群在诱导Th分化时存在负反馈调节机制,Th1/Th2细胞分别通过其分泌的细胞因子IFN-γ和IL-4作用于DC1/DC2,调控DC1/DC2的发育及比例,从而更精确地调节机体内Th1细胞和Th2细胞免疫功能的动态平衡,使机体免疫处于稳态。
我们既往的研究发现,在鼻息肉组织中DC可通过一系列的细胞和体液免疫机制导致Th1/Th2细胞比例失衡[15]。因此,我们认为鼻息肉组织中Th1/Th2比例失衡只是一个现象,DC及其亚群才很可能是Th1/Th2失衡而致免疫应答紊乱的动因,检测患者鼻息肉组织中DC亚群DC1和DC2有助于我们了解鼻息肉的初始免疫状态。本研究结果显示,CD11c和CD123在鼻息肉组的表达均高于对照组,在鼻息肉组,CD11c和CD123的表达无明显差异,但CD11c+DC与CD123+DC细胞数量的比较,差异有统计学意义。提示鼻息肉组织中存在DC1/DC2混合模式,DC1和DC2通过分别诱导Th1型与Th2型免疫应答,Th1/Th2型免疫应答并存,DC1/DC2比例失衡导致鼻息肉组织Th1/Th2细胞比例失衡。DC1在鼻息肉组织中占优势主导地位,在DC1的主导作用下Thl亚群介导的细胞免疫反应占优势地位。本研究发现鼻息肉炎症反应的终极结果,其组织病理学上以淋巴细胞及浆细胞浸润为主(约占70%),也从因果关系上印证了DC1在鼻息肉中占优势主导地位这一结论。这个新的认识进一步拓展和延伸了以往单纯关注细胞因子调节Th1/Th2细胞平衡的视野,将鼻息肉发病机制的研究焦点从对Th细胞极化的研究上升到对DC1/DC2的产生、发育及调节的节点上来,把贯穿于鼻息肉发病过程的炎症反应追溯到了更上游的初级始动阶段。简而言之,就是鼻息肉研究的Th1/Th2阶段进入了DC1/DC2阶段。
展望未来,通过DC亚群对Th1/Th2免疫应答平衡这一关键调控节点如何进行精细调节的深入研究,必将丰富和深化对鼻息肉发病机制,尤其是对DC始动介导炎症反应路线图的认识,为鼻息肉的防治提供了新的思路和更精准的干预靶点。
1 Wang XD,Zheng M,Lou HF,et al.An increased prevalence of self-reported allergic rhinitisin major Chinese cities from 2005 to 2011[J].J Allergy,2016,71(8):1170-1180.
2 Shi JB,Fu QL,Zhang H,et al.Epidemiology of chronic rhinosinusitis:Results from a cross-sectional survey in seven Chinese cities[J].Allery,2015,70(5):533-539.
3 Bachert C,Gevaert P,Holtappels G,et al.Nasal polypsis:from cytokines to growth[J].Am J Rhinol,2000,14:279-290.
4 Halawi AM,Smith SS,Chandra RK.Chronic rhinosinusitis:Epidemiology and cost[J].Allergy Asthma Proc,2013,34(4):328-334.
5 Casale M,Pappacena M,Potena M,et al.Nasal polyposis:from pathogenesis to treatment,an update[J].Inflamm Allergy Drug Targets,2011,10:158-163.
6 Segura E,Amigorena S.Cross-presentation by human dendritic cellsub sets[J].Immunol Lett,2014,158:73-78.
7 Merad M,Sathe P,Helft J,et al.The dendritic cell lineage:ontoteny and function of dendritic cells and their subsets in the steady state and the inflamed setting[J].Annu Rev Immunol,2013,31:563-604.
8 Rissoan M C,Soumelis V,Kadowaki N,et al.Reciprocal control of T helper cell and dendritic cell differentiation[J].Science,1999,283:1183-1186.
9 MoserM,Murphy KM.Dendriticcellregulationof TH1-TH2development[J].Nat Immunol,2000,1:199-205.
10 Xiao BG,Huang YM,Link H.Dendritic cell vaccine design:strategies for eliciting peripheral tolerance as therapy ofautoimmune disease[J].Bio Drugs,2003,17(2):103-111.
11 Ebner S,Hofer S,Nguyen VA,et al.A novel role for IL-3:Human monocytes cultured in the presence of IL-3 and IL-4 differentiate into dendritic cells that produce less IL-12 and shift Th cell responses toward a Th2 cytokine pattern[J].J Immunol,2002,168(12):6199-6207.
12 Ito T,Liu Y J,Kadowaki N.Functional diversity and plasticity of human dendritic cell subsets[J].Int J Hematol,2005,81:188-196.
13 Hancock DG,Guy TV,Shklovskaya E,et al.Experimental models to investigate the function of dendritic cell subsets:challenges and implications[J].Clin Exp Immunol,2013,171:147-154.
14 Ayers CM,Schlosser RJ,O’Connell BP,et al.Increased presence of dendritic cells and dendritic cell chemokines in the sinus mucosa of chronic rhinosinusitis with nasal polyps and allergic fungal rhinosinusitis[J].Int Forum Al lergy Rhinol,2011,1:296-302.
15 Lin XS,Luo XY,Wang HG,et al.Expression and distribution of dendritic cells in nasal polys[J].Exp Ther Med,2013,5(5):1476-1480.
16 Wang X,Zhang N,Bo M,et al.Diversity of TH cytokine profiles in patients with chronic rhinosinusitis:A multicenter study in Europe,Asia,and Oceania[J].J Allery Clin Immunol,2016,138(5):1344-1353.
17 Lou H,Meng Y,Piao Y,et al.Cellular phenotyping of chronic rhinosinusitis with nasal polyps[J].Rhinology,2016,54(2):150-159.
18 Bernstein JM,Ballow M,Rich G,et al.Lymphocyte subpopulations and cytokines in nasal polyps:is there a local immune system in the nasal polyp[J].Otolaryngol Head Neck Surg,2004,130(5):526-535.
19 袁晓培,于德林,虞有智.鼻息肉组织中T-细胞亚群的分布及2种白细胞介素表达的初步研究[J].中华耳鼻咽喉科杂志,2000,35(5):363-366.
20 李华斌,许庚,李源,等.鼻息肉组织中Th1、Th2细胞因子的表达及其意义[J].临床耳鼻咽喉科杂志,2001,15(2):51-52.
21 程万民,郑春泉,田洁,等.鼻息肉组织辅助性T细胞亚群及相关转录因子表达[J].中国眼耳鼻咽喉科学杂志,2007,7(5):285-287.
22 RankinSM,Conroy DM,WilliamsTJ.Eotaxinand eosinophil recruitment:implications for human disease[J].Mole Med Today,2000,6(1):20-27.
23 Seillet C,Belz GT.Terminal differentiation of dendritic cells[J].Adv Immunol,2013,120:185-210.
