抗氧化型壁材包埋番茄红素微胶囊的研究
2018-03-27林蔚婷贾承胜夏书芹张晓鸣
林蔚婷, 贾承胜, 夏书芹, 张晓鸣, 冯 骉
(江南大学 食品学院,江苏 无锡 214122)
番茄红素是类胡萝卜素中的一种,主要存在于成熟的红色的水果蔬菜中,如草莓、胡萝卜和西瓜等[1]。现在越来越多的研究者开始关注番茄红素的生理功能。很多研究表明,番茄红素除了可以作为维生素A的前体,它还具有多种生理功能,其中包括慢性疾病的预防[2],以及抗氧化活性,如淬灭单线态氧、清除自由基等[3],且近年来越来越多的研究指明,在所有类胡萝卜素中番茄红素清除单线态氧的能力最强。因此,番茄红素的商业价值越来越受到人们的重视。番茄红素抗氧化活性的能力归因于其在同一平面上具有很多的共轭双键结构[4],但正是由于这种不饱和双键存在,导致番茄红素易被氧化分解,在储存和加工过程中对光、氧、热和酸等十分敏感[5]。同时,由于番茄红素是脂溶性的物质,在水中溶解性较差[6],因此极大的限制了番茄红素在食品产业中的应用。
微胶囊技术有助于芯材成分理化稳定性和溶解度的提高。随着微胶囊技术的不断发展,抗氧化微胶囊壁材的研究也越来越多,美拉德反应产物具有一定的抗氧化性能。作者以低聚木糖和乳清分离蛋白的美拉德产物为新型抗氧化微胶囊壁材包埋番茄红素,采用喷雾干燥技术制备番茄红素微胶囊,并对微胶囊化效果的工艺进行探究。以乳清蛋白为原料制成的膜透明、柔软、有弹性,且湿度较低时,能较好的阻隔氧气等气体[7]。由于乳清分离蛋白具有较多的亲水基团,因此其成膜的机械强度较低,水汽的阻隔性能也较差[8]。而低聚木糖可以与蛋白质发生糖接枝反应,使乳清分离蛋白的交联情况得到改进,从而提高乳清分离蛋白膜的机械强度及阻隔性能。值得一提的是,对于低能量的低聚木糖,除了可以降低血清中胆固醇和甘油三酯的含量,还由于其低热值和不易被人体直接吸收的特殊功能性,可适合于糖尿病患者。因此,开发和利用低能量糖和乳清分离蛋白的糖基化产物为壁材包埋番茄红素可以拓宽番茄红素微胶囊的应用范围。
1 材料与方法
1.1 主要试剂及仪器
乳清分离蛋白:山东禹王有限公司产品;番茄红素:中国华北制药厂产品;低聚木糖:国药集团化学试剂有限公司产品。Ultra-turrax T25型高速分散器:德国Janke&Kukel公司产品;JHG-Q54-P60型高压均质机:上海张堰轻工机械厂产品;B-191型实验型喷雾干燥机:瑞典Buchi公司产品;Mastersizer 2000型激光粒度分析仪:英国Malvern公司产品;722型紫外一可见分光光度计:上海精密科学仪器有限公司产品;HH-4数显恒温水浴锅:江苏金坛市荣华仪器制造有限公司产品;JB300-D型强力电动搅拌器:上海标本模型厂产品;SDTA851e TGA热分析仪:瑞典梅特勒-拖利多仪器有限公司产品。
1.2 实验方法
1.2.1 乳清分离蛋白-低聚木糖美拉德反应产物的制备 称取一定量的乳清分离蛋白(WPI)、低聚木糖分别溶于一定量的去离子水中。采用水浴加热至一定温度,使蛋白质完全溶解,将低聚木糖溶液完全分散到蛋白质溶液中,搅拌混合均匀,得到蛋白质质量分数为6%的溶液,再用NaOH溶液调pH至碱性。然后转移至具塞烧瓶中,在一定的温度下加热反应一定的时间,反应结束后在冰水浴中迅速冷却至室温或更低温度以终止反应,制备得到乳清分离蛋白与低聚木糖的美拉德反应产物(MRPs)。
1.2.2 美拉德反应产物对·OH清除能力的测定分别配制不同浓度梯度的美拉德反应产物溶液。在试管中加入1 mL 2.5 mmol/L的邻二氮菲溶液,再按顺序加入pH为7.4的PBS 2 mL和去离子水1 mL,振荡混匀后加入2.5 mmol/L的硫酸亚铁水溶液1 mL,充分混合均匀后加入1 mL的20 mmol/L过氧化氢水溶液,在37℃恒温水浴中反应,60 min后在536 nm下测 其吸光度,得到损伤管的吸光度A1。未损伤管以1 mL的去离子水代替损伤管中的过氧化氢水溶液,得到未损伤管,测吸光度A0。按损伤管的配制方法操作,并以1 mL样品代替损伤管中的去离子水,得到样品管,测得吸光度A2。由公式(1)计算·OH 清除率(I):
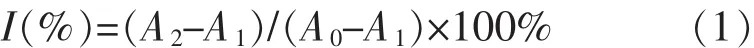
1.2.3 美拉德反应产物对DPPH·清除能力的测定分别配制不同浓度梯度的美拉德反应产物溶液。向试管中分别加入2 mL用无水乙醇配制的0.1 mmol/L的DPPH·溶液和2 mL美拉德反应产物溶液,混合均匀后,在室温下放置30 min后在517 nm处测得吸光度Aa,同时测定2 mL DPPH·溶液和2 mL无水乙醇混合后的吸光度Ab,以及2 mL美拉德反应产物溶液和2 mL无水乙醇混匀后的吸光度Ac[9]。由公式(2)计算清除率(I):

1.2.4 番茄红素标准曲线的绘制 称取一定质量的番茄红素溶于乙酸乙酯中,用超声促溶,再对溶液进行紫外—可见扫描,得番茄红素最大吸收峰为474 nm,再根据GB/T 14251-1993的方法制备标准曲线。准确称取番茄红素标准品0.002 5 g,用乙酸乙酯将其溶解并定容到50 mL,摇匀。再分别吸取0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0 mL 置于50 mL棕色容量瓶中,用乙酸乙酯定容。在474 nm处测定吸光值(参比溶液为乙酸乙酯),以吸光值(A474)为纵坐标,番茄红素质量浓度(μg/mL)为横坐标绘制番茄红素标准曲线。
1.2.5 番茄红素微胶囊的制备 用喷雾干燥法制备番茄红素微胶囊,喷雾干燥工艺参数为:进料温度55℃,进风温度190℃,出风温度90℃,喷雾压力180 kPa。
1.2.6 番茄红素微胶囊制备工艺参数的优化 以接枝程度(DG)、褐变程度、微胶囊化效率和产率为指标,采用单因素实验研究乳清分离蛋白与低聚木糖的质量比、反应时间、pH值以及均质压力对番茄红素微胶囊制备的影响,确定微胶囊制备工艺参数。
1.2.7 接枝度计算 采用邻苯二甲醛(OPA)法计算接枝度,其中OPA试剂要现配现用。准确称取40.0 mg的OPA,用1.0 mL甲醇溶解,溶解完全后加入2.5 mL 20%的十二烷基硫酸钠,25.0 mL 0.1 mol/L硼砂,100 μL β-巯基乙醇,最后再用蒸馏水定容到50 mL。测定时,取4.0 mL OPA试剂于试管中,加入200 μL样品,混合均匀后在35℃水浴中反应2 min,最后在340 nm下测吸光值A340,空白样的配制为向4.0 mL OPA试剂中加入200 μL水。以赖氨酸为标准物作标准曲线,利用曲线回归方程计算出样品中自由氨基的浓度C[10-11]。
接枝度计算按公式(3):

式中,C0为未反应时溶液中自由氨基的浓度,mol/L;Ct为反应t小时后溶液中自由氨基的浓度,mol/L。
1.2.8 WPI-糖美拉德反应褐变程度的测定 取1.0 mL反应物加入5.0 mL质量分数0.1%SDS稀释液,以稀释液作空白,在420 nm下测定吸光值A420,以吸光度大小来反映美拉德反应的褐变程度[11-12]。
1.2.9 乳状液稳定性的测定 在美拉德反应物溶液中加入番茄红素溶液,高速分散器分散2 min(18 000 r/min),高压均质两次(均质压力为 40 MPa),制得乳状液。采用Mastersizer 2000激光粒度分析仪测定新制备的乳状液及25℃静置24 h后的乳状液的粒径分布和平均粒径dm。
1.2.10 微胶囊化产率与效率的测定
1)微胶囊产品中番茄红素含量的测定[12]称量20 mg微胶囊产品于烧杯中,加一定量去离子水形成均匀的分散相后,再加入乙酸乙酯,对样液进行超声10 min,使有机相充分萃取出番茄红素,反复数次至水相变为无色,合并有机相,并加适量无水硫酸钠干燥,有机相用乙酸乙酯定容到50 mL,在474 nm处测吸光值,代入番茄红素标准曲线的回归方程中计算出番茄红素质量浓度。
2)微胶囊表面番茄红素质量浓度的测定[13]称20 mg样品于离心管中,加15 mL乙酸乙酯,剧烈震荡 1 min,离心 5 min(3 000 r/min),分离上清液与沉淀物,取沉淀物复溶于乙酸乙酯中多次提取至上清液无色,将上清液合并后定容至50 mL,474 nm处测吸光值,代入番茄红素标准曲线的回归方程中计算出番茄红素质量浓度。
1.2.11 番茄红素微胶囊的表面结构的观察 取少量样品用双面胶粘于样品台上,喷金后将其放入QUANTA-200型扫描电子显微镜(SEM)样品腔内观察微胶囊的外形结构。加速电压为20 kV,放大倍数分别为600和2 000倍。
1.2.12 微胶囊化番茄红素保留率的测定 分别取0.1 g样品放入培养皿中,盖上盖子,并置于4℃和25℃下储存。每隔相同时间测定样品中的番茄红素质量浓度,计算保留率[13-14]。
1.3 数据统计
数据统计使用SPSS软件。
2 结果与讨论
2.1 标准曲线
以分光光度法所得吸光值(A)对浓度(C)进行线性回归,番茄红素标准曲线见图1,回归方程为:A=0.047 2C+0.002 8(R2=0.998 9)。

图1 番茄红素标准曲线Fig.1 Standard colorimetry curve of lycopene
2.2 美拉德反应产物的抗氧化性
制备美拉德反应产物,其反应条件为蛋白质与糖的配比1∶2,反应温度90℃,反应时间3 h,反应体系pH 10。
2.2.1 美拉德反应产物对·OH的清除能力 羟基自由基(·OH)清除率是反映物质抗氧化能力的主要指标之一。

图2 MRPs对·OH的清除率Fig.2 Scavenging effect of MRPs on·OH
从图2可以看出,MRPs对·OH具有显著清除能力(P<0.05),且抗氧化活性与MRPs质量分数呈正比,随着质量分数的增加,其清除·OH的能力逐渐增强。MRPs具有抗氧化活性可能是因为它不仅是一种氢供体,也是一种金属螯合剂,可与Fe2+螯合,所以MRPs能够发挥较强的抗氧化作用[14]。
2.2.2 美拉德反应产物对DPPH·的清除能力DPPH·在乙醇溶液中呈紫色,若溶液中含有自由基清除剂,则DPPH·的单电子会与自由基清除剂配对,配对后DPPH·浓度减小,溶液颜色变浅,相应的在517 nm处的吸光度也变小。乳清分离蛋白与低聚木糖反应得到的MRPs对DPPH·的清除作用如图3所示。

图3 MRPs对DPPH·的清除率Fig.3 Scavenging effect of MRPs on DPPH·
从图3可知,且清除率随MRPs质量分数的增加而增强,且当质量分数超过6%时,MRPs具有对DPPH·的显著清除能力(P<0.05)。可能是由于美拉德反应会生产类黑精,而类黑精结构中的短肽的支链氨基酸具有抗氧化活性,同时,美拉德反应除了产生类黑精,还会生成一些具有一定抗氧化活性的还原酮类物质以及杂环类化合物[14]。
2.3 番茄红素微胶囊制备工艺参数的选择
2.3.1 蛋白质与糖质量比例 以乳清分离蛋白与低聚木糖的MRPs作为壁材包埋番茄红素,固定芯壁比为质量比1∶6,反应温度为90℃,反应时间为3 h,通过改变蛋白和糖的比例测得MRPs的接枝度和褐变程度,以及其微胶囊化效率和产率。蛋白质与低聚木糖不同配比对MRPs的接枝度和褐变程度的影响以及对微胶囊效率、产率的影响如图4和图5。
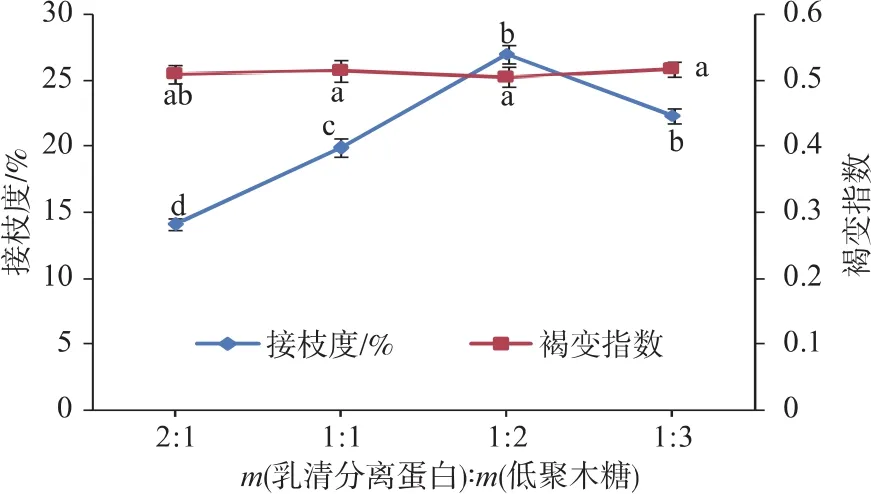
图4 蛋白质与低聚木糖不同配比对MRPs的接枝度和褐变程度的影响Fig.4 Effect of different WPI:xyloligosaccharides mass ratios on DG and browning of MRPs
从图4中可以看出,底物质量配比对接枝度的影响比较显著(P<0.05),当蛋白质用量一定时,随着糖质量的提高,反应物分子之间碰撞的几率大大增加,从而提高了蛋白质自由氨基和糖分子还原末端的羰基之间的接触几率,促进反应的发生。但是,当糖含量继续增加,一方面因为蛋白质分子和糖分子之间本身具有一定的空间位阻作用,阻隔了分子之间的碰撞,使反应受阻;另一方面,溶液的性质,如黏性增加也会阻碍分子之间的接触,因此,适当的底物配比既能增加反应的速率,又能降低副反应的发生。由图4可知接枝度随着乳清分离蛋白与低聚木糖的质量比呈现先增后减的趋势,当底物配比为1∶2时,接枝度达到最大,且褐变指数在0.5左右,褐变程度相对最小。
同时,从图5可以看出,底物配比对包埋效率和包埋产率的影响显著(P<0.05),包埋效率随着低聚木糖的用量的增加而增加,但是当配比达到1∶3时,包埋产率大幅减少。这是因为,在乳状液中,具有表面活性的乳清分离蛋白分子是完全吸附在油水界面上,在喷雾干燥的过程中,由于水分的瞬间蒸发,部分蛋白膜失去水分而导致整体膜的不均衡收缩,并最终造成膜稳定性的下降。当糖分子存在时,含有羟基的糖分子可以共价接入蛋白质分子中代替蒸发的水分子,使蛋白膜保持类似水合态时的稳定性,减轻膜的损坏[15]。此外,糖分子的增加能增加乳状液中固形物的含量,促使在喷雾干燥过程中小分子颗粒能够迅速固化[16],使油相分子渗出膜表面几率大为减少,从而提高产品效率。但是,当糖含量过高时,虽然产品效率好,但乳状液喷雾干燥粘壁较为厉害,从而导致干燥这一步损失较大,产率下降。因此,乳清分离蛋白与低聚木糖的配比选择为 1∶2 为宜。

图5 蛋白质与低聚木糖质量比对微胶囊的效率和产率的影响Fig.5 Effect of different WPI:xyloligosaccharides mass ratios on EE and EY
2.3.2 加热时间 以乳清分离蛋白与低聚木糖的MRPs作为壁材包埋番茄红素,固定芯壁质量比为1∶6,蛋白质与糖的质量比例为 1∶2,采用不同反应时间制备番茄红素微胶囊壁材。反应时间对MRPs的接枝度和褐变程度的影响以及对微胶囊效率、产率的影响如图6和图7所示。

图6 反应时间对MRPs的接枝度和褐变程度的影响Fig.6 Effect of different heating time on DG and browning of MRPs
图6表明,随加热时间增加,接枝度也逐渐增加,加热时间对接枝度的影响显著(P<0.05),当加热时间超过3 h后,接枝度的增加速度放缓,加热时间对接枝度的影响不显著(P>0.05)。而随着时间的增加,褐变指数一直逐渐增加,但当时间增加到3 h后,随着时间的增加褐变指数呈现急剧增大的趋势,加热时间对褐变指数的影响显著(P<0.05)。这是由于,刚开始加热时,乳清分离蛋白的氨基没有全部暴露出来,持续加热,蛋白质球状分子结构部分伸展开来,提高了多糖与蛋白质的结合几率,接枝度随之增加。但是继续加热,不仅会对蛋白质分子的一些赖氨酸造成破坏,同时,蛋白质结构的持续展开造成蛋白质紧密结构破坏,蛋白质分子间相互作用增大,易形成凝聚和沉淀,接枝反应受阻。
图7表明,加热时间对包埋效率和包埋产率有着显著的影响(P<0.05),在加热初期,微胶囊包埋效率随加热时间的增加而增大,当加热时间达到3 h时,包埋产率最大,达到81.08%,此时的微胶囊化效率也很高,为82.04%。这一现象可能与乳状液稳定性有关。美拉德反应能够促使蛋白伸展并与碳水化合物结合。随着加热时间的延长,与蛋白结合的碳水化合物分子的量也增加,从而破坏了蛋白原来的紧密结构,促进形成了一定的空间位阻,增强了乳状液的保护层的厚度,提高了乳状液的稳定性。当继续加热的时候,美拉德反应会产生一些小分子物质,这些小分子物质不能很好的吸附在油水界面,从而破坏了乳状液的稳定性,而乳状液的稳定性对包埋效率和包埋产率都至关重要。因此,综合考虑,加热时间为3 h最适。
2.3.3 反应pH值 美拉德反应中的许多反应都是酸碱催化,因此pH是重要的影响因素之一,控制其他条件不变,测定不同反应物浓度的pH,考察其对包埋效果的影响。不同pH值对MRPs的接枝度和褐变程度的影响以及对微胶囊效率、产率的影响见图8和图9。
从图8可以看出,pH值对接枝程度与褐变指数的影响显著(P<0.05),两者都随着pH的增大而增大。大部分美拉德反应都是碱催化反应,因为氨基酸分子既有酸性基团-COOH,又有碱性基团-NH2,在碱性介质中主要以反应性较强的阴离子形式存在,此时容易发生美拉德反应,但是过碱的环境会破坏蛋白质的一级结构,造成如脱氨、脱羧和肽键断裂等变化,从而导致氨基酸发生“胱赖反应”而变成有毒的化合物,反而对接枝反应不利[17],因此一般美拉德反应仅限于pH 3~10。

图9 反应体系pH值对微胶囊的效率和产率的影响Fig.9 Effect of different pH on EE and EY
图9表明,随着pH值的增加,包埋效率也随之增加,当pH值为10时,包埋效率达到最高值90.43%,同时也获得了较高的包埋产率,但是,当pH继续增加,包埋效率则有所减少,在pH为10时,pH值对包埋效率具有显著影响(P<0.05)。其原因可能与静电斥力的作用有关。由于pH值的增加,介质逐渐成为碱性,多肽链的净电荷也逐渐增加,从而提高了分子之间的静电相互作用力,导致了扩散双电层和溶液界面的增厚。这种现象有利于胶束的形成,相应的提高了乳化活性,促进微胶囊的形成。
2.3.4 均质压力 提高均质压力是为了减小芯材的粒度,使芯材与壁材充分混合,同时也能使乳状液液滴的粒径减小,形成稳定的乳状液。不同均质压力对乳状液的平均粒径及微胶囊包埋效果的影响如表1所示。
从表1可以得到,随着乳状液均质压力的增加,乳状液平均粒径也逐渐减少,均质压力对粒径的影响显著(P<0.05),在均质压力为 40 MPa时,乳状液平均粒径为1.31 μm,同时番茄红素微胶囊的包埋效率和包埋产率也都随着均质压力的增加而增加(有显著影响P<0.05),并在40 MPa时达到最高值,分别为94.11%和86.28%。但是,当均质压力进一步提高到50 MPa时,乳状液的平均粒径开始增大,微胶囊的包埋效率和产率也随之减少。这是因为,当增加均质压力时,压力越高,越有利于乳状液形成较小而均匀的液滴,一方面较小的液滴能增加喷雾干燥过程中质量传递以及水分蒸发的速率,防止液滴内部物质移向液滴表面[18];另一方面,乳状液液滴越小,乳状液越均匀,液滴发生凝聚的可能性越低,有利于乳状液的稳定性。但是,当均质压力过高时,使得乳状液液滴过小,过小的液滴表面积大,表面自由能大,液滴极不稳定,有自动缩小表面积向稳定状态方向发展的趋势,即小液滴重新合并变大,这不利于乳状液的稳定性,并会最终导致包埋效果降低。

表1 均质压力对乳状液的平均粒径以及微胶囊包埋效果的影响Table 1 Effect of homogenization pressure on mean particle diameter and EE
2.4 美拉德反应产物制备番茄红素乳状液的稳定性
乳状液液滴的平均粒径随着储存时间的增加变化越缓慢,则乳状液越稳定,越有利于微胶囊产品的包埋效率和产率。贮存24 h的乳状液稳定性如图10所示。

图10 乳状液的稳定性Fig.10 Stability of emulsion
由图10可知,在相同条件下,放置24 h,乳状液液滴的粒径分布变化不大,由此表明,乳状液的乳化稳定性好,具有稳定番茄红素乳状液的能力,有助于提高包埋效果。
2.5 番茄红素微胶囊的表面结构
SEM图片能够显示微胶囊化番茄红素的表观特征。番茄红素微胶囊的外形结构见图11。
由图11可以看出,微胶囊外观形态为圆形,且分散性良好,整个表面连续光滑,具有典型凹陷但没有裂痕和缝隙,这说明有较高的微胶囊化效率。光滑的表面形态可能是由于碳水化合物的加入形成的。碳水化合物可以与水分子结合,从而锁住水分,利用这些水分子填补微胶囊的多余空间,防止表面的皱缩,从而使得微胶囊囊壁更加光滑,均一[18]。典型凹陷的形成与喷雾干燥过程的雾化有关,尤其是在冷却的阶段,当高速率喷雾时,热气流会造成微胶囊膨胀;当冷却时,微胶囊恢复原状,之前固化的壁材就皱缩,形成凹陷。

图11 番茄红素微胶囊产品的外形结构Fig.11 Scanning electron microscope oflycopene microcapsules
2.6 番茄红素微胶囊的保留率
芯材保留率是衡量微胶囊化番茄红素贮存稳定性的一个重要指标。4℃和25℃储存时,番茄红素保留率随时间变化关系如图12和图13所示。

图12 4℃下产品的稳定性Fig.12 Stability of products at 4℃
从图中可以看出,在4℃和25℃下分别存放番茄红素微胶囊产品时,番茄红素都发生了不同程度的降解。当温度升高时,降解反应加剧,番茄红素损失增加,微胶囊囊芯番茄红素的降解速率要比囊外的番茄红素慢很多,在4℃下避光储存24 d的番茄红素微胶囊保留率为78.25%远大于25℃下避光储存的保留率(47.91%)。这说明,微胶囊壁材对番茄红素有着明显的保护作用。

图13 25℃下产品的稳定性Fig.13 Stability of products at 25℃
3 结 语
采用乳清分离蛋白WPI与低能量的低聚木糖糖基化产物作为壁材,蛋白与糖质量配比为1∶2,反应时间为3 h,反应体系pH值为10,均质压力为40 MPa,喷雾干燥进风温度为190℃,出风温度为90℃,微胶囊效率可达到94.11%,产率为86.28%,平均粒径为1.31 μm,乳状液稳定性良好。在最佳条件下,所得的微胶囊产品在4℃下避光储存24 d,所得保留率为78.25%,室温避光储存24 d,所得保留率为47.91%,微胶囊化后,番茄红素的稳定性得到了较大幅度的提高。
参考文献:
[1]LI Chunsheng.Research summary of lycopene[J].Academic Periodical of Farm Products Processing,2009,1:1671-9646.(in Chinese)
[2]XUE F,LI C,LIU Y,et al.Encapsulation of tomato oleoresin with zein prepared from corngluten meal[J].Journal of Food Engineering,2013,119:439-445.
[3]DODDAIAH K M,NARAYAN A,ASWATHANARAYANA R G,et al.Effect of metabolic inhibitors on growth and carotenoid production in dunaliella bardawil[J].Journal of Food Science and Technology,2011,50:1130-1136.
[4]RAO A V,AGARWAL S.Role of lycopene as antioxidant carotenoid in the prevention of chronic diseases:a review[J].Nutrition Research,1999,19:305-323.
[5]LIN C,CHEN B.Stability of carotenoids in tomato juice during storage[J].Food Chemistry,2005,90(4):837-846.
[6]SHI Hui,JING Siqun,ZONG Wei,et al.Preparation of double coating lycopene microcapsule[J].Food Science and Technology,2014,39(5):242-246.(in Chinese)
[7]ZHANG Xi,LI Qi,JING Hao.Film-forming properties of Maillard reaction products formed from whey protein and xylose and their inhibitory effect on lipid oxidation in walnut kernel[J].Food Science,2011,32(5):58-64.(in Chinese)
[8]GHANBARZADEH B,OROMIEHI A R.Biodegradable biocomposite films based on whey protein and zein:Barrier,mechanical properties and AFM analysis[J].International Journal of Biological Macromolecules,2008,43:209-215.
[9]SUN Tao,HU Dongmei,CHEN Chunhong,et al.The Maillard reaction of chitosan oligosaccharide with xylose and the antioxidant activity of the chitosan oligosaccharide derivatives[J].Journal of Food Science&Biotechnology,2012,31(11):1198-1202.(in Chinese)
[10]LAROQUE D,INISAN C,BERGER C,et al.Kinetic study on the Maillard reaction.Consideration of sugar reactivity[J].Food Chemistry,2008,111:1032-1042.(in Chinese)
[11]AJANDOUZ E H,TCHIAKPE L S,ORE F D,et al.Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J].Journal of Food Science,2001,66:926-931.
[12]GOULA A M,ADAMOPOULOS K G.A new technique for spray-dried encapsulation of lycopene[J].Dry Technology,2012,30:641-652.
[13]ZHAO Xiaoyan,FENG Zuoshan,CHEN Fusheng.Studies on stability of microencapsulated lycopene [J].Food and Fermentation Industries,2005,31(10):45-47.(in Chinese)
[14]YOSHIMURA Y,IIJIMA T,WATANABE T,et al.Antioxidative effect of Maillard reaction products using glucose-glycine model system[J].Journal of agriculture and Food Chemistry,1997,45(10):4106-4109.
[15]SHU Bo,ZHAO Yapin,YU Wenli.Encapsulation of lycopene with gelatin and sucrose[J].Science and Technology of Food Industry,2004,9:52-58.(in Chinese)
[16]SHAH B,DAVIDSON P M,ZHONG Q.Encapsulation of eugenol using Maillard-type conjugates to form transparentand heat stable nanoscale dispersions[J].Food science and Technology,2012,49:139-148.
[17]GUAN Junjun,QIU Aiyong,LIU Xiaoya.Effects of conditions on soy protein isolate-saccharide graft reaction by microwave radiation[J].Journal of Food Science and Biotechnology,2005,24(5):16-20.(in Chinese)
[18]BRUSCHI M L,CARDOSO M L C,LUCCHESI M B,et al.Gelatin microparticles containing propolis obtained by spray-drying technique:preparation and characterization[J].International Journal of Pharmaceutics,2003,264:45-55.
