猪蓝耳病与猪链球菌、副猪嗜血杆菌混合感染的诊治
2018-03-27,,,,,,
, , , , , ,
林 毅, 戴卓建, 叶勇刚, 李兴玉, 张先惠, 叶健强, 潘 梦, 肖 璐
(四川省畜牧科学研究院,四川 成都 251600)
猪蓝耳病亦称猪繁殖与呼吸综合征,是由猪繁殖与呼吸综合征病毒(PRRS)引起的猪的急性接触性传染病[1],可造成母猪的繁殖障碍和仔猪的呼吸症状,具有发病快、死亡率高等特点。猪链球菌病是由链球菌感染所引起的猪的一类疾病的总称,该病分布范围极广,世界各地均有发生[2];副猪嗜血杆菌是猪上呼吸道的一种常在菌,但在特定条件下能够侵入机体并引起严重的全身性疾病,以纤维素性多发性浆膜炎、关节炎和脑膜炎为特征[3]。2017年10月份,四川某猪场爆发以高烧、呼吸道、共济失调、圆圈运动等脑神经炎症和急性型败血症症状为主的病情,发病急、死亡高。经临床诊断及实验室确诊为猪蓝耳病及猪链球菌、副猪嗜血杆菌病混合感染导致。采取对症措施后,疫病很快得到控制,现将有关情况报告如下。
1 临床症状
发病猪以育肥猪为主,兼有仔猪发病,怀孕母猪流产,部分猪经治疗无效后死亡。病猪主要表现为体温升高,高达41℃~42℃,病猪食欲极具下降,咳喘及呼吸急促,部分猪共济失调、站立不稳、转圈运动等症状的神经特征,下腹、耳尖以及四肢末端的皮肤出现发紫或者发红的迹象。
2 剖检病变
病猪内脏器官出血,心包积液,心包积液并有纤维素性渗出物,心肌表面呈“绒毛心”,肺脏部位具有较多的纤维素样的渗出物。腹股沟淋巴结肿大明显、切面水肿、出血。胸腔积有大量黄色液体并有纤维素渗出物。全身内脏器官出血,肺脏肿大,间质增宽,呈现大理石样或者斑驳状。肾脏有能够见到少量出血点,大肠有出血点,膀胱黏膜部位有出血点,关节肿胀,有大量渗出物。
3 实验室确诊
3.1 病料采集
无菌采集病猪病猪肺脏、脾脏、淋巴结,置于冰盒中送实验室备检。引物设计[4-6]合成猪瘟、圆环、蓝耳鉴定引物,参考Oliveira等[7]的Hps 16S rRNA引物副猪嗜血杆菌病合成上、下游引物,参考PICARD等[8]合成猪链球菌鉴定引物,细菌16s基因由本实验室保存(见表1)。

表1 鉴定引物列表
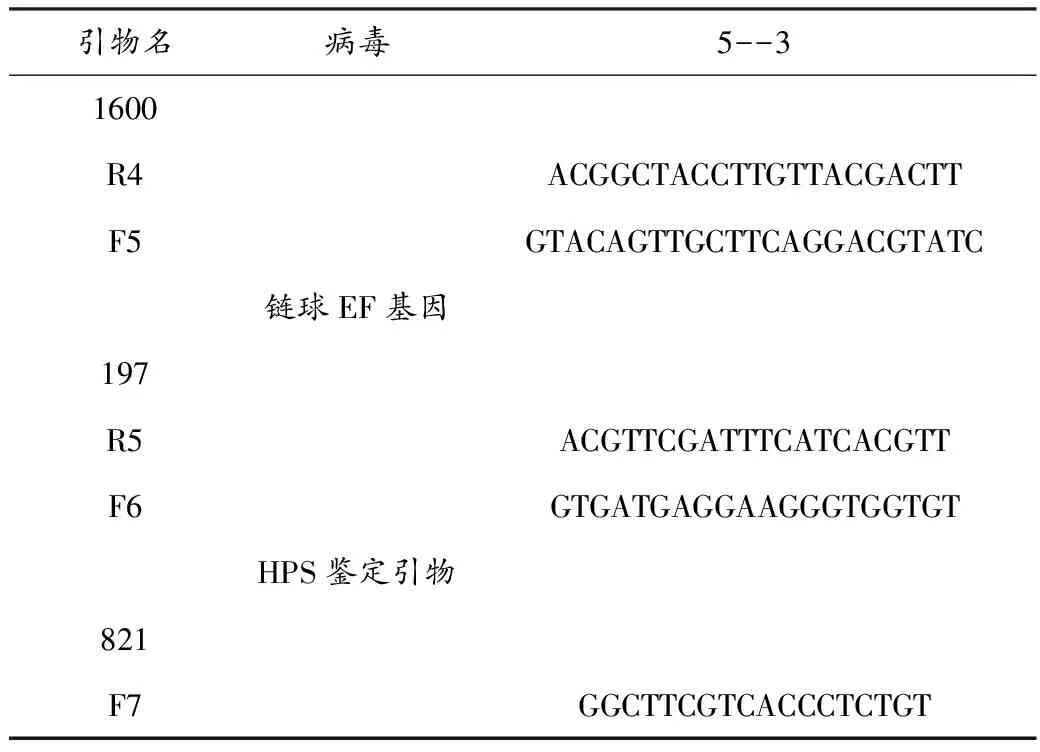
续表1
3.2 病毒DNA/RNA提取
采用天根组织病毒DNA/RNA提取试剂盒提取病毒总DNA和RNA,采用宝生物RNA反转录是试剂盒(RNA to cDNA EcoDryTM premix)反转录cDNA。
3.3 PCR反应
采用95℃ 3 min,95℃ 30 s、55℃ 30 s、72℃1 min 30循环,72℃ 终延伸10 min。2%的琼脂糖凝胶电泳鉴定。
4 细菌分离鉴定
无菌采集肺脏、心血、关节液无菌接种鲜血琼脂平板和TSA平板(含有5%的血清及0.002%的NAD),挑取优势菌落精简并划线相应的培养基,挑取单菌落接种TSB液体培养基(含有5%的血清及0.002%的NAD)并进行16S基因扩增并测序,同时采用链球菌及副猪嗜血杆菌病鉴定引物PCR鉴定。
5 致病性试验
将分离纯化的细菌接种TSB肉汤(含0.0002% NAD 和5%新生牛血清),皮下注射小鼠0.4 mL,每种细菌注射5只同时设置5只小白鼠对照组,对照组皮下注射0.4 mL无菌生理盐水。
6 结果
6.1 病毒PCR检测结果
经RT-PCR及PCR鉴定,确诊送检病料中存在高致病性蓝耳病毒,未检出猪瘟、圆环病毒(检测结果见图1)。

图1 猪瘟 圆环 蓝耳PCR检测结果
注:1-3:一号样品猪瘟、圆环、蓝耳检测结果;4-6:二号样品猪瘟、圆环、蓝耳检测结果;7-9:三号样品猪瘟、圆环、蓝耳检测结果;10-11:阴性对照;12:DL2000 Maker Plus
6.2 细菌分离鉴定
TSA平板(含0.0002% NAD 和5%新生牛血清)上优势菌为圆形、光滑湿润、无色透明的菌落形态革兰氏染色为阴性短杆菌(见图2);鲜血琼脂上优势菌落为圆形、针尖大小的半透明状菌落形态,革兰氏染色为阳性单个、成对或者短链状的椭圆形菌(见图3)。
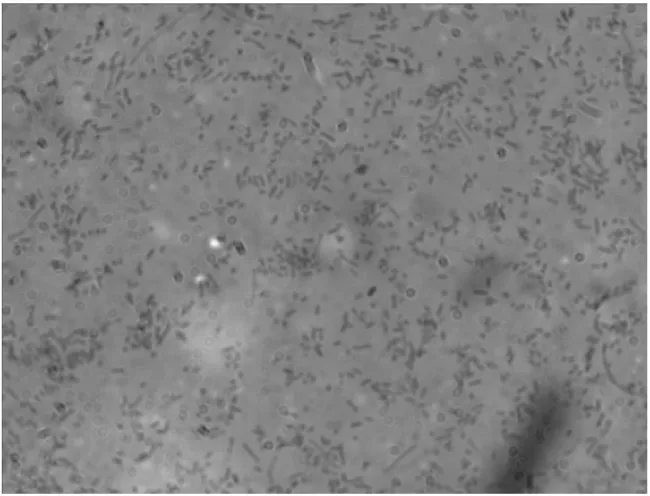
图2 TSA平板优势菌染色镜检

图3 鲜血琼脂平板优势菌颜色镜检
6.3 细菌16S鉴定及特异性鉴定
采用采用细菌16 s引物扩增细菌16S基因片段,并送上海生工进行测序,经NCBI上序列比对确定TSA平板上优势菌围副猪嗜血杆菌,鲜血琼脂平板上优势菌为猪链球菌(见图4);采用副猪嗜血杆菌鉴定引物及猪链球菌鉴定引物对纯化的细菌进行PCR鉴定,复检确诊TSA平板上优势菌为副猪嗜血杆菌(见图5),血平板上优势菌为猪链球菌(见图6)。
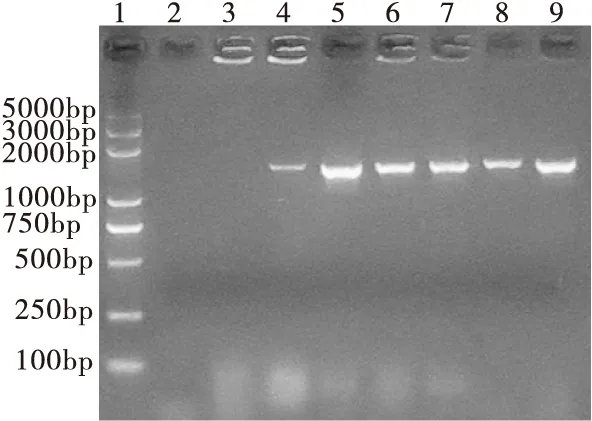
图4 TSA平板及血平板上优势菌16S电泳图
注:1.DL2000 Maker plus ,2-3.阴性对照,4-5.TSA平板优势细菌16s鉴定 ,6-9.鲜血琼脂平板优势细菌16 s鉴定

图5 副猪嗜血杆菌鉴定
注:1.DL2000 Maker plus ,2.阴性对照,3-4.副猪嗜血杆菌PCR鉴定

图6 猪链球菌鉴定
注:1.阴性对照,2-9.猪链球菌PCR鉴定,10. DL2000 Maker plus
6.4 致病性试验
副猪嗜血杆菌和猪链球菌皮下注射小白鼠24 h后,副猪嗜血杆菌4只死亡(4/5),猪链球菌5只死亡(5/5),对照组无死亡,将死亡小鼠的心血接种TS平板和血平板,分离出对应的副猪嗜血杆菌和猪链球菌,证明这两种菌具有较强的致病性。
7 防控措施
该次疫情主要是高致病性蓝耳病毒感染猪群后,造成其淋巴器官中的 T细胞和 B 细胞数量减少、淋巴组中巨噬细胞浸润以及外周血和淋巴组织中的巨噬细胞、单核细胞数量升高,最终导致猪群免疫系统受到侵害,引发猪的免疫抑制,使的猪的呼吸系统抵抗力降低。副猪嗜血杆菌与猪链球菌为猪呼吸系统常见病,当猪群发生蓝耳病时,副猪嗜血杆菌与猪链球菌呈现较高的分离率,且这两种病原协同时可引发或加重疾病。
目前蓝耳病缺乏有效的治疗药物,该病是一种免疫抑制病,其引发的免疫抑制导致的继发感染常常加重猪场的损失,因此控制蓝耳病猪群的继发感染会大大降低猪群的发病率和死亡率。选用对副猪嗜血杆菌和猪链球菌都有效的头孢类药物(如头孢哌酮和头孢噻呋钠)以及替米考星可以有效的控制继发感染。对于蓝耳病,虽然疫苗免疫是猪场最常规的方法,但是由于蓝耳病弱毒疫苗毒株多样,各个疫苗毒株之间的杂交、重组导致的毒力返强时有发生,因此对不稳定猪群推荐使用蓝耳病灭活苗稳定猪群,配合使用抗病毒中药(七清败毒散、白虎汤等),免疫增强剂(黄芪多糖、活性肽等)和免疫因子(白细胞介素、干扰素、转移因子),同时对发病猪群加强护理、保温、清洁卫生等措施。该场猪群采用七清败毒散拌料、黄芪多糖饮水,肌注头孢噻呋钠,仔猪肌注倍健+ 倍康肽组合,猪群疫情迅速得到有效控制。
[1] 高许雷,吴发兴,朱紫祥,等.我国五省区部分猪场高致病性猪蓝耳病毒感染情况检测与分析[J].动物医学进展,2009,30(11):33-36.
[2] 江定丰,陈灵芝.猪链球菌2型感染猪和人的现状及研究进展[J].动物医学进展,2008,29(5):82-85.
[3] lewis P A,Shope R E.Haemophilus parasuis.A hemophilic bacillus from the respiratory tract of infected swine[J].The Journal of experimmental medicine.1931,54(3):361-371.
[4] 陈甜甜,程福亮,梁瑾,等.猪瘟和猪蓝耳病病毒多重RT-PCR检测方法的建立及初步应用[J].中国生物制品学杂志,2013,26(3):425-429.
[5] 左奕,王建永,袁万哲,等.PCV2-PRV-PRRS-CSFV多重PCR检测方法的建立[J].中国兽医科学,2015,45(8):771-775.
[6] 王晓波,李丽敏,袁万哲,等.猪瘟病毒和猪繁殖与呼吸综合征病毒高致病性典毒株多重RT-PCR方法的建立及应用[J].中国兽医学报,2015,35(5):675-679.
[7] Oliveira S,Galina L,Pijoan C.Development of a PCR test to diagnose Haemophilus parasuis infections [J].J Vet Diagn Invest, 2001, 139(6):495-501.
[8] PICARD F J,KE D,BOUDREAU D K,et al.Use of tuf sequences for genus-specific PCR detection and phylogenetic analysis of 28 streptococcal species[J].J Clin Microbiol,2004,42(8)3686-3695.
