响应面法优化云南松树皮多聚原花青素片段化条件
2018-03-27李美娟姜永新张加研李莲芳
张 霞 李美娟 姜永新 李 娜 张加研 李莲芳 赵 平
(1. 西南林业大学云南省木材胶黏剂及胶合制品重点实验室,云南 昆明 650224;2. 西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224)
植物原花青素由不同数目黄烷3-醇结构单元通过不同键合方式聚合而成,是迄今为止发现的最为优良的天然抗氧化剂,广泛应用于食品、保健品、医药品等领域[1-5]。根据原花青素聚合度的大小,一般将2~4聚体称为低聚原花青素,5聚体以上的称为多聚原花青素 (PPC)[6]。以往研究表明,聚合度对原花青素抗氧化活性的影响较大,随着聚合度的增加其抗氧化活性明显下降[6-8]。与PPC相比,低聚原花青素生物利用度较高,在抗氧化、清除自由基、抗癌、抗衰老等方面具有显著的生物活性[9-11]。大多数植物中的原花青素主要以PPC的形式存在。研究发现,云南松 (Pinusyunnanensis) 树皮中低聚原花青素含量仅为0.569%,而PPC含量则高达8%[12],木瓜原花青素中的PPC更占到90%之多[13]。因此,利用片段化技术将PPC有效转化为高活性低聚原花青素具有重要意义。
构成原花青素的黄烷3-醇结构单元之间的连接键的酸催化裂解是原花青素最重要的化学反应之一。在适当的酸性条件下,其连接键容易发生断裂,末端的结构单元被释放的同时,另一延伸单元C-4位则形成正碳离子,容易被茶多酚(TP)中的儿茶素类或其他巯基试剂等亲核试剂捕捉,从而形成亲核剂附加产物。前期基于茶多酚的PPC片段化研究发现,原花青素二聚体表儿茶素-(4β-8)-表没食子儿茶素3-O-没食子酸酯 (1) 是松树皮PPC和木瓜PPC的主要片段化产物[14],其抗氧化能力均高于松树皮PPC、TP和片段化总产物,采用响应面法[15-17]对思茅松树皮PPC和白花木瓜PPC的片段化反应条件进行了优化[18-19],具有良好的开发利用前景[20]。
本研究以云南松树皮PPC为原料,片段化产物1的含量为评价指标,分析了片段化反应温度、反应时间、盐酸浓度和PPC/TP对产物1生成的影响,通过响应面法优化其片段化条件,实现云南松树皮PPC向主产物1的高效转化,为云南松树皮PPC片段化产物进一步的开发利用提供参考依据。
1 材料与方法
1.1 试验材料与试剂
采用云南松树皮的80%乙醇水提取物经柱层析制备得云南松树皮PPC,经UV检测原花青素纯度为90%[20]。
本实验室分离纯化所得表儿茶素-(4β-8)-表没食子儿茶素3-O-没食子酸酯 (1) (纯度98%);茶多酚;乙腈 (色谱纯),磷酸和浓盐酸 (分析纯),水为重蒸馏水。
1.2 试验仪器
Agilent Technologies 1200高效液相色谱仪;HH-2电热恒温水浴锅;EYELA N-1100旋转蒸发仪。
高效液相色谱分析条件:色谱柱,Agilent Analytical Eclipse XDB-C18 (4.6 mm × 150 mm, 5 μm);流动相,A:0.34% H3PO4/H2O,B:0.34% H3PO4/CH3CN;洗脱梯度:0~15 min (4%~25% B), 15~18 min (25%~90% B), 18~20 min (90%~95% B), 20~24 min (95% B);流速:1.0 mL/min;柱温:30 ℃;检测波长:280 nm;进样量:5 μL。
1.3 试验方法
1.3.1片段化反应及主产物1的HPLC含量分析
参照李娜等[18]的方法,精确称取云南松树皮PPC和TP各10.000 0 mg,置入10 mL棕色容量瓶中用1% HCl水溶液充分溶解、定容后,分别配制浓度为1.0 mg/mL的PPC和TP溶液。精确吸取上述2种溶液各500 μL,充分混匀后于70 ℃恒温水浴中反应1 h,置于冰水冷却以终止反应。反应液经0.45 μm滤膜过滤后,取5 μL按1.2所示条件进行HPLC分析。HPLC色谱分析图如图1所示,由图中片段化主产物1的峰面积,根据产物1的标准曲线[19]所得的线性回归方程:y=188.05x+ 0.587 7 (R2=0.999 8),式中x为产物1的质量 (μg)、y为产物1的峰面积,并按反应总体积换算得到产物1的含量 (μg/mL)。

图1片段化反应溶液的HPLC色谱
Fig.1 The HPLC profile of fragmented reaction solution
1.3.2单因素试验
参照1.3.1片段化反应条件和主产物1的HPLC含量分析方法,配制PPC和TP溶液进行不同条件下的片段化反应,以产物1含量作为评价指标,分别考察不同温度 (50~90 ℃)、时间 (30~150 min)、盐酸质量分数 (0.1%~5%) 和PPC/TP (质量比1∶3~3∶1) 对产物1生成的影响,每组实验重复3次,以确定各因素的适宜范围。
1.3.3响应面试验
在单因素试验结果的基础上,采用Design-Expert V8.0.6软件,依据中心组合设计原理,以反应温度 (A)、反应时间 (B)、盐酸质量分数 (C) 和PPC/TP (D) 4因素为自变量,片段化主产物1质量浓度 (Y) 为响应值,每因素取5水平以-2,-1,0,1,2为编码 (如表1)。试验设计方案如表2,共30个试验点 (含6个中心点),各点随机顺序进行并重复3次,运用软件对数据进行分析,建立数学模型,以确定云南松树皮PPC片段化的最佳反应条件。

表1 中心组合设计因素水平编码Table 1 Factor level of central composite design
1.3.4验证试验
按照1.3.3响应面试验所得的最佳片段化条件进行3次重复试验,通过测定所得片段化主产物1的实际含量与回归模型所得产物1质量浓度的理论预测值进行比较,以验证响应面法试验参数是否准确可靠。
2 结果与分析
2.1 单因素试验
不同反应温度、反应时间、盐酸浓度和PPC/TP对主产物1生成的影响结果见图2。由图2a可知,片段化产物1的质量浓度在50~60 ℃内,随着温度的升高而升高,在60 ℃时达到最大值,之后,随着温度的升高,片段化产物1的质量浓度急剧下降,故选择温度60 ℃为宜。由图2b可知,片段化产物1的质量浓度在30~90 min内,随着反应时间的延长而不断增加,当反应时间超过90 min时,片段化产物1的质量浓度随着时间的延长而缓慢下降,故选择反应时间90 min为宜。从图2c可知,片段化产物1质量浓度在盐酸浓度为0.1%~2%,随着盐酸浓度的增加而增加,当盐酸浓度达到2%时片段化产物1质量浓度达到最大值,故选择盐酸质量分数为2%为宜。从图2d可知,PPC/TP为1∶3~1∶2时,片段化产物1的质量浓度呈急剧增长趋势;当PPC/TP为1∶2时,片段化产物1的质量浓度达到最大值,故选择PPC/TP在1∶2为宜。
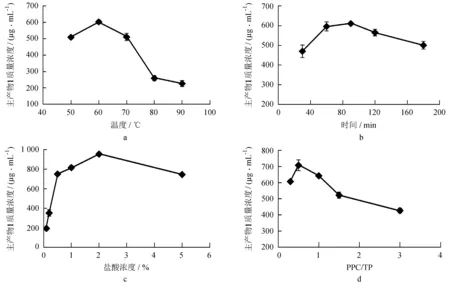
图24种因素对主产物1质量浓度的影响
Fig.2 Effects of 4 factors on the concentration of the principal product1
2.2 响应面分析
2.2.1响应面试验
4因素5水平中心组合响应面实验结果如表2。
2.2.2回归模型建立及显著性检测
经回归拟合后,回归模型方差分析结果如表3。实验因子对响应值的影响可用回归方程表示:
Y=761.75+31.95A+2.01B+6.00C-56.57D-74.76AB-111.47AC+8.16AD-24.33BC-11.58BD-8.59CD-93.66A2-4.81B2-31.75C2+8.62D2。

表2 中心组合试验方案及结果Table 2 Central composite design matrix and experimental results

表3 回归模型方差分析Table 3 Variance analysis of the regression model
注:*为差异显著(P< 0.05);**为差异极显著 (P< 0.01)。

2.2.3双因素交互作用
图3直观地反映了各因素以及相互之间对响应值的影响。反应温度对响应值的影响作用显著 (P=0.015 7),当其他因素不变时,片段化产物1的质量浓度与温度呈正比关系如图3a、3b、3c。PPC/TP质量比对响应值的影响作用极显著 (P=0.001 2),其他因素不变时,片段化产物1质量浓度与PPC/TP质量比呈反比关系 (图3c, 3e, 3f),温度和时间对响应值的相互影响作用极显著 (P=0.000 1)。

图3片段化主产物1质量浓度的响应面立体分析和等高线图
Fig.3 Response surface and contour for the interactive effects on different factors of product1
由图3a可看出,当时间不变时,随着温度的升高,片段化产物1的质量浓度不断增加,最后呈水平趋势,当温度不变时,随着时间的增长,片段化产物1的质量浓度显著增加;温度和盐酸质量分数对响应值的相互影响作用极显著 (P< 0.01)。由图3b可看出,当盐酸质量分数不变时,随着温度的升高,片段化产物1的质量浓度不断增加,最后趋于稳定,当温度不变时,随着盐酸质量分数的升高,片段化产物1质量浓度显著增加 (P< 0.05)。由图3d可看出,片段化产物1的质量浓度随着时间的增加而增加,随着盐酸浓度的升高而升高。
2.2.4最佳工艺条件及验证
采用由Design-Expert V8.0.6统计软件对试验数据进行回归分析,得到片段化最佳反应条件为:反应温度51 ℃、反应时间120 min、盐酸质量分数3%、PPC/TP质量比为1∶1。为验证该优化条件的可靠性,采用上述条件进行片段化反应,试验重复3次,得到片段化主产物1的平均实际质量浓度为861.897 μg/mL,与理论预测值(864.664 μg/mL)较为接近,实测含量与预测含量相对误差仅为0.32%,说明响应面法优化所得的模型参数准确可靠。
3 结 论
本研究通过单因素试验结合响应面法对基于茶多酚的云南松树皮多聚原花青素片段化反应条件进行了分析优化,发现片段化主产物1生成量的影响因素顺序为:PPC/TP > 反应温度 > 盐酸浓度 > 反应时间。云南松树皮PPC片段化的最佳反应条件为:反应温度51 ℃、反应时间120 min、盐酸质量分数3%、PPC/TP质量比1∶1。采用上述条件进行验证试验,结果发现片段化主产物1的实际质量浓度为861.897 μg/mL,与理论预测值较为接近,说明采用响应面法优化云南松树皮PPC片段化反应条件方法可行。对云南松树皮PPC、思茅松树皮PPC[18]和白花木瓜PPC[19]片段化反应中主产物1生成量的4个影响因素的主次关系进行分析比较,发现PPC/TP对主产物1生成影响均为最大,反应温度或盐酸质量分数次之,而反应时间对1主产物生成影响最小。从上述3种不同来源PPC片段化主产物1质量浓度来看,云南松树皮PPC片段化反应所得主产物1质量浓度最高,思茅松树皮PPC次之 (718.570 μg/mL),白花木瓜PPC最低 (601.093 μg/mL),其质量浓度高低可能是由于不同来源PPC的化学组成和纯度存在差异所致。研究结果将为云南松树皮PPC片段化产物进一步的开发利用提供科学依据。
[1] Rohdewald P. A review of the French maritime pine bark extract (Pycnogenol), a herbal medication with a diverse clinical pharmacology[J]. International Journal of Clinical Pharmacology and Therapeutics, 2002, 40(4): 158-168.
[2] Cos P, de Bruyne T, Hermans N, et al. Proanthocyanidins in health care: current and new trends[J]. Current Medicinal Chemistry,2004,11(10): 1345-1359.
[3] Kim D S, Kim M S, Kang S W, et al. Pine bark extract enzogenol attenuated tumor necrosis factor-a-induced endothelial cell adhesion and monocyte transmigration[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 7088-7095.
[4] Ignat I, Volf I, Popa V I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J]. Food Chemistry, 2011, 126(4): 1821-1835.
[5] Yi J J, Wang Z Y, Bai H N, et al. Optimization of purification, identification and evaluation of theinvitroantitumor activity of polyphenols fromPinuskoraiensispinecones[J]. Molecules, 2015, 20(6): 10450-10467.
[6] Lotito S B, Actis-Goretta L, Renart M L, et al. Influence of oligomer chain length on the antioxidant activity of procyanidins[J]. Biochemical and Biophysical Research Communications, 2000, 276(3): 945-951.
[7] Ursini F, Rapuzzi I, Toniolo R, et al. Characterization of antioxidant effect of procyanidins[J]. Method Enzymology, 2001, 335: 338-350.
[8] 孙芸, 徐宝才, 谷文英, 等. 葡萄籽原花青素的聚合度与抗氧化活性关系[J]. 食品与发酵工业, 2006, 32(10): 41-46.
[9] Erlejman A G, Verstraeten S V, Fraga C G, et al. The interaction of flavonoids with membranes: potential determinant of flavonoid antioxidant effects[J]. Free Radical Research, 2004, 38(12): 1311-1320.
[10] Manach C, Donovan J L. Pharmacokinetics and metabolism of dietary flavonoids in humans[J]. Free Radical Research, 2004, 38(8): 771-785.
[11] Youdim K A, Qaiser M Z, Begley D J, et al. Flavonoid permeability across an in situ model of the blood-brain barrier[J]. Free Radical Biology and Medicine, 2004, 36(5): 592-604.
[12] 张加研, 张晓龙, 秦永剑. 云南松树皮提取物的性能研究[J]. 生物质化学工程, 2007, 41(3): 31-33.
[13] Hamauzu Y, Yasui H, Inno T, et al. Phenolic Profile, Antioxidant property, and anti-influenzaviral activity of chinese quince (PseudocydoniasinensisSchneid.), quince (CydoniaoblongaMill.), and apple (MalusdomesticaMill.) fruits[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 928-933.
[14] 姜永新, 朱宏涛, 王军民, 等. 松树皮原花青素片段化产物的LC-ESI-MS分析[J]. 林产化学与工业, 2013, 33(4): 117-120.
[15] 余小翠, 刘高峰. 响应面分析法在中药提取和制备工艺中的应用[J]. 中药材, 2010, 33(10): 1651-1655.
[16] Alberti A, Zielinski A A F, Zardo D M, et al. Optimatisation of the extraction of phenolic compounds from apples using response surface methodology[J]. Food Chemistry, 2014, 149: 151-158.
[17] Lai J, Wang H, Wang D, et al. Ultrasonic extraction of antioxidants from Chinese sumac (RhustyphinaL.) fruit using response surface methodology and their characterization[J].Molecules,2014,19(7):9019-9032.
[18] 李娜, 姜永新, 李美娟, 等. 思茅松树皮多聚原花青素降解优化[J]. 林业科学, 2017, 53(2): 110-116.
[19] 张霞, 姜力, 李娜, 等. 白花木瓜多聚原花青素降解条件优化[J]. 西南林业大学学报, 2017, 37(2): 209-215.
[20] 李娜, 但汉龙, 姜永新, 等. 松树皮多聚原花青素片段化产物的分离鉴定及活性[J]. 西部林业科学, 2015, 44(5): 76-80.
[21] 贾学静, 李乐, 丁春邦, 等. 响应面法优化微波辅助提取成熟叶老鹰茶总黄酮及其抗氧化研究[J]. 林产化学与工业, 2014, 34(3): 85-91.
