水红木果油的超声辅助提取与脂肪酸组成研究
2018-03-27杨晓琴黄元波郑云武郑志锋
杨晓琴 黄元波 郑云武 刘 灿 马 焕 郑志锋
(云南省高校生物质化学炼制与合成重点实验室;云南省生物质高效利用工程实验室;西南林业大学材料科学与工程学院,云南 昆明 650224)
随着全球煤炭、石油、天然气等不可再生能源日渐紧缺,能源压力越来越大,为了延缓不可再生能源的消耗速度和匮乏趋势,寻找可再生资源替代不可再生能源成为了当务之急。我国有着极为丰富的可再生能源资源,开发利用的潜力很大,油脂是其中重要的一类。油脂的结构中有酯基、双键等多种官能团,有利于化学改性,可转化为生物基化学品、生物基材料和生物燃料[1-6]等绿色产品。目前,市场上已有油脂基化学品实现工业化生产,如大豆油基增塑剂、大豆油基多元醇等,但由于大豆油为食用油,将其用作化工用油存在 “与人争粮争地” 的问题,因此寻找可替代其地位的其他油脂资源意义重大[7-9]。
水红木 (Viburnumcylindricum) 属忍冬科 (Capfifoliaeeae) 荚蓬属植物,分布广泛,且栽培观赏效果好,叶、树皮、花和根供药用,树皮和果实可提制栲胶,种子含油可用来制皂或点灯,若将其用于制备化工产品,可提高其附加价值[10-12]。油脂的提取方法有很多种,传统提取多采用压榨法和有机溶剂浸提法,压榨法出油率低,油品色泽不理想,油料资源综合利用率低;有机溶剂浸提法,提取时间较长,成本较高,溶剂易残留[13-14]。超声辅助提取是在提取过程中引入超声波,利用超声波对细胞的空化效应、机械效应和热效应,在较低的温度下可以促进溶剂提取过程[15-19]。本研究采用超声波辅助进行水红木果的提取,不仅可提高提取效率、节省时间,降低成本,还可为水红木果快速提取油脂提供新思路、新方法。
1 材料与方法
1.1 材料与试剂
水红木果采自云南省丽江市,除去杂质后于空气中干燥2~3 d,然后低温储存备用;乙醚、石油醚 (30~60 ℃)、正己烷均为分析纯,购自昆明盘龙华森实验设备成套部;标准脂肪酸甲酯 (油酸甲酯、亚油酸甲酯、亚麻酸甲酯、硬脂酸甲酯和棕榈酸甲酯) 样品购自Sigma-Aldrich公司;其他试剂均为分析纯,未经处理直接使用。
1.2 实验方法
1.2.1超声波辅助提取方法
采用超声波提取器SY-360进行超声波辅助法提取水红木果中的油脂,具体操作为:准确称量5.0 g经干燥的水红木果粉末置于150 mL三口烧瓶中,加入适量溶剂,装好冷凝管和温度计后置于超声波提取器中,分别设定超声功率、超声温度和超声时间,待提取结束后,滤液用旋转蒸发仪除去溶剂,于 (103 ± 2)℃烘箱中烘至恒质量,按计算提取率。
(1)
式中:Y为水红木果油提取率(%);W1为水红木果油与三口烧瓶的质量 (g);W2为三口烧瓶的质量 (g);W为干燥的水红木果粉末质量 (g)。
1.2.2提取工艺优化
首先进行单因素实验,分别探讨超声功率、超声温度和超声时间对油脂提取率的影响。然后采用正交实验 L9(33),以水红木果油提取率为评价指标,考察超声功率 (90、100、110 W)、超声温度 (45、50、55 ℃) 和超声时间 (50、60、70 min) 进一步优化超声波辅助提取水红木果油的提取工艺。
1.3 测定方法
1.3.1水红木果的理化性质测定
1) 百粒质量测定:随机选择100颗水红木果进行称量 (精确到0.01 g),重复称量3次,结果取平均值。
2) 水分及挥发物含量的测定依据GB/T 14489.1—2008 《油料 水分及挥发物含量测定》 进行;粗脂肪酸的测定依据GB/T 5512—2008 《粮油检验 粮食中粗脂肪含量测定》 进行。
1.3.2水红木果油的理化性质测定
首先对脂肪酸进行甲酯化[20],然后采用安捷伦7890A气相色谱仪 (GC) 对脂肪酸甲酯进行测定,确定水红木果油中脂肪酸的组成,色谱柱采用DB-Wax弹性石英毛细管柱 (30 m × 0.32 mm × 0.25 μm),进样量1 μL,进样口温度和检测器温度250 ℃,分流比1∶10,两段式程序升温。初始柱温200 ℃,第一段升温以20 ℃/min速率升到236 ℃,并在此温度下保持0.5 min,第二段以1 ℃/min的速率升到238 ℃,并在此温度下保持3 min;红外光谱分析 (FT-IR) 由Nicolet iS10型傅立叶变换红外光谱仪 (美国Thermo Fisher Scientific公司) 进行,采用液体涂膜法,波数从400~4 000 cm-1,扫描32次。
水红木果油的相对密度依据GB/T 5526—1985 《植物油脂检验 比重测定法》 进行,折光率依据GB 5527—2010 《植物油脂 折光指数的测定》 进行,过氧化值依据GB/T 5538—2005 《动植物油脂 过氧化值测定》 进行,酸值依据GB/T 5530—2005 《动植物油脂 酸值和酸度测定》 进行,皂化值依据GB/T 5534—2008 《动植物油脂 皂化值的测定》 进行,碘值依据GB/T 5532—2008 《动植物油脂 碘值的测定》 进行,平均相对分子质量和理论双键含量依据文献 [20] 计算。
2 结果与分析
2.1 水红木果的基本性质
水红木果的百粒质量为2.804 1 g,含水率4.65%,粗脂肪酸量为26.82%,高于现在常用的大豆,是一种含油脂较为丰富的木本油料植物,可作为生产油脂的原料树种之一。
2.2 超声辅助提取水红木果油的单因素实验
以超声辅助法提取水红木果中的油脂,分别探讨了不同的超声功率、超声温度和超声时间对油脂提取率的影响。
2.2.1超声功率的影响
分别采用无水乙醇和正己烷作溶剂,在超声温度为50 ℃的条件下超声提取60 min,考察了超声功率为40、60、80、100、120 W时对提取率的影响,结果见图1。
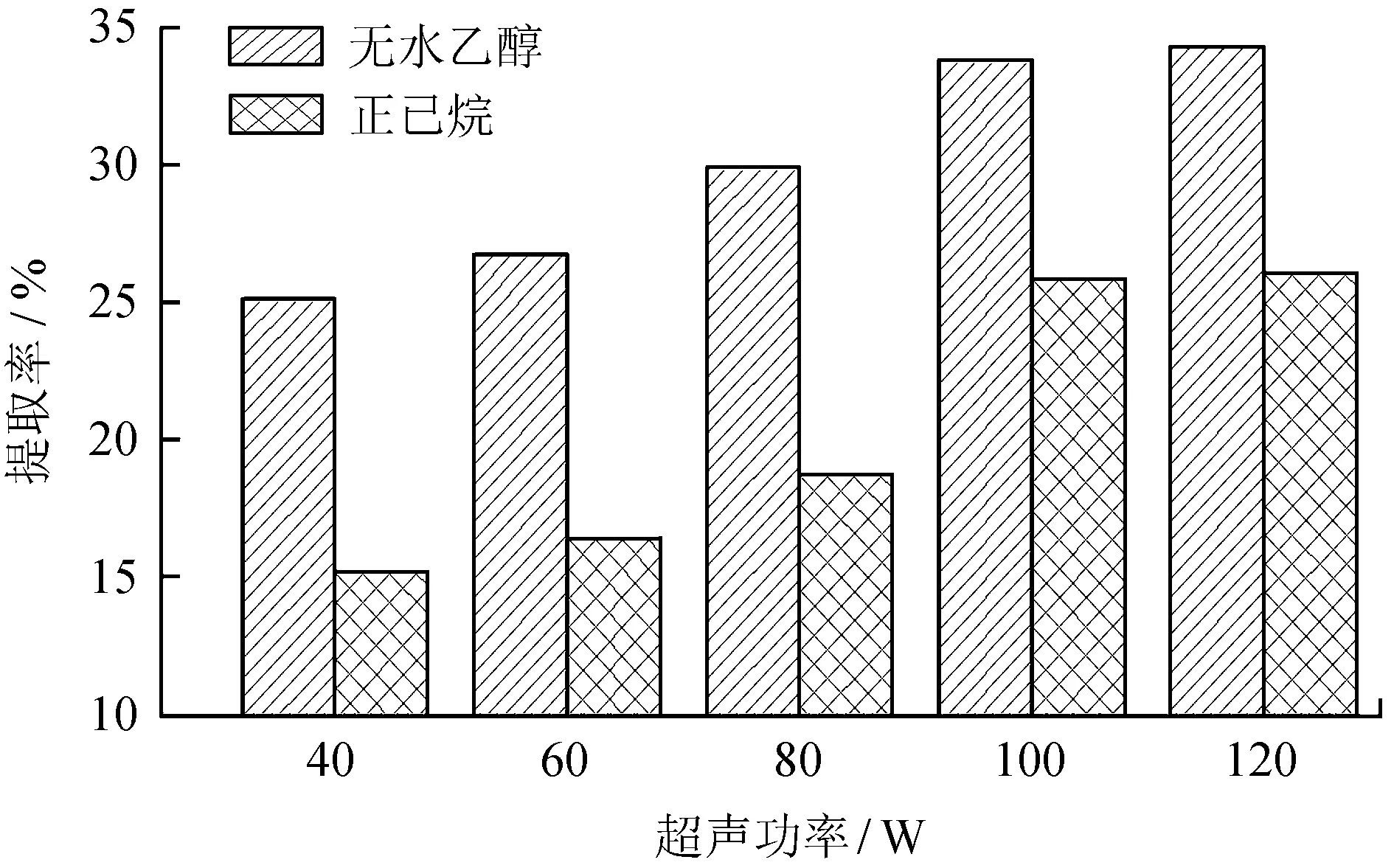
图1不同超声功率下水红木果提取率
Fig.1 Extraction rate ofV.cylindricumunder different ultrasonic power
由图1可知,油脂的提取率随着超声功率的提高呈上升趋势,当功率达到100 W和120 W时,正己烷提取油脂得率分别为25.84%和26.02%,与水红木果的粗脂肪酸含量26.82%很接近,但由于功率120 W时油脂提取率与100 W时相差不大,但能耗却高出许多,综合各个因素,选择100 W作为较佳超声功率。另一方面,相同超声功率条件下,采用无水乙醇作溶剂时油脂的得率较正己烷提取的高,主要是由于在用无水乙醇作溶剂时,除了油脂还有一部分色素也被提取出来,致使无水乙醇提取提到的产物得率高于水红木果粗脂肪酸含量。根据相关的文献报道,色素也是水红木果中比较有价值的化合物,故在余下的实验过程中继续探讨了无水乙醇作溶剂时提取条件对产物得率的影响。
2.2.2超声温度的影响
分别采用无水乙醇和正己烷作溶剂,在超声功率100 W的条件下超声提取60 min,考察了超声温度为30、35、40、45、50、55、60、70 ℃时对提取率的影响,结果见图2。
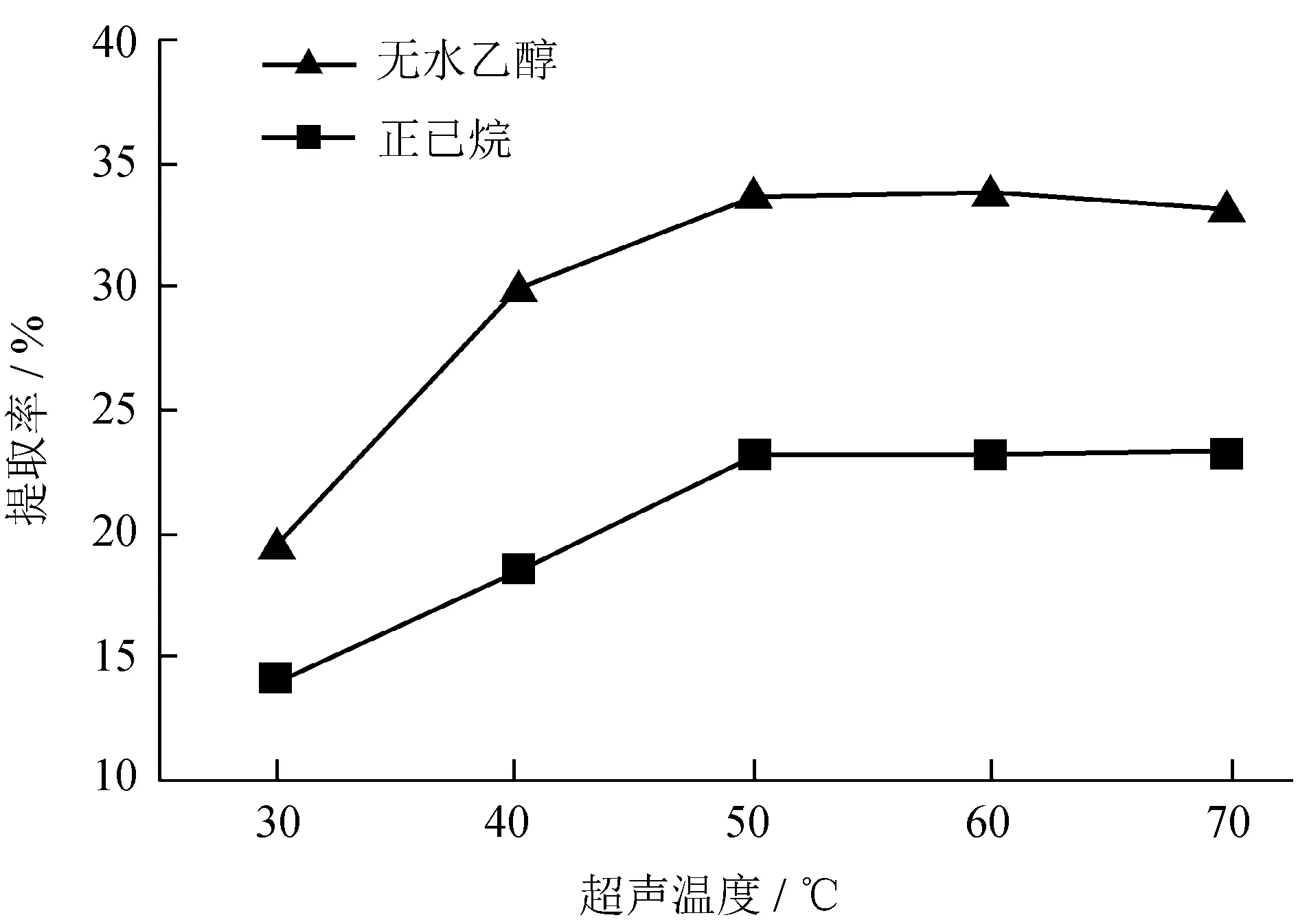
图2不同超声温度下水红木果提取率
Fig.2 Extraction rate ofV.cylindricumunder different ultrasonic temperature
由图2可知,提高温度有利于使更多的成分被提取出来,当温度达到50 ℃时产物得率最高,继续升高温度,提取率甚至有下降的趋势。一方面可能由于一些成分发生了聚合反应而在过滤过程中被除去,另一方面可能由于在过滤过程中没有将滤渣洗涤干净,使一部分提取物仍残留于滤渣中,导致提取得率有下降趋势,故选择超声温度为50 ℃作为较佳提取温度。
2.2.3超声时间的影响
分别采用无水乙醇和正己烷作溶剂,在超声功率100 W,超声温度为50 ℃的条件下超声提取一定时间,考察了超声时间为10、20、30、40、50、60、70 min时对提取得率的影响,结果见图3。

图3不同超声时间下水红木果提取率
Fig.3 Extraction rate ofV.cylindricumunder different ultrasonic time
由图3可知,提高时间对油脂提取率影响较大。当提取时间较短时,无法将油脂完全提取出来,而时间过长则消耗能量。超声时间小于30 min时,提取率随着超声时间的延长而大幅度增加,随后继续延长超声时间,油脂提取率有所增加,但增加幅度较小,超声60 min后,油脂得率不再随时间延长而继续增加,反而呈现下降趋势,主要可能是由于对残渣没有完全清洗导致产物残留而导致的,故选择超声时间为60 min较为适宜。
2.3 超声辅助提取水红木果油的正交优化实验
为进一步优化超声辅助提取水红木果油的提取条件,揭示不同提取条件对油脂得率影响的变化趋势,基于单因素实验,进行正交实验,结果见表1~2。
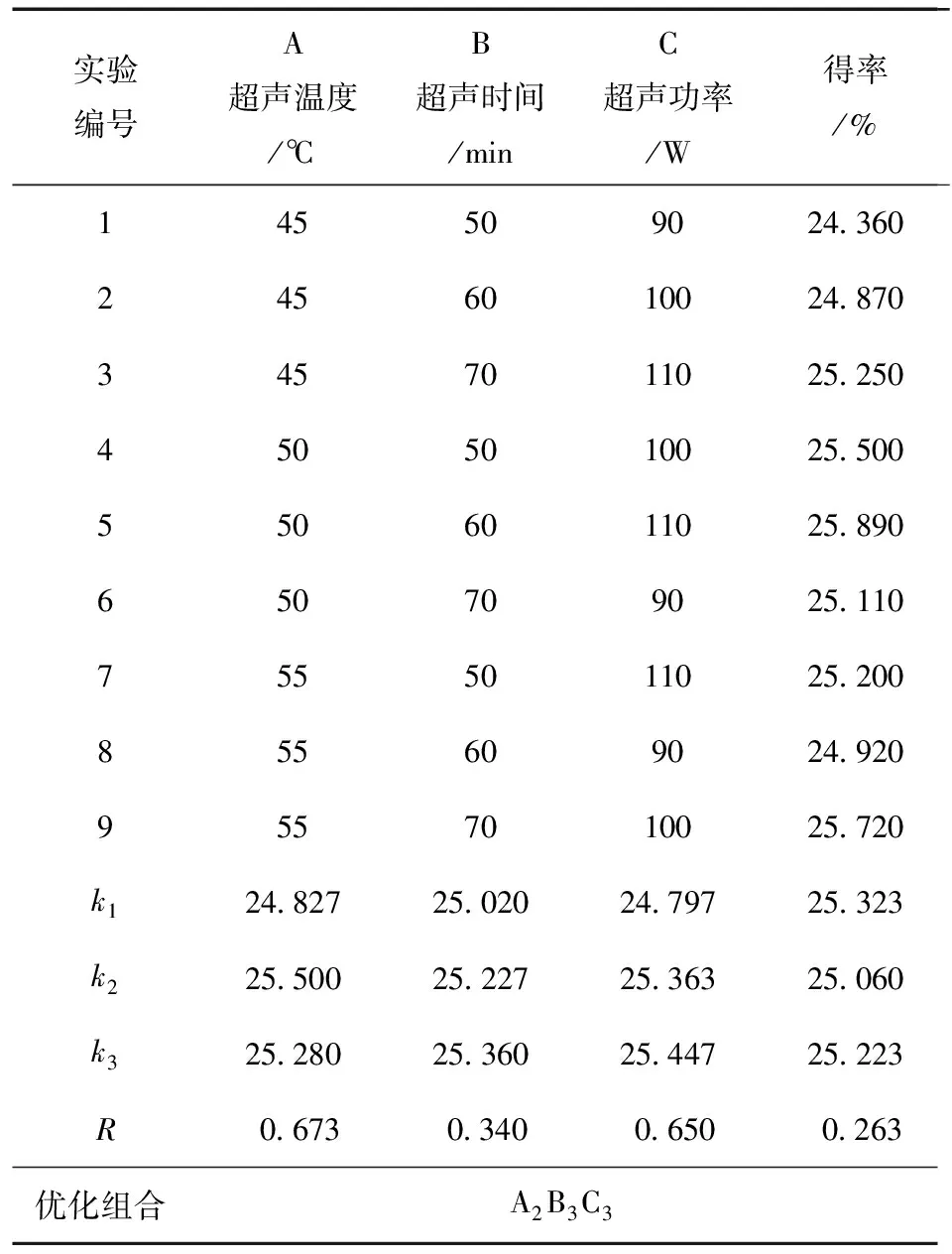
表1 正交实验设计与结果分析Table 1 Results and analysis of orthogonal test

表2 正交试验方差分析Table 2 Variance analysis of orthogonal test
由表1~2可知,不同因素对提取得率的影响不同,其中超声温度的影响最大,超声功率的影响最小,主次顺序为A > C > B,即超声温度 > 超声功率 > 超声时间。综合比较得到较佳的超声辅助提取水红木果油提取工艺为A2B3C3,即超声温度50 ℃、超声时间70 min、超声功率110 W时所得的水红木果油脂得率较高。方差分析表明,虽然3个因素均对提取得率有影响,但影响均不显著。
为验证提取条件的稳定性与可重复性,按正交优化得到的提取条件进行重复实验,其结果见表3。结果表明,该提取实验结果再现性及重复性较好。
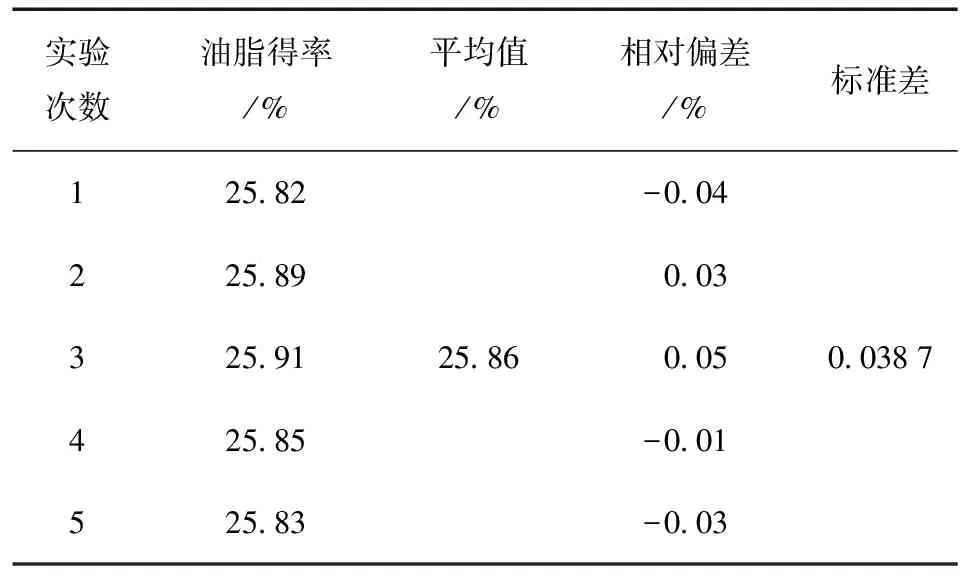
表3 重复实验结果Table 3 Reproducibility results
2.4 水红木果油的基本理化性质分析
超声波辅助下分别采用正己烷和无水乙醇对水红木果进行提取后所得产物差异较大,正己烷提取物呈淡黄色液体,无水乙醇提取物为紫红色液体。经除溶剂后,正己烷提取物为淡黄色油状液体,而无水乙醇提取物中除有少量淡黄色油状液体外还有大部分为红色固体物质,结合相关文献报道,无水乙醇提出的紫红色固体物质应为水红木果中的色素成分[21]。对正己烷提取的水红木果油进行了基本理化性质分析,并与大豆油进行了比较,结果见表4。
由表4知,水红木果油的基本理化蛋白质与大豆油[22]接近,碘值稍低,为98 g/100 g,与相关文献报道相似,为不干性油脂。经计算可知,水红木果油双键含量约为3.27C=C/100 g。水红木果油中的不饱和双键可发生加成、氧化、还原、聚合、异松化与共轭化等反应,可作为合成生物基产品的原料。
2.5 水红木果油的脂肪酸分析
水红木果油的脂肪酸组成见表5。

表4 水红木果油的基本理化参数Table 4 Basic physical and chemical parameters of V.cylindricum oil

表5 水红木果油的脂肪酸组成Table 5 Fatty acid composition of V.cylindricum oil
由表5可知,水红木果油主要由棕榈酸 (C16∶0)、硬脂酸 (C18∶0)、油酸 (C18∶1)、亚油酸 (C18∶2)、亚麻酸 (C18∶3) 等5种脂肪酸组成,其中油酸、亚油酸和亚麻酸等不饱和脂肪酸占70.23%。不饱和脂肪酸中含有大量的双键,可通过加氢、环氧化等化学修饰而得到生物基的化学中间体和化学品,水红木果中含有较多的不饱和脂肪酸,有利于进行化学修饰,可作为极佳的化工原料。
2.6 水红木果油的FTIR分析
利用红外可以定性的鉴别出物质中的特征官能团的存在。水红木果油的FTIR分析结果见图4。
图4中,3 477 cm-1处的吸收峰为-OH的伸缩振动吸收,主要是由于油脂中存在不饱和脂肪酸;3 008 cm-1的吸收峰为不饱和双键的C-H的伸缩振动,1 648 cm-1的吸收峰为C=C的伸缩振动,表明水红木果油中有不饱和C=C存在;2 940 cm-1和2 870 cm-1为饱和C-H的伸缩振动,在1 453 cm-1CH2的变形振动和CH3的反应对称变形振动,1 377 cm-1为-CH3的对称变形振动,716 cm-1为 (CH2)n的面内摇摆振动,表明在水红木果油中有较多的CH2基团;在1 739 cm-1是羰基的伸缩振动,1 239、1 161、1 106 cm-1是C-O键的伸缩振动,表明水红木果油中酯基的存在。
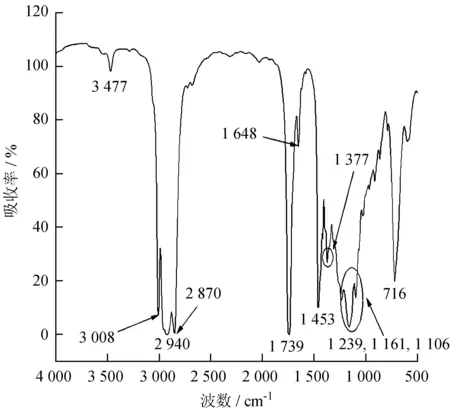
图4水木红果油的FTIR图谱
Fig.4 FTIR spectrum ofV.cylindricumoil
3 结 论
1) 对水红木果的基本分析可知,水红木果的百粒重为2.804 1 g,油脂含量较高,可达26.8%,是一种富含油脂的资源。
2) 采用超声辅助法提取水红木果中的油脂,分别探讨了不同的超声功率、超声频率、溶剂、超声温度和超声时间对产物得率的影响,结果表明,分别采用无水乙醇和正己烷作溶剂,料液比为1∶10,在超声功率为100 W,超声频率为60 Hz,超声温度为50 ℃的条件下超声提取60 min,产物的提取得率最高,正己烷提取物得率为23.14%,无水乙醇提取物得率为33.76%。
3) 对水红木果提取产物进行分析表明,正己烷提取物为淡黄色油状液体,主要由5种脂肪酸组成,其中不饱和脂肪酸占70.23%,表明水红木果中含有较多的不饱和脂肪酸,有利于进行化学修饰,可作为极佳的化工原料。
[1] Alagi P, Hong S C. Vege Table oil-based polyols for sustainable polyurethanes[J]. Macromolecular Research, 2015, 23(12): 1079-1086.
[2] Rodríguez-Gómez J E, Silva-Reynoso Y Q, Varela-Guerrero V, et al. Development of a process using waste vege Table oil for separation of aluminum and polyethylene from Tetra Pak[J]. Fuel, 2015, 149: 90-94.
[3] Rafiq M, Lv Y Z, Zhou Y, et al. Use of vege Table oils as transformer oils-a review[J]. Renewable & Sustainable Energy Reviews, 2015, 52: 308-324.
[4] Zoran S. Petrovic'. Polyurethanes from vege Table oils[J]. Polymer Reviews, 2008, 48(1): 109-155.
[5] Luo Q, Liu M, Xu Y, et al. Thermosetting allyl resins derived from soybean oil[J]. Journal of Applied Polymer Science, 2011, 127(1): 7149-7157.
[6] Z. S. Petrovic', I. Cvetkovic'. Vege Table oil-based hyperbranched polyols in flexible foams[J]. Contemporary Materials, 2012, 1(3): 63-71.
[7] 郝敬颖, 朱姝, 李玉松. 植物油多元醇的制备及其在聚氨酯硬泡中的应用[J]. 聚氨酯工业, 2016(1): 44-46.
[8] 钱伯章. 从植物油生产可再生柴油和生物丙烷[J]. 石油炼制与化工, 2015, 46(2): 48.
[9] 黄元波, 王家强, 顾继友, 等. 环氧植物油合成研究进展[J]. 林产化学与工业, 2013, 33(5): 115-120.
[10] Zhu X D, Wang Q, Wang Y F, et al. Two new phenolic glycosides fromViburnumcylindricum(Caprifoliaceae) [J]. Acta Botanica Yunnaniea, 2006, 8(1): 91-94.
[11] 李防. 野生植物水红木 (ViburnumcylindricumBuch. Ham. ex D. Don) 营养成分的分析[J]. 青岛科技大学学报 (自然科学版), 2007, 28(2): 115-117.
[12] 杨发忠, 付惠, 杨德强, 等. 水红木油理化特性及成分分析[J]. 中国油脂, 2009, 34(11): 74-77.
[13] 朱英莲. 南瓜籽油提取工艺优化及油脂氧化稳定性研究[J]. 粮食与油脂, 2015(1): 24-26.
[14] 朱振宝, 刘旷, 易建华, 等. 3种不同方法提取大扁杏仁油脂性质比较[J]. 中国粮油学报, 2015, 30(2): 57-60.
[15] 刘柏华, 殷钟意, 郑旭煦. 超声波辅助提取牡丹籽粕中油脂的工艺研究[J]. 食品研究与开发, 2016, 37(8): 40-44.
[16] 严伟, 李淑芬, 田松江. 超声波协助提取技术[J]. 化工进展 , 2002, 21(9): 649-651.
[17] 黎冬明, 上官新晨, 杨武英, 等. 超声波辅助提取玫瑰茄籽油工艺的研究[J]. 粮油加工,2010(11): 20-23.
[18] 刘祝祥, 陈功锡, 欧阳姝敏, 等. 华榛种仁油提取及GC-MS分析[J]. 中国油脂, 2011, 36(9): 14-17.
[19] 单成俊, 周剑忠, 黄开红, 等. 超声波辅助提取黑莓籽油及其脂肪酸组成分析[J]. 中国粮油学报, 2010, 25(5): 62-64.
[20] Yang X Q, Pan H, Zeng T, et al. Extraction and characterization of seed oil from naturally grown Chinese tallow trees[J]. Journal of the American Oil Chemists Society, 2013, 90(3): 459-466.
[21] 马银海, 彭永芳, 王飞. 用树脂法提取水红木果色素的研究[J]. 食品科学, 2006, 27(3): 93-95.
[22] 于殿宇, 陈晓慧, 宋云花, 等. 转基因和非转基因大豆油理化性质比较研究[J]. 东北农业大学学报, 2012, 43(11): 1-6.
