红花醌苷对心肌缺血再灌注大鼠心肌细胞凋亡的影响
2018-03-27
(1 济源市第二人民医院心血管内科,河南 济源 459000; 2 中国医学科学院阜外医院心血管内科)
急性心肌梗死已成为当今威胁人类健康的两大主要杀手之一,而心肌缺血损伤和心肌缺血再灌注损伤是导致急性心肌梗死致死、致残的主要病因。心肌组织缺血再灌注后可以引起心肌结构破坏、心肌细胞死亡,甚至可以导致梗死范围扩大,其损伤机制包括氧自由基的产生、中性粒细胞的浸润及促炎因子的释放等等[1-4]。目前研究表明,心肌细胞也存在凋亡现象,细胞凋亡在缺血再灌注心肌损伤的发生机制中扮演着重要的角色。细胞凋亡的发生受到细胞内凋亡调节蛋白的调控,B淋巴细胞瘤-2基因(Bcl-2)蛋白、Bcl-2相关X蛋白(Bax)和含半胱氨酸的天冬氨酸蛋白水解酶(Caspase 3)蛋白的比例失衡即会导致细胞凋亡[5-11]。现代药理学研究显示,红花及其活性成分具有抗凝血、抗氧化、镇痛以及抗炎等活性,被用于心脑血管等疾病的治疗[12-13]。红花中主要含醌式查尔酮碳苷类化合物、黄酮类化合物、多炔、烷基二醇、有机酸以及芳香苷等化学成分,其中,醌式查尔酮碳苷类化合物由于含有醌式查尔酮的结构,被认为是其最重要活性成分之一[14-15]。本研究通过建立大鼠心肌缺血再灌注模型,评价红花醌苷对心肌缺血再灌注的保护作用,并对其相关机制进行探讨。
1 材料与方法
1.1 材料来源
红花醌苷由本实验室前期提取和保存;SPF级SD大鼠50只,购自上海加科生物科技有限公司。
1.2 试剂与仪器
TUNEL检测试剂盒购自Roche公司;mRNA提取试剂盒购自Invitrogen公司;逆转录PCR试剂盒购自TAKARA公司;蛋白抽提试剂盒、BCA蛋白测定试剂盒购自碧云天生物科技有限公司;兔抗Bcl-2、Bax、Caspase 3和GAPDH多克隆抗体购自美国Abcam公司;HRP标记单克隆抗体购自美国Cell Signaling公司;倒置显微镜购自日本Olympus公司;PCR仪购自日本TAKARA公司。
1.3 实验方法
1.3.1心肌缺血再灌注大鼠模型的建立及其处理大鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉,背位固定在手术台上;以体积分数0.75的乙醇消毒后,经颈部中央气管切开置管,连接小动物呼吸机控制呼吸;于胸骨左缘第3、4肋间开胸,小心提起心包并剪开,轻压右侧胸腔,充分暴露心脏;在左心耳与肺动脉圆锥间前降支下2 mm处使用6-0无损伤缝线环绕冠状动脉,将结扎线从一根聚乙稀小管中穿出,拉紧形成闭环造成缺血,缺血40 min后,松解结扎线,即发生再灌注,时间120 min。其中,假手术组大鼠只穿线不结扎冠状动脉。建模成功后,将大鼠随机分为模型组及红花醌苷低、中、高剂量组。红花醌苷低、中、高剂量组大鼠分别给予25、50和100 mg/kg的红花醌苷腹腔注射,假手术组和模型组大鼠给予等体积的生理盐水注射,连续7 d。
1.3.2TUNEL方法检测心肌细胞的凋亡情况 取各组大鼠心脏组织,于40 g/L多聚甲醛中固定,脱水、浸蜡,制备蜡块标本并切片;二甲苯脱蜡,梯度乙醇水化;PBS洗涤,每次3 min;加入0.1 mol/L枸橼酸缓冲液,微波辐照进行抗原修复;PBS洗涤,每次3 min;BSA温孵育30 min,封闭特异性抗原;PBS洗涤,每次3 min;滴加50 μL TUNEL反应混合液,37 ℃孵育1 h;PBS洗涤,每次3 min;滴加体积分数0.03的H2O2,室温下孵育10 min;PBS洗涤,每次3 min;滴加50 μL转化剂POD,37 ℃培养箱孵育30 min;PBS洗涤,每次3 min;滴加100 μL DAB显色液;自来水冲洗,苏木素淡染,常规脱水、透明、封片;荧光显微镜观察,凋亡细胞的细胞核呈深浅不一的棕褐色,正常细胞的细胞核呈蓝色。采用Motic Images Advanced 3.2图像分析软件对结果进行分析,灰度值越大阳性越低,灰度值越小阳性越高。
1.3.3RT-qPCR法检测心肌组织中Bcl-2、Bax以及Caspase 3 mRNA的水平 取100 mg的心肌组织,加入1 mL Trizol;玻璃匀浆器充分匀浆后,室温静置5 min;将悬液转移至1.5 mL Eppendorf管中;加入200 μL氯仿,振荡混匀15 s;4 ℃下12 000 r/min离心15 min;将上层水相转移至另一个1.5 mL Eppendorf管中,加入等体积异丙醇,振荡混匀15 s,室温下静置10 min;4 ℃下12 000 r/min,离心15 min;弃上清液,用1 mL预冷的体积分数0.75的乙醇洗涤沉淀;4 ℃下7 500 r/min离心5 min;弃上清液,室温下干燥5 min;加DEPC水30 μL溶解,进行纯度以及浓度检测;采用逆转录试剂盒进行cDNA的转录。设计Bcl-2、Bax以及Caspase 3的引物,同时以β-actin作为内参照,引物序列如下:Bax-F:5′-TAGCCACAGTGTTGTAAGC-3′,Bax-R:5′-TCTGATCCGTCTCAATAGTC-3′;Bcl-2-F:5′-TTGCTTGGCTGGTTCTAC-3′,Bcl-R:5′-TCTATGCCCTACCTATGAG-3′;Caspase-3-F:5′-T-CCTCGTTTCCGTGTTTG-3′,Caspase-3-R:5′-C-AGGGCATCTCCACTTTG-3′;β-actin-F:5′-TTG-TGCCTTGATAGTTCGC-3′,β-actin-R:5′-GGAG-TCCTTCTGACCCATAC-3′。反应条件为:94 ℃,3 min;95 ℃,20 s;56 ℃,20 s;72℃,30 s,共35个循环。读取数据,计算相对值。
1.3.4Western Blot法检测心肌组织中Bcl-2、Bax和Caspase 3蛋白的水平 取100 mg心肌组织,眼科剪剪碎;加入1 mL裂解液,冰浴条件下进行匀浆,冰上静置30 min后,将匀浆液转移至1.5 mL Eppendorf管中,4 ℃下12 000 r/min离心5 min;取上清液,采用BCA蛋白检测试剂盒测定总蛋白含量;取蛋白样品,加入1/4体积5×loading buffer,沸水煮5~10 min;然后上样进行SDS-PAGE电泳;电泳结束以后转移至PVDF膜上;取出PVDF膜,50 g/L BSA室温封闭1 h;PBST洗涤,每次5 min;分别加入稀释后的兔抗Bcl-2、Bax和Caspase 3多克隆抗体,4 ℃孵育过夜;PBST洗涤,每次5 min;加入HRP标记单克隆抗体,37 ℃孵育1 h;PBST洗涤,每次为5 min;取ECL超敏发光液A、B各300 μL,充分混匀后均匀滴到PVDF膜上,覆盖保鲜膜;凝胶成像仪曝光保存蛋白条带图像,以GAPDH作为内参照,分析软件测量目的条带和内参照条带的灰度值,以比值作为蛋白质相对表达水平。
2 结 果
2.1 各组大鼠心肌细胞凋亡变化
TUNEL分析结果显示,假手术组、模型组以及红花醌苷低、中、高剂量组大鼠心肌细胞凋亡指数分别为(4.12±0.18)%、(57.12±8.09)%、(48.32±7.01)%、(36.19±6.41)%和(21.37±5.38)%。假手术组大鼠心肌组织中可见本底水平细胞凋亡现象,模型组与红花醌苷低、中、高剂量组大鼠心肌组织中可见大量细胞凋亡现象,与假手术组比较,差异具有统计学意义(P<0.05);与模型组比较,红花醌苷低、中、高剂量组心肌组织中细胞凋亡水平显著下降(P<0.05),且细胞凋亡改善情况呈剂量依赖性。
2.2 各组大鼠心肌细胞中Bcl-2、Bax和Caspase 3 mRNA水平变化
RT-qPCR检测结果显示,与假手术组比较,模型组及红花醌苷低、中、高剂量组大鼠心肌组织中Bax以及Caspase 3 mRNA的水平显著升高,Bcl-2 mRNA水平显著下降(P<0.05);与模型组比较,红花醌苷低、中、高剂量组大鼠心肌组织中Bax和Caspase 3 mRNA水平下降,Bcl-2 mRNA水平升高(P<0.05),且变化趋势呈剂量依赖性。见表1。
2.3 各组大鼠心肌细胞中Bcl-2、Bax和Caspase 3蛋白水平变化
Western Blot检测结果显示,与假手术组比较,模型组及红花醌苷低、中、高剂量组大鼠心肌组织中Bax和Caspase 3蛋白的水平显著升高,Bcl-2蛋白水平显著下降(P<0.05);与模型组比较,红花醌苷低、中、高剂量组大鼠心肌组织中Bax和Caspase 3蛋白的水平显著下降,而Bcl-2蛋白水平显著升高(P<0.05),且变化趋势呈剂量依赖性。见表2。
3 讨 论
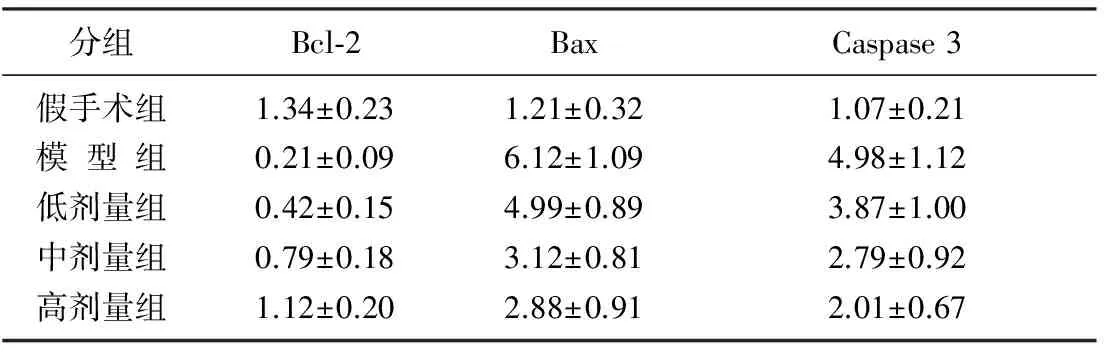
分组Bcl⁃2BaxCaspase3假手术组1.34±0.231.21±0.321.07±0.21模型组0.21±0.096.12±1.094.98±1.12低剂量组0.42±0.154.99±0.893.87±1.00中剂量组0.79±0.183.12±0.812.79±0.92高剂量组1.12±0.202.88±0.912.01±0.67
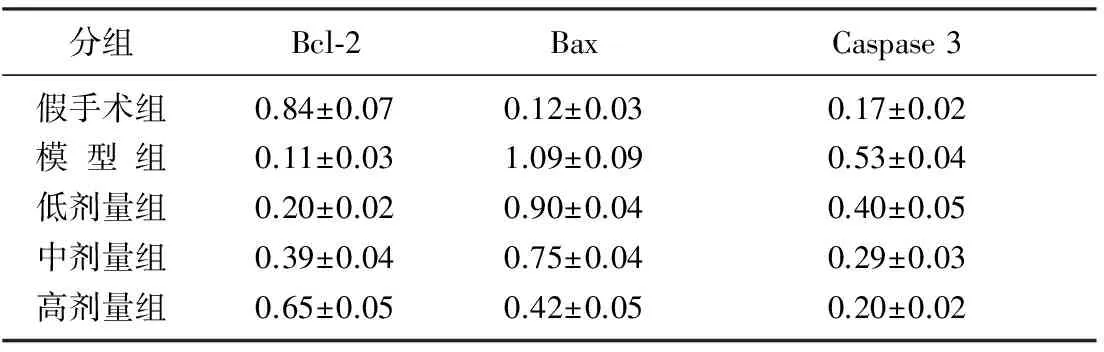
分组Bcl⁃2BaxCaspase3假手术组0.84±0.070.12±0.030.17±0.02模型组0.11±0.031.09±0.090.53±0.04低剂量组0.20±0.020.90±0.040.40±0.05中剂量组0.39±0.040.75±0.040.29±0.03高剂量组0.65±0.050.42±0.050.20±0.02
心肌缺血再灌注后,缺血心肌组织细胞的超微结构明显改变,细胞代谢、功能明显下降,导致病情更加恶化,甚至不可逆转,由此产生的病理生理过程,即为缺血再灌注损伤[16-18]。细胞凋亡在心肌缺血再灌注损伤中的作用越来越被关注,成为心肌缺血再灌注损伤研究的重要方向。现有研究表明,缺血再灌注损伤的机制包括细胞凋亡、氧化应激及炎症反应等,其中心肌细胞凋亡是其重要的病理生理环节之一[19-21]。
Caspase家族是细胞凋亡的介导者以及执行者,Caspase 3处于凋亡有序级联反应的下游,是家族中的最重要的凋亡执行者之一,是多种凋亡刺激信号传递的汇聚点,Caspase 3参与了绝大多数哺乳动物细胞的凋亡过程[22-25]。Bcl-2蛋白家族是重要的细胞凋亡调控因子,该家族可以分为两大类,一类是以Bcl-2为代表的凋亡抑制因子,一类是以Bax为代表的促凋亡因子,Bcl-2和Bax是在功能上相互对立的凋亡调控因子,在正常生理情况下,Bcl-2和Bax处于平衡状态,一旦机体受损产生应激反应时,Bcl-2/Bax比例失衡,尤其是Bax水平会显著升高,导致细胞凋亡现象加剧[26-28]。本研究通过建立大鼠心肌缺血再灌注模型,采用TUNEL、RT-qPCR以及Western Blot手段检测模型大鼠心肌组织细胞凋亡水平以及Bcl-2、Bax以及Caspase 3表达水平的变化,结果显示,心肌缺血再灌注大鼠心肌组织出现明显的细胞凋亡现象,促凋亡相关因子Bax和Caspase 3表达水平显著上升,凋亡抑制因子Bcl-2表达水平显著下降。说明,心肌缺血再灌注损伤激活了机体细胞凋亡信号通路。
红花有多种药理活性作用,在临床实践中,其已成为预防和治疗冠心病、心肌梗死以及脑血栓等疾病的重要中药。研究显示其对脑梗死动物的脑组织有保护作用[29]。但是,作为红花重要活性成分之一的红花醌苷即醌式查尔酮碳苷类化合物,对其在心肌方面的药理作用尚未有相关报道,本研究采用红花醌苷对心肌缺血再灌注大鼠进行治疗,结果显示,红花醌苷能够显著降低心肌缺血再灌注大鼠心肌细胞的凋亡水平,下调Bax和Caspase 3表达水平,上调Bcl-2表达水平,且红花醌苷的调控作用呈剂量依赖性。因此,红花醌苷可能通过抑制Caspase家族细胞凋亡信号通路,调节Bcl-2蛋白家族Bcl-2/Bax比例,进而抑制心肌缺血再灌注损伤导致的细胞凋亡。
[1] XUE Q, PEI H, LIU Q, et al. MICU1 protects against myocardial ischemia/reperfusion injury and its control by the importer receptor Tom70[J]. Cell Death Dis, 2017,8(7):e2923.
[2] WANG Z, WU G, LIU H, et al. Cardioprotective effect of the xanthones from Gentianella acuta against myocardial ischemia/reperfusion injury in isolated rat heart[J]. Biomed Pharmacother, 2017,93:626-635.
[3] 徐盟. 心肌缺血再灌注损伤的主要机制与相关药物治疗的研究进展[J]. 实用药物与临床, 2014,12(8):1052-1056.
[4] LIU X M, YANG Z M, LIU X K. Fas/FasL induces myocardial cell apoptosis in myocardial ischemia-reperfusion rat model[J]. Eur Rev Med Pharmacol Sci, 2017,21(12):2913-2918.
[5] CHEN L, CAI P, CHENG Z, et al. Pharmacological postconditioning with atorvastatin calcium attenuates myocardial ischemia/reperfusion injury in diabetic rats by phosphorylating GSK3β[J]. Exp Ther Med, 2017,14(1):25-34.
[6] CHUN N, HADDADIN A S, LIU J, et al. Activation of complement factor B contributes to murine and human myocardial ischemia/reperfusion injury[J]. PLoS One, 2017,12(6):e0179450.
[7] LIU Y, JIANG H, ZHOU H, et al. Lentivirus-mediated silencing of HOTAIR lncRNA restores gefitinib sensitivity by activating Bax/Caspase-3 and suppressing TGF-α/EGFR signaling in lung adenocarcinoma[J]. Oncol Lett, 2018,15(3):2829-2838.
[8] HE X, SUN J, HUANG X. Expression of caspase-3, Bax and Bcl-2 in hippocampus of rats with diabetes and subarachnoid hemorrhage[J]. Exp Ther Med, 2018,15(1):873-877.
[9] JIN S J, YANG Y, MA L, et al. In vivo and in vitro induction of the apoptotic effects of oxysophoridine on colorectal cancer cells via the Bcl-2/Bax/caspase-3 signaling pathway[J]. Oncol Lett, 2017,14(6):8000-8006.
[10] 王俊东,崔勇,王建国, 等.人参皂苷Rh3预处理对大鼠心肌缺血再灌注损伤大鼠心肌组织中caspase-3的作用[J]. 长春中医药大学学报, 2017,33(1):13-15.
[11] 于丽芳,周大亮,耿硕, 等.曲美他嗪对心肌缺血再灌注损伤后大鼠Bcl-2及caspase-3蛋白表达影响[J]. 中华实用诊断与治疗杂志, 2015,29(9):855-857,861.
[12] 刘莉.红花的研究概述[J]. 广州化工, 2017(12):23-25,68.
[13] 扈晓佳,殷莎,袁婷婷, 等.红花的化学成分及其药理活性研究进展[J]. 药学实践杂志, 2013,31(3):161-168,197.
[14] 廖晖,梁红萍,武晋. 红花的抗氧化活性及对α-葡萄糖苷酶的作用研究[J]. 时珍国医国药, 2013,24(9):2131-2133.
[15] 乐世俊,唐于平,王林艳,等. 红花中黄酮类化合物的分离与体外抗氧化研究[J]. 中国中药杂志, 2014,39(17):3295-3300.
[16] 原大江,郝家荣,郭政. 线粒体ATP敏感性钾通道在降钙素基因相关肽减轻大鼠心肌缺血再灌注损伤中的作用:离体实验[J]. 中华麻醉学杂志, 2017,37(6):744-747.
[17] 叶明,吴辉. 心肌缺血再灌注损伤的研究新进展[J]. 中华老年心脑血管病杂志, 2016,18(4):434-437.
[18] 李冬,史大卓,刘秀华. 线粒体功能障碍与心肌缺血再灌注损伤[J]. 中华老年心脑血管病杂志, 2014,16(3):318-321.
[19] MU F, DUAN J, BIAN H, et al. Cardioprotective effects and mechanism of Radix Salviae miltiorrhizae and Lignum Dalbergiae odoriferae on rat myocardial ischemia/reperfusion injury[J]. Mol Med Rep, 2017,16(2):1759-1770.
[20] LIM S H. Larch arabinogalactan attenuates myocardial injury by inhibiting apoptotic cascades in a rat model of ischemia-reperfusion[J]. J Med Food, 2017, 20(7):691-699.
[21] SUN X, WANG W, DAI J, et al. A long-term and slow-releasing hydrogen sulfide donor protects against myocardial ischemia/reperfusion injury[J]. Sci Rep, 2017,7(1):3541.
[22] HE S, WANG X, CHEN A. Myocardial ischemia/reperfusion injury: the role of adaptor proteins Crk[J]. Perfusion, 2017,32(5):345-349.
[23] ZHOU T, GUO S, WANG S, et al. Protective effect of sevoflurane on myocardial ischemia-reperfusion injury in rat hearts and its impact on HIF-1α and caspase-3 expression[J]. Exp Ther Med, 2017,4(5):4307-4311.
[24] KHAFAGA A F, EL-SAYED Y S. All-trans-retinoic acid ameliorates doxorubicin-induced cardiotoxicity: In vivo potential involvement of oxidative stress, inflammation, and apoptosis via caspase-3 and p53 down-expression[J]. Naunyn Schmiedebergs Arch Pharmacol, 2018, 391(1):59-70.
[25] RAVINDRAN S, KURIAN G A. The role of secretory phospholipases as therapeutic targets for the treatment of myocardial ischemia reperfusion injury[J]. Biomed Pharmacother, 2017, 92:7-16.
[26] RAVINDRAN S, JAHIR HUSSAIN S, BOOVARAHAN S R, et al. Sodium thiosulfate post-conditioning protects rat hearts against ischemia reperfusion injury via reduction of apoptosis and oxidative stress[J]. Chem Biol Interact, 2017,274:24-34.
[27] 熊年,韦晟. 银杏内酯B对大鼠心肌缺血再灌注损伤的保护作用及机制研究[J]. 中国现代应用药学, 2015,32(3):289-294.
[28] WANG Y, ZHANG H, CHAI F, et al. The effects of escitalopram on myocardial apoptosis and the expression of Bax and Bcl-2 duringmyocardial ischemia/reperfusion in a model of rats with depression[J]. BMC Psychiatry, 2014,14:349.
[29] 李淑景.红花注射液联合高压氧治疗急性脑梗塞的疗效分析[J]. 临床医药文献电子杂志, 2016,3(10):1965-1968.
