根皮苷生物转化制备根皮素工艺优化研究
2018-03-27汪瑾雨余海立刘兰庆苏香萍汪鋆植
汪瑾雨,余海立,刘兰庆,苏香萍,汪鋆植,2*
(1.三峡大学 生物与制药学院 湖北省生物酵素工程技术研究中心,湖北 宜昌443002;2.湖北省土家族医药研究所,湖北 宜昌 443002)
根皮素是根皮苷的脱糖基产物,存在于蔬菜,苹果、梨等水果中,是著名的天然二氢查尔酮之一[1-3],具有抗氧化[4]、抑制酪氨酸酶活性[5-6]、抗癌[7-8]、抗炎[9]、抗菌[10]和雌激素作用[11]等多种生物活性[12]。近年来,根皮素作为抗氧化功效因子在食品领域应用广泛,李姝静等[13]制备出根皮素与β-环糊精的包合物,提高了根皮素的水溶性和抗氧化能力,有利于其加工成水基化保健食品剂型。孙玥等[14]采用等效面分析法考察了多组分食品添加剂—阿魏酸、根皮素和水溶性维生素E(vitamin E,VE)抗氧化的协同作用,并进行配方比例的响应面优化;此外,还制备出阿魏酸、根皮素及水溶性维生素E(VE)的复方微乳[15],提高了复方抗氧化体系的稳定性和抗氧化效力,扩大了其在食品、化妆品等领域的应用。ZHANG T J等[16]用不同溶剂提取苹果渣并测定其活性,证实了根皮素可作为合成抗氧化、抗菌食品添加剂的天然替代品。然而,根皮素在植物中的含量较低[17],而根皮苷易于从苹果、海棠等植物中大量获取,因此,利用根皮苷制备根皮素是一条可行途径[18-20]。为了更高效、环保地生产根皮素,本研究利用酵母菌生物转化根皮苷制备根皮素,并通过响应面法优化出根皮苷最佳转化工艺,以期为根皮素工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司;根皮苷标准品(纯度≥98%)、根皮素标准品(纯度≥98%):上海纯优生物科技有限公司;甲醇、乙腈(均为色谱纯):美国Tedia有限公司;其余试剂均为国产分析纯。
发酵培养基:马铃薯200g,葡萄糖20g,蒸馏水1000mL,pH自然,121℃灭菌20 min。
1.2 仪器与设备
HH-6数显恒温水浴锅:金坛市城西春兰实验仪器厂;ME215S型十万分之一电子天平:德国Sartorios公司;Dionex U 3000型高效液相色谱仪(high performance liquid chromatograph,HPLC):美国戴安液相色谱有限公司;JY99-IIDN型超声波破碎仪:宁波新芝生物科技有限公司;HEV-50型自动灭菌锅:日本HIRAYAMA公司;SB-100旋转蒸发仪:日本EYELA公司;0.45 μm尼龙膜针筒过滤器:天津津腾实验设备有限公司。
1.3 方法
1.3.1 酵母转化液收集
取斜面菌种接种至200 mL发酵培养基中,于30℃、100 r/min条件下,培养24 h,制得种子液。以5%的接种量吸取种子液至200 mL发酵培养基中,于30℃、100 r/min条件下,培养48 h后,于2 000 r/min离心10 min,弃去上清液,收集沉淀细胞。沉淀细胞用同等体积的pH 6.0的磷酸盐缓冲液淋洗两遍,置于三角烧瓶中,在冰浴条件下破碎(破碎3 s,间歇3 s,共70次,10 min),即得酵母转化液。
1.3.2 根皮苷的生物转化方法
实验组:取上述一定体积的转化液,pH自然,加入合适比例的一定浓度的根皮苷溶液,于适宜温度下水浴相应时间,沸水加热5 min,以终止反应。转化液用同等体积的乙酸乙酯萃取2次,合并乙酸乙酯,于45℃减压蒸干,用甲醇溶解,并定容至一定体积,0.45 μm的微孔滤膜过滤。采用HPLC分析滤液中的根皮素,并根据根皮素标准曲线回归方程计算含量。实验中,同时设立对照组,即只加转化液,不加底物。根皮素产率按如下公式计算:

式中:C1为转化液中根皮素的质量浓度,g/L;C2为底物根皮苷的质量浓度,g/L;M1为根皮素的相对分子质量,274.27;M2为根皮苷的相对分子质量,436.41。
1.3.3 高效液相色谱分析
色谱条件:CosmailC18色谱柱(4.6mm×250mm,5μm);流动相:乙腈-水(55∶45,V/V);检测波长为285 nm,流速为1.0 mL/min,柱温:30 ℃,进样量:10 μL。
1.3.4 根皮素标准曲线的绘制
精密称取0.01g的根皮素标准品,置于10mL容量瓶中,甲醇定容至刻度线,摇匀,即得质量浓度为1.0 g/L的根皮素标准品溶液。精密吸取标准溶液0.1 mL、0.5 mL、1.0 mL、1.5 mL、2.0 mL,分别置于10 mL容量瓶,用甲醇定容,配成质量浓度为10 μg/mL、50 μg/mL、100 μg/mL、150 μg/mL、200 μg/mL的系列根皮素标准溶液。吸取10 μL,于上述色谱条件下进样分析,每个质量浓度进样3次,计算平均峰面积。以根皮素质量浓度(X)为横坐标,峰面积积分值(Y)为纵坐标,进行线性回归,得根皮素标准回归方程为:Y=0.459 2X-1.325(R2=0.999 5)。根据根皮素标准回归方程计算样品中根皮素含量。
1.3.5 单因素试验
选取转化时间(4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h)、转化温度(30℃、40℃、50℃、60℃、70℃)、酵母转化液与底物根皮苷体积比(液料比)(5∶1、7∶1、9∶1、11∶1、13∶1(V/V))和底物根皮苷质量浓度(8g/L、10g/L、12g/L、14g/L、16 g/L)对根皮素产率的影响,以确定响应面试验的考察因素及各因素的水平。
1.3.6 响应面试验[21-22]
根据单因素试验结果,选择转化时间(X1)、转化温度(X2)、液料比(X3)为考察因素,以根皮素产率(Y)为评价指标,按照Box-BehnkenDesign(BBD)试验设计,进行3因素3水平响应面分析试验,数据分析采用Design-Expert 8.0.6软件,从而得出生物转化制备根皮素的最佳条件。响应面试验因素与水平见表1。

表1 根皮素制备条件优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for phloretin preparation conditions optimization
2 结果与分析
2.1 单因素试验结果
2.1.1 转化时间对根皮素产率的影响

图1 转化时间对根皮素产率的影响Fig.1 Effect of conversion time on the yield of phloretin
转化时间对根皮素产率的影响见图1。由图1可知,随着转化时间的延长,根皮素产率也逐渐增加,当转化时间为18 h时,根皮素产率最高,为49.75%。若转化时间太短,底物根皮苷转化不完全;转化时间过长,转化液中酶失活。因此,选取转化时间16 h、18 h、20 h为响应面试验的取值范围。
2.1.2 转化温度对根皮素产率的影响
转化温度对根皮素产率的影响见图2。由图2可知,随着转化温度的升高,根皮素产率先增加后减少,当转化温度为40℃时,产率达最大,为48.67%;当转化温度在30℃~40℃时,根皮素产率随着转化温度的升高而缓慢增加;当转化温度高于40℃后,随着转化温度的升高,根皮素产率呈下降趋势。其原因可能是温度过高,转化液中酶失活且失活速率也加快所致。因此,选取转化温度30℃、40℃、50℃为响应面试验的取值范围。

图2 转化温度对根皮素产率的影响Fig.2 Effect of conversion temperature on the yield of phloretin
2.1.3 液料比对根皮素产率的影响
液料比对根皮素产率的影响见图3。由图3可知,随着液料比的增加,根皮素产率逐渐增加,液料比为11∶1(V/V)时产率最大且趋于稳定,为70.05%。说明在底物根皮苷的量一定的情况下,液料比达到11∶1(V/V)后,根皮素产率基本保持不变,此后无增加液料比的必要。因此,选取液料比9∶1、11∶1、13∶1(V/V)为响应面试验的取值范围。

图3 液料比对根皮素产率的影响Fig.3 Effect of liquid-material ratio on the yield of phloretin
2.1.4 底物质量浓度对根皮素产率的影响
底物质量浓度对根皮素产率的影响见图4。由图4可知,随着底物质量浓度的增加,根皮素产率也逐渐增加,但整体增加幅度相对较小,底物质量浓度在10 g/L时产率最大,为69.55%。这是因为转化液中酶的耐受能力与底物质量浓度有关,同时产物根皮素的积累也会对转化液中的酶产生抑制。底物质量浓度为8 g/L时的产率(66.21%)与底物质量浓度为10 g/L时的产率(69.55%)差异不大,且此后,继续增加底物质量浓度,根皮素产率变化不明显。
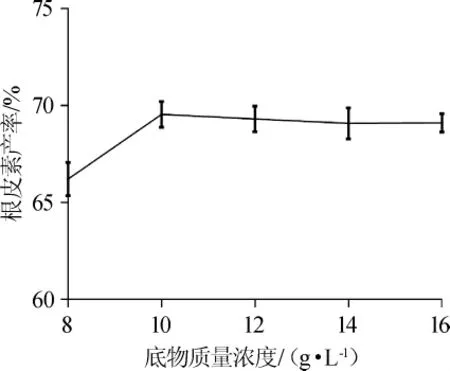
图4 底物质量浓度对根皮素转化率的影响Fig.4 Effect of substrate concentration on the yield of phloretin
2.2 响应面试验
2.2.1 响应面试验结果
在单因素试验结果的基础上,以转化时间(X1)、转化温度(X2)、液料比(X3)为自变量,以根皮素产率(Y)为响应值进行响应面试验。响应面试验设计与结果见表2。

表2 响应面试验设计与结果Table 2 Design and results of response surface experiments
2.2.2 模型建立及响应面分析
采用Design-Expert 8.0.6软件对表2数据进行处理,方差分析见表3。
由表3回归模型的方差分析结果可知,模型的F值为14.09(P<0.01),说明拟合的方程极显著(模型可靠),但是失拟项的F值为93.15(P<0.01),说明方程模拟的不好,不能很好用于根皮素产率的分析。因此对该模型进行手动优化,结果见表4。

表3 回归模型方差分析Table 3 Variance analysis of regression model

表4 手动优化后的回归模型方差分析Table 4 Variance analysis of regression model after manual optimization
由表4可知,手动优化后的回归模型F值为224.41,说明拟合的方程极显著(P<0.01);同时,失拟项的F值为6.95,失拟项不显著(P>0.05),说明用转化时间、转化温度、液料比这3个参数拟合的根皮素产率方程是可行的;此外,该回归模型的相关系数R2为0.998 0,校正系数(与预测复相关系数(以上参数均说明该模型合理,实验误差小,可以用于根皮素产率的分析。
一次项X1对根皮素产率的影响有显著作用(P<0.05),X2和X3对根皮素产率的影响达极显著水平(P<0.01);二次项、、对根皮素产率的影响有极显著作用(P<0.01);交互项X1X3对根皮素产率有极显著影响(P<0.01),而X1X2、X2X3对根皮素产率的作用不显著(P>0.05),无统计学差异。

利用Design-Expert 8.0.6软件对表2数据进行多元回归分析,得到的回归拟合方程如下:回归模型中X1、X2、X3前的拟合系数分别为0.61、1.93、1.99,可知各试验因素对根皮素产率影响的大小顺序为X3(液料比)>X2(转化温度)>X1(转化时间),其中液料比和转化温度是主要影响因素;回归方程的变异系数(coefficient of variation,CV)为0.88%,说明数据离散程度较小,在正常范围内;因此,可用该回归模型对根皮素产率进行预测和分析。由回归方程预测得到的根皮苷最佳生物转化工艺为:转化时间18.09 h、转化温度41.20℃、液料比11.52∶1(V/V),根皮素产率为70.97%。
2.3 响应曲面图分析与验证试验
表4数据通过Design-Expert 8.0.6软件进行回归拟合后,所得响应面图见图5。
由图5可知,当液料比一定时,根皮素产率随时间的延长而增加,在18 h时趋于稳定;而根皮素的产率随温度的升高呈先增后减的趋势,在40℃时根皮素产率最高,此后根皮素产率呈下降趋势,分析其原因可能是因为温度升高,转化液中酶失活所致。当转化温度一定时,根皮素产率随着时间和液料比的增加而增加,但时间过长可能会导致根皮素的水解,进而影响根皮素产率。当时间一定时,随着液料比增大,根皮素产率呈增加趋势;液料比达到11∶1(V/V)后,根皮素产率基本保持不变,此时,底物根皮苷最大限度地参与反应。
基于响应面法分析结果和实际工业生产,将理论最佳工艺调整为:转化时间18 h、转化温度41℃、液料比12∶1(V/V)。在此条件下平行验证3次,最终试验结果取平均值,得到根皮素产率为70.12%,与理论值70.97%基本相符,说明该回归模型可靠。

图5 转化时间、转化温度、液料比交互作用对根皮素产率影响的响应面与等高线Fig.5 Response surface plots and contour line of effects of interaction between conversion time,conversion temperature and liquor-material ratio on the yield of phloretin
3 结论
本试验利用酿酒酵母可产β-葡萄糖苷酶,该酶专一性地作用于根皮苷的β-D-葡萄糖苷键,脱糖基为根皮素。在单因素试验的基础上,通过Box-Behnken中心组合试验设计,考察转化时间、转化温度、液料比这三个因素对根皮素产率的影响,建立数学模型,得出根皮苷生物转化最佳工艺条件为:转化时间18 h、转化温度41℃、液料比12∶1(V/V),底物质量浓度8 g/L。在此条件下,根皮素产率为70.12%。
本研究获得了酿酒酵母生物转化根皮苷为根皮素的工艺条件,与传统化学法和酸碱法相比,具有操作简单、条件温和、成本低等优点,为后期根皮素工业化的生成奠定了基础,但还需要进一步中试调试,以满足工业化生成的实际需求。
[1]BARRECA D,BELLOCCO E,CARISTI C,et al.Kumquat(Fortunella japonicaSwingle)juice:Flavonoid distribution and antioxidant properties[J].Food Res Int,2011,44(7):2190-2197.
[2]BARRECA D.Flavonoid and antioxidant properties of fruits belonging to theAnnonaandCitrusgenera[J].ACS Symp Ser,2013,1129:103-119.
[3]EHRENKRANZ J R L,NORMAN G L,KAHN C R,et al.Phlorizin:a review[J].Diabetes-Metab Res Rev,2005,21:31-38.
[4]REZK B M,HAENEN G R,WJ V D V,et al.The antioxidant activity of phloretin the disclosure of a new antioxidant pharmacophore in flavonoids[J].Biochem Bioph Resh Commun,2002,295(1):9-13.
[5]王建新,周 忠,王建国.根皮素抑制酪氨酸酶活性研究[J].香料香精化妆品,2002,(2):4-5.
[6]LIN Y P,HSU F L,CHEN C S,et al.Constituents from the Formosan apple reduce tyrosinase activity in human epidermal melanocytes[J].Phytochemistry,2007,68(8):1189-1199.
[7]MA L,WANG R,NAN Y,et al.Phloretin exhibits an anticancer effect and enhances the anticancer ability of cisplatin on non-small cell lung cancer cell lines by regulating expression of apoptotic pathways and matrix metalloproteinases[J].Int J Oncol,2015,48(2):843-853.
[8]罗 辉,汪亚君,陈 杰,等.根皮素诱导肝癌BEL-7402细胞凋亡[J].南方医科大学学报,2008,28(7):1249-1251.
[9]HUANG W C,WU S J,TU R S,et al.Phloretin inhibits interleukin-1β-induced COX-2 and ICAM-1 expression through inhibition of MAPK,Akt,and NF-κB signaling in human lung epithelial cells[J].Food Function,2015,6(6):1960-1967.
[10]张 英.根皮素抑菌活性及抑菌机理的研究[D].西安:陕西师范大学,2016.
[11]LERNER L J,TURKHEIMER A R,BORMAN A.Phloretin,a weak estrogen and estrogen antagonist[J].P Soc Exp Biol Med,1963,114(1):115-117.
[12]BEHZAD S,SUREDA A,BARRECA D,et al.Health effects of phloretin:from chemistry to medicine[J].Phytochem Rev,2017(2):1-7.
[13]李姝静,周自若,周 威,等.根皮素与两种β-环糊精衍生物的包合作用及性质[J].食品科学,2017,38(7):11-16.
[14]孙 玥,余燕影,曹树稳.阿魏酸、根皮素和水溶性VE的抗氧化协同效应及其配方优化[J].食品科学,2012,33(3):33-38.
[15]孙 玥,余燕影,曹树稳.阿魏酸、根皮素及Trolox复方微乳制备及性质[J].南昌大学学报(理科版),2013,37(5):474-479.
[16]ZHANG T,WEI X,MIAO Z,et al.Screening for antioxidant and antibacterial activities of phenolics from Golden Delicious apple pomace[J].Chem Central J,2016,10(1):47-55.
[17]赵艳敏,王 皎,宋光明,等.苹果树枝和叶中根皮苷及根皮素含量变化研究[J].食品研究与开发,2013,34(7):95-98.
[18]赵斐文.苹果枝叶中根皮苷的提取[J].科技创新导报,2009(29):92-94.
[19]夏冬梅,李 敏,王道清,等.藏药俄色叶中根皮苷、根皮素含量分析[J].中国现代中药,2014,16(8):618-622.
[20]冯雪娇,曹学丽,李 艳,等.根皮苷的应用及分离纯化研究进展[J].食品科学技术学报,2008,26(4):13-16.
[21]李 莉,张 赛,何 强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.
[22]张泽志,韩春亮,李成未.响应面法在试验设计与优化中的应用[J].河南教育学院学报:自然科学版,2011,20(4):34-37.
