茶皂素β-D-葡萄糖醛酸酶水解物的结构分析
2018-03-27林敬杰徐一涵张建华
林敬杰,严 凯,桂 娟,徐一涵,张建华*
(1.上海交通大学 农业与生物学院 陆伯勋食品安全研究中心,上海 200240;2.上海交通大学 分析测试中心,上海 200240)
茶皂素是山茶科山茶属植物中的一类齐墩果烷型三萜类皂苷的混合物,基本结构有齐墩果烷型配体、糖基及小分子有机酸等,其化学结构试如下:

配体与有机酸的连接是通过配体环上的羟基与有机酸的羧基酯化而成的,有机酸多为当归酸和醋酸等[1]。糖基与配体通过配体上的羰基与糖基上的羟基以糖苷键形式结合[2],糖基有葡萄糖醛酸、木糖、阿拉伯糖和半乳糖等。从分子结构上看,茶皂素的结构可分为亲水基团和亲油基团两部分,其亲水基团是由电负性很强的的含氧基团构成,主要集中在茶皂素的糖基配体,有机酸配体以及皂苷配基的连接部位,而五环三萜骨架是由非极性的碳氢环链构成,在水溶液中呈现疏水倾向,为亲油基团的主体。
茶皂素具有两亲性,可与红细胞细胞壁上胆甾醇络合形成不溶于水的复合物沉淀,破坏细胞渗透压,进而导致细胞破裂,引发溶血[3-4]。朱全芬等[5]发现并验证了茶皂素溶血性的鱼毒作用;YOSHIKAWA M等[6]测得茶皂素的溶血指数可达到105,对鱼类等冷血动物溶血毒性很大,但对猪、牛、羊等温血动物毒性相对较弱。
茶皂素易溶于含水甲醇、含水乙醇、正丁醇及冰醋酸、醋酐和吡啶[7-9],而苷元易溶于乙酸乙酯。殷敏敏等[10]依次通过石油醚、乙酸乙酯和正丁醇提取青阳参根茎,并在乙酸乙酯中分离到14种物质,其中包含10种苷元成分。CHAICHAROENPONGA C等[11]用硅胶吸附,以乙酸乙酯∶甲醇∶水(6∶3∶1.5(V/V))为洗脱液可分离茶籽粉提取液中的皂苷,并通过高效液相色谱(high performance liquid chromatography,HPLC)对其做了定量分析。
茶籽粕富含营养成分,但茶皂素的溶血性却限制了其作为饲料的工业价值。茶皂素的糖苷键可被酸、碱或酶水解成糖与苷元。在酸性条件下,3号位的糖苷键断裂;而在碱性条件下,16、18、21、22位的酯键断裂[12]。尹丽茸等[13]证明了β-D-葡萄糖醛酸苷酶(β-D-glucuronidase)水解能降低茶籽粕的溶血性,并利用产β-D-葡萄糖醛酸苷酶的面包乳杆菌和枯草芽孢杆菌对茶籽粕固体发酵,极大地降低了粕的溶血性。β-D-葡萄糖醛酸苷酶是一种能催化β-D-葡萄糖醛酸苷键水解的糖苷类水解酶[12]。从茶皂素的结构上可以看出,其五环三萜骨架与糖基以葡糖醛酸键相连[14-16],若利用酶解法去除皂苷的糖体配体,可能会很大程度上降低皂苷的两亲性,继而减弱茶皂素的溶血性。本实验通过超高效液相色谱-质谱联用(ultra performance liquid chromatography-mass spectrometry,UPLC-MS)对酶解前后茶皂素结构以及糖基和苷元相对含量的改变进行检测,验证β-D-葡萄糖醛酸苷酶酶解对茶皂素结构的影响,探讨溶血性降低的作用机理。如果β-D-葡萄糖醛酸苷酶可以降解茶皂素,下一步即可筛选产该酶的微生物菌种或构建产酶的基因工程菌,探索茶籽粕发酵脱毒的可行性。
1 材料与方法
1.1 材料与试剂
99%茶皂素:上海阿拉丁生化科技股份有限公司;β-D-葡萄糖醛酸酶(350 U/mL):美国Sigma公司;无水乙酸钠、冰乙酸、正丁醇、乙酸乙酯、甲醇、无水乙醇均为分析纯:国药集团化学试剂公司。
1.2 仪器与设备
DK-8D型电热恒温水槽:上海齐欣科学仪器有限公司;Mili-Q型超纯水系统:德国Merck公司;5415D型微量台式离心机:德国Eppendorf公司;RE-52AA型旋转蒸发仪:上海青浦沪西仪器厂;ACQUITY UPLC超高效液相-电喷雾-四级杆-飞行时间质谱仪:美国Waters公司。
1.3 实验方法
1.3.1 茶皂素的酶解
取0.25 g茶皂素溶于2 mL的体积分数50%乙醇中,用振荡器混合20 s,加入2 mL醋酸钠-醋酸缓冲液(pH 5.0)以及1 mL的β-D-葡萄糖醛酸酶混匀,于37℃反应24 h。以酶解物的正丁醇提取液和乙酸乙酯提取液为样品,以未酶解的茶皂素相应提取液为对照组。
1.3.2 乙酸乙酯-正丁醇转萃法
往反应液中加入1 mL的乙酸乙酯,充分振荡后,静置15 min,然后取上层清液。此步骤重复6次,合并收集到的上层清液。在剩余的反应液中加入1 mL的正丁醇充分振荡后,静置15 min,然后取上层清液,此步骤同样重复6次,合并收集到的上层清液。将乙酸乙酯萃取液在30℃进行真空浓缩,接近蒸干后,加入15 mL甲醇,继续蒸发浓缩,用甲醇将浓缩液体积调为500 μL。将正丁醇的萃取液于60℃进行蒸发浓缩,接近蒸干后,加入15 mL甲醇,然后于30℃蒸发浓缩,用甲醇将浓缩液体积调为500 μL。
1.3.3 UPLC-MS条件
液相色谱条件:色谱柱规格:Waters AcquityBEH C18色谱柱(100 mm×2.1 mm,1.7 μm);柱温:45℃;紫外检测波长:254 nm;进样量:5 μL;流动相A:含有0.1%甲酸的水,流动相B:含有0.1%甲酸的乙腈。流速0.4 mL/min,洗脱梯度程序见表1。
质谱条件:离子方式:负离子模式;质量范围(m/z):50~2 000;毛细管电压:2 800 V;锥孔电压:50.0 V;离子源温度:115℃;去溶剂温度:350℃;去溶剂气流:700 L/h;扫描时间:0.3 s。

表1 液相色谱梯度洗脱程序Table 1 Gradient elution program of liquid chromatogram
1.3.4 数据处理
峰面积比例计算:本实验对UPLC-MS结果进行了分析,首先通过软件积分得到总峰面积,再将非茶皂素的杂质峰剔除,并且过滤掉峰面积<80且峰型不佳的峰,以剩余峰的峰面积和为总峰面积,计算各个峰面积的百分比。其计算公式如下:

式中:n为茶皂素总组分数。
乙酸乙酯萃取部分糖苷型茶皂素的百分比即为该部分中所有糖苷型茶皂素百分比之和,其余类推。
2 结果与分析
2.1 酶解前后样品的组分及其峰面积分析
茶皂素样品及酶解后试样的UPLC分离结果见图2~图5,从各组分的出峰时间和峰面积的差异判断,酶解前后体系的物质组成存在明显差异,其中部分峰型酶解前后物质的含量提高2倍以上或者降至50%以下。酶解前后茶皂素乙酸乙酯萃取液与正丁醇萃取液中各组分的峰面积对比见表2和表3。

图2 茶皂素乙酸乙酯萃取液UPLC色谱图Fig.2 UPLC chromatogram of tea saponin extracted by ethyl acetate

图3 茶皂素酶解物乙酸乙酯萃取液UPLC色谱图Fig.3 UPLC chromatogram of tea saponin hydrolysate extracted by ethyl acetate

图4 茶皂素正丁醇萃取液UPLC色谱图Fig.4 UPLC chromatogram of tea saponin extracted by n-butyl alcohol
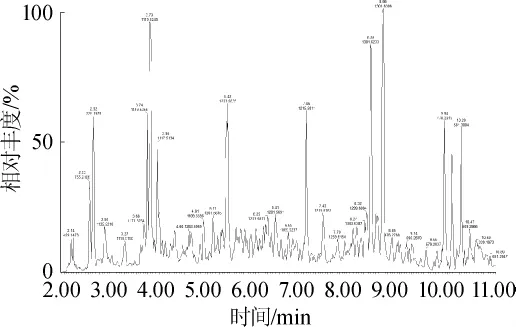
图5 茶皂素酶解物正丁醇萃取液UPLC色谱图Fig.5 UPLC chromatogram of tea saponin hydrolysate extracted by n-butyl alcohol

表2 酶解前后乙酸乙酯萃取液中茶皂素各组分的峰面积对比Table 2 Peak area comparison of components in tea saponin extracted by ethyl acetate before and after enzyme treatment

表3 酶解前后正丁醇萃取液中茶皂素各组分的峰面积对比Table 3 Peak area comparison of components in tea saponin extracted by n-butyl alcohol before and after enzyme treatment
由表2表3结果表明,乙酸乙酯萃取液中,出峰时间分别为4.96 min、5.08 min、6.29 min、7.60 min和7.82 min等组分的峰面积出现较大变化。正丁醇萃取液中,出峰时间分别为2.62 min和5.42 min的组分,酶解前后峰面积差异很大。
2.2 茶皂素样品及酶解产物的结构分析
通过Chemspider数据库对各个组分的质谱数据进行分析,系统推荐的可能的茶皂素结构式见表4、表5。
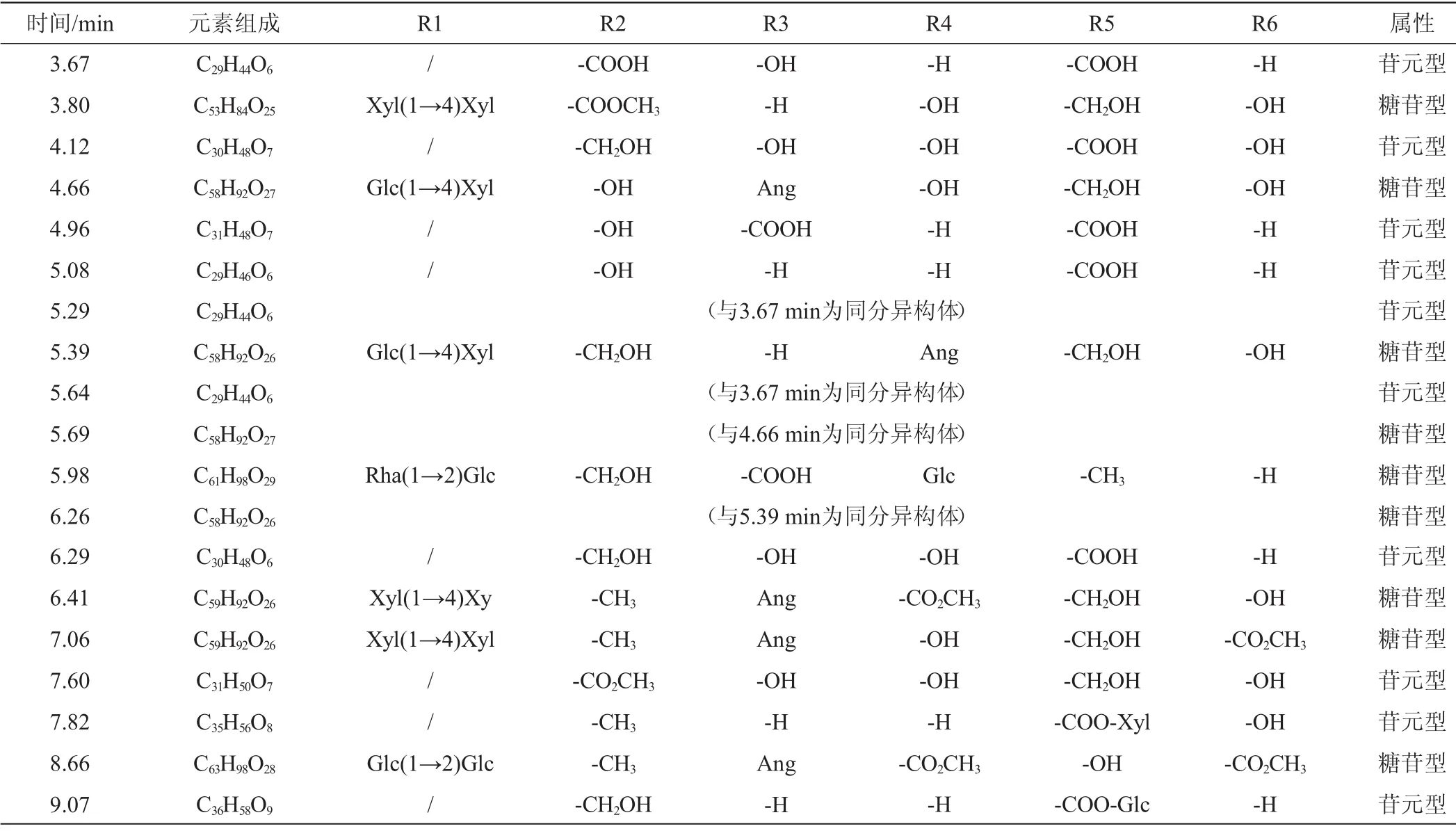
表4 乙酸乙酯萃取液中各组分的茶皂素组成Table 4 Compositions of tea saponins extracted by ethyl acetate

表5 正丁醇萃取液中各组分的茶皂素组成Table 5 Compositions of tea saponins extracted by n-butyl alcohol
酶解前乙酸乙酯萃取组分中糖苷型茶皂素合计为75.06%,由表2和表4可知,主要的糖苷型分子有C53H84O25(3.80 min)、C58H92O26(5.39 min)、C58H92O27(5.69 min)、C58H90O26(6.41 min)、C59H92O26(7.06 min)和C63H98O28(8.66 min)等,在酶解前峰面积百分比分别为13.35%、8.01%、5.10%、2.72%、7.94%和15.25%,合计为52.37%。酶解后上述组分的峰面积百分比分别为1.26%、1.33%、0、0、1.42%和1.23%,合计为5.24%,可见酶解后糖苷型的含量明显减少。
乙酸乙酯萃取组分中主要苷元的分子式为C29H44O6(3.67 min)、C30H48O7(4.12 min)、C31H48O7(4.95 min)、C29H46O6(5.09 min)、C30H48O6(6.29 min)、C31H50O7(7.60 min)、C35H56O8(7.62 min)和C36H58O9(9.07 min)等,酶解前峰面积百分比分别为4.33%、0.80%、0.09%、0.93%、0、0.50%、0和0.11%,合计为6.76%;酶解后上述组分峰面积百分比分别为4.65%、4.10%、10.72%、4.74%、13.31%、16.28%、8.63%和4.62%,合计为67.05%。可见酶解后苷元的含量显著增加。
酶解前后正丁醇萃取组分中皂苷形式的茶皂素分别合计为61.66%和47.17%。由表5可知,正丁醇萃取组分中主要的茶皂素分子均为糖苷型,有C54H86O26(3.74 min)、C53H82O25(3.95min)、C58H90O26(5.11min)、C59H96O26(5.68min)、C59H92O26(5.42min)、C63H98O28(8.66min)和C53H84O25(3.79min)等,酶解前峰面积百分比分别为5.35%、7.42%、2.30%、0、7.94%、15.25%和13.35%,合计为51.61%;酶解后上述组分的峰面积百分比分别为2.98%、3.84%、1.56%、1.39%、4.52%、10.52%和10.17%,合计为34.98%,酶解后正丁醇萃取组分中糖苷形式的茶皂素的含量也是显著减少。糖基可能的分子式为C25H40O21,分子质量与茶皂素常见的四糖结构相同,酶解前后峰面积占比分别为2.47%和4.98%(见表3),可见糖基的含量也有提高。上述结果表明,酶解前茶皂素以糖苷型为主,酶解后以苷元型为主,且四糖含量明显增加,说明β-D-葡萄糖醛酸苷酶的作用位点就是连接茶皂素中糖基与苷元成分的糖苷键。本研究的结果与王小燕等[17]关于β-D-葡萄糖醛酸苷酶催化机理的论证,以及PODOLAK I等[18]通过酶解法去除皂苷的糖基配体,降低皂苷溶血性的实验结果[18]均相符。
3 结论
本实验采用乙酸乙酯-正丁醇转萃法对酶解前后的茶皂素进行提取,再通过UPLC-MS分析方法对各组分进行分析,发现酶解前乙酸乙酯萃取组分中皂苷的峰面积占75.06%,苷元的峰面积仅占6.76%;酶解后皂苷的峰面积占5.24%,苷元的峰面积占67.05%。正丁醇萃取组分中茶皂素主要为皂苷类,酶解前的峰面积百分比61.66%,酶解后峰面积占47.17%。酶解前茶皂素混合物中以糖苷型为主,酶解后苷元及四糖含量明显增加,说明β-D-葡萄糖醛酸苷酶的作用位点就是连接茶皂素中糖苷与苷元成分的糖苷键,这一研究结果为解释β-D-葡萄糖醛酸苷酶能有效降低茶皂素溶血性提供了理论依据。
[1]沈善登,周丽凤.油茶籽综合利用关键技术探讨[J].中国油脂,2012,37(7):67-70.
[2]满 意,张春勇,郭荣富.茶皂素结构、生物学作用及其在动物生产中的应用前景[J].湖南饲料,2012(3):15-17.
[3]YOSHIKAWA M I,MORIKAWA T,YAMAMOTO K,et al.Floratheasaponins A-C,acylated oleanane-type triterpene oligoglycosides with antihyperlipidemicactivitiesfromflowersoftheteaplant(Camellia sinensis)[J].Chem Pharm Bull,2005,68(9):1360-1365.
[4]钟世安,贺国文,张春静,等.反相高效液相色谱法测定茶籽饼中茶皂素[J].理化检验(化学分册),2008,44(12):1169-1175.
[5]朱全芬,夏春华,樊兴土,等.茶皂素的鱼毒活性及其应用的研究[J].茶叶科学,1993,13(1):69-78.
[6]YOSHIKAWA M,SEIKOU N,KATO Y,et al.Medicinal flowers XIV.1)New acylated oleanane-type triterpene oligoglycosides with antiallergic activity from flower buds of Chinese tea plant(Camellia sinensis)[J].Chem Pharmaceut Bull,2007,55(4):598-605.
[7]李升锋,尹 国,刘学铭,等.茶皂素性质、提取、精制及应用[J].粮食与油脂,2003(11):17-18.
[8]青山新次郎.茶皂素的提取工艺及性质[J].药学杂志(日),1931,51(5):367-375.
[9]熊道陵,张团结,陈金洲,等.茶皂素提取及应用研究进展[J].化工进展,2015,34(4):1080-1087.
[10]殷敏敏,殷志奇,张 健,等.青阳参乙酸乙酯萃取部位的化学成分[J].中国药科大学学报,2013,44(3):213-218.
[11]CHAICHAROENPONGA C,PETSOM A,Quantitative TLC analysis of the saponins in tea seed meal[J].Phytochem Anal,2009,20:253-255.
[12]胡健华,陈新新.油茶皂素、油茶多糖及糖萜素的化学结构、理化性质综述[J].武汉轻工大学学报,2012(2):20-23.
[13]尹丽茸,钟广耀,张建华.茶籽粕发酵脱毒及茶皂素的分析鉴定[D].上海:上海海洋大学,2013.
[14]HU J,NIE S,HUANG D,et al.Extraction of saponin fromCamellia oleiferacake and evaluation of its antioxidant activity[J].Int J Food Sci Technol,2012,47(8):1676-1687.
[15]MYOSE M,WARASHINA T,MIYASE T.Triterpene saponins with hyaluronidase inhibitory activity from the seeds ofCamellia sinensis[J].Chem Pharm Bull,2012,60(5):612-623.
[16]THAO N T,HUNG T M,CUONNG T D,et al.28-nor-oleanane-type triterpene saponins fromCamellia japonicaand their inhibitory activity on LPS-induced NO production in macrophage RAW264.7 cells[J].Bioorg Med Chem Lett,2010,20(24):7435.
[17]王小燕.β-D-葡萄糖醛酸苷酶催化多样性及定向合成GAMG的酶基因克隆与表达[D].石河子:石河子大学,2007.
[18]PODOLAK I,GALANTY A,SOBOLEWSKA D.Saponins as cytotoxic agents:a review[J].Phytochem Rev,2010,9(3):425-474.
