小飞蓬耐铅内生细菌的分离及其16S rDNA鉴定
2018-03-27刘希华江丹丹
刘希华, 江丹丹, 文 欣
(1.福建省资源环境监测与可持续经营利用重点实验室,福建三明 365004; 2.三明学院资源与化工学院,福建三明 365004)
小飞蓬(Conyzacanadensis)别称加拿大飞蓬,属菊科白酒草属,为一年生草本植物,广泛分布在福建省各地,具有生命力强、生长迅速、生物量大的特点,在矿区有很强的生长优势。杨刚等对四川甘洛铅锌矿废弃矿区和尾矿库区自然生长的15种草本植物进行调查发现,不同植物地上部分体内重金属铅(Pb)、锌(Zn)、镉(Cd)的富集量以小飞蓬最高[1],小飞蓬富集土壤中Pb的方式是利用它们植物稳定化(固定化)的作用吸收固定土壤中的Pb[2],其中叶片吸收囤积的重金属元素最多,达到147.105 8 mg/kg,远高于其根、茎部所吸收囤积的重金属元素量。因此,在治理土壤中的铅污染时,可以通过大面积收割铅污染区小飞蓬地上部分来治理回收利用重金属[3]。
对福建省重金属污染现状的调查结果表明,重点防控的重金属污染物为铬(Cr)、铅(Pb),而三明市则以铅为重点防控的重金属污染。小飞蓬生长缓慢,植株矮小,地上部生物量小,在实际应用中受到很大的限制。植物内生细菌(endophytic bacteria)是从植物内部得到的并且可以定殖于健康植物体内的,或者从表面消毒的植物组织中分离得到的各类菌,但是不会改变植物的表型特征和功能[4]。学者们通过研究发现,内生细菌对植物的生长具有促进作用,不仅可以缓解重金属的毒性,而且会对土壤中的重金属生物有效性产生影响[5-11]。目前,在内生细菌与植物相联合对重金属污染的土壤进行修复方面已经有了一些研究,还取得了很好的治理效果[12-14],但是对小飞蓬内生菌的研究还未见报道。本研究以小飞蓬根茎叶为材料,采用常规方法分离内生细菌并对其进行生理生化和分子进化检测,以了解小飞蓬耐铅内生细菌种类组成,尝试从内生细菌特性方面对小飞蓬的耐铅胁迫特性进行探索。
1 材料与方法
1.1 材料与方法
1.1.1 小飞蓬 野生盆栽小飞蓬,等小飞蓬长到高约为 50 cm 时,分别用配制的浓度梯度为0(空白对照组)、0.3、0.6、0.9、1.2 mmol/L的硝酸铅溶液浇灌盆栽小飞蓬,3 d浇灌1次,1个月后,正常浇自来水2个月,采集长势好、无病害小飞蓬根、茎、叶3个部分进行内生细菌分离。
1.1.2 培养基 牛肉膏蛋白胨培养基:3 g/L牛肉膏,10 g/L蛋白胨,5 g/L NaCl,固态培养基另加琼脂20 g/L,调节pH值至7.4,121 ℃灭菌20 min。
配制铅浓度分别为0、0.3、0.6、0.9、1.2 mol/mL的牛肉膏蛋白胨培养基。
1.2 内生细菌的分离和纯化
将小飞蓬根、茎、叶3个部分分别用5%洗洁精浸泡 5 min,于流水下冲洗干净,在无菌操作台上,用75%乙醇振荡冲洗 2 min,再用无菌水振荡冲洗5次,以最后1次漂洗液涂布于培养基上做灭菌效果检测。将灭菌材料置于无菌研钵中,加入适量无菌磷酸缓冲盐溶液(PBS)和石英砂进行研磨至浆状。将匀浆液转入离心管中,2 000 r/min离心2 min,取上层澄清液涂布于固态培养基中,每个铅浓度设3次重复。于37 ℃培养至长出单菌落,反复划线至得到纯培养菌株。
1.3 形态及生理生化鉴定
纯化菌株采用常规方法进行革兰氏染色、柠檬酸盐反应、接触酶反应、甲基红试验和VP试验等检验[15]。
1.4 分子鉴定
采用3S柱离心式环境样品DNA回收试剂盒V2.2提取分离菌株基因组DNA,以通用引物8f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-GGTTACCTT GTTACGACTT-3′)(上海华大基因科技有限公司)进行PCR扩增。50 μL PCR扩增体系如下:5 μL 10×PCR buffer(2.0 mmol/L MgCl2),4 μL dNTPs(10 mmol/L ),1 μL 8f(10 mmol/L),1 μL 1492r(10 mmol/L),1 μLTaqDNA聚合酶(2.5 U/μL),1 μL模板DNA。PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 7 min。用1.0%琼脂糖凝胶电泳检测PCR产物。回收1 700 bp左右的PCR产物并连接到pMD19-T Vector,挑取阳性克隆送往上海华大基因公司测序。
序列经Blast进行最大相似性比对,用 Clustal X 1.83[16]进行同源性分析,用来自MEGA(2.1)的邻接(neighbor-joining,简称NJ)法[16]构建系统发育树。
2 结果与分析
2.1 内生菌的分离与纯化
小飞蓬表面灭菌处理后,经涂布检测表明灭菌彻底。通过小飞蓬不同部位、不同铅浓度培养基平板的分别培养,共分离到31株内生细菌,在根的部位分离到14株,茎的部位分离到7株,叶的部位分离到10株(表1)。在不同铅离子浓度的平板培养基上,0、1.2 mol/mL铅离子浓度培养基中无菌株产生;0.3 mol/mL铅离子浓度培养基上分离到最多的内生菌,达到13株;0.9 mol/mL铅离子浓度培养基上分离到11株内生菌;0.6 mol/mL铅浓度培养基上分离到7株内生菌。
2.2 形态学与耐铅生理浓度检测
由表2可以看出,经革兰氏染色、显微镜观察,所有菌株均为G+菌,接触酶反应都为阳性(+),甲基红试验测定结果均为阴性(-),24株菌柠檬酸盐反应结果为阳性(+),21株菌VP试验结果为阳性(+)。
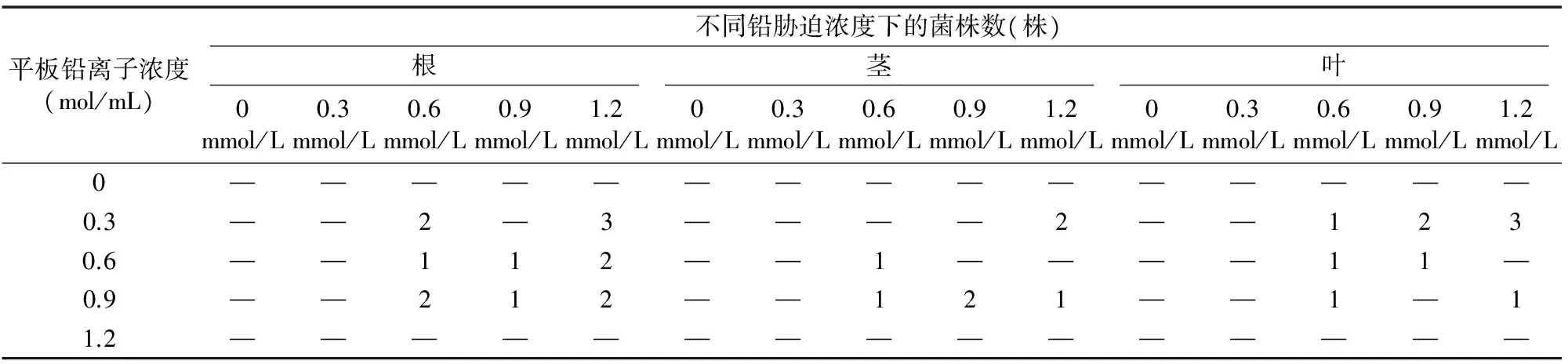
表1 小飞蓬分离菌株情况
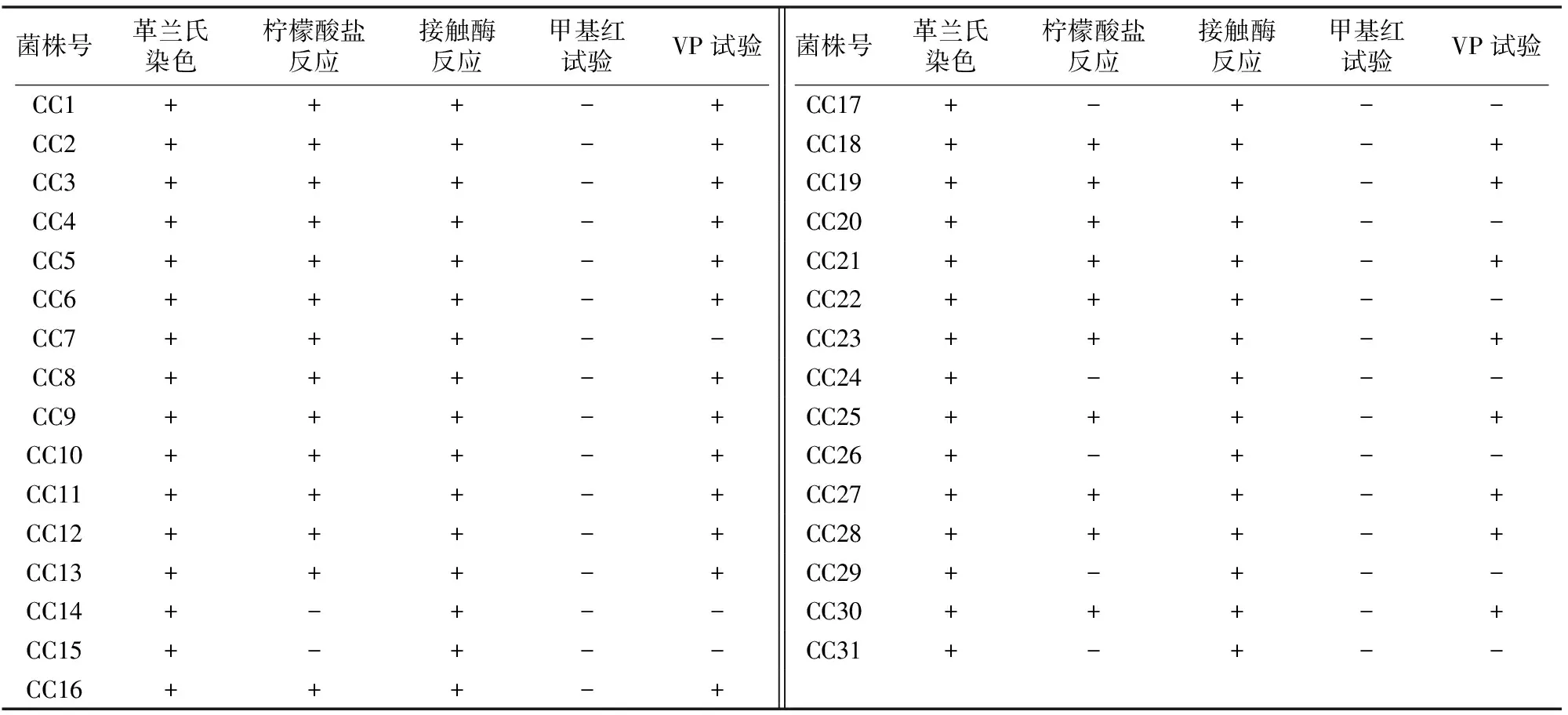
表2 生理生化结果
2.3 内生菌株16S rDNA基因序列分析及系统发育树构建
对小飞蓬31株内生细菌DNA进行PCR扩增后,扩增产物长度均为1 500 bp左右。小飞蓬内生细菌的16S rDNA测序结果表明,部分内生菌为同种,经过合并归类后,得到5种小飞蓬内生菌(CC2、CC6、CC14、CC16和CC23)。经过BLAST检索,找到与之相似性最高的种属。
将上述5个菌株与其同源性较高的菌株16S rDNA序列利用MEGA(2.1)程序包构建发育树(图1)。根据系统发育树,可以推断CC2、CC6、CC16和CC23在遗传距离上较为接近,聚为一类。同时,从遗传距离上来看,这4个菌株与短芽孢杆菌属(Brevibacillussp.)较为接近,表明这4个菌株与短芽孢杆菌属在系统发育上的亲缘关系较近。CC14则与节杆菌属(Arthrobactersp.)在遗传距离上较为接近,表明这二者在系统发育上的亲缘关系较近。根据16S rDNA分类标准,一般认为,属于同一个种的16S rDNA序列同源性大于99%,归为一个属的可以认为同源性在95%~99%之间。据此推断,所分离的小飞蓬内生细菌CC2、CC6、CC16和CC23是短芽孢杆菌属,CC14是节杆菌属。
3 结论与讨论
本研究通过分离纯化铅胁迫下的小飞蓬根茎叶的内生菌,共得到31株内生细菌,在根的部位分离到14株细菌,在茎的部位分离到7株细菌,在叶的部位分离到10株细菌。得到的菌株经过革兰氏染色等生理生化检测和内生菌基因组DNA提取、16S rDNA扩增和系统进化树的构建等分子检测分析方法,推测所分离到的菌株中CC2、CC6、CC16和CC23是短芽孢杆菌属,CC14是节杆菌属。植物内生菌是与植物组织共生在一起的,长期存在于植物组织内部,内生菌的存在能促进植物生长,在某些重金属污染地区,可增强植物抗逆能力,提高生物修复能力[17]。柯野等从大宝山矿区重金属污染的土壤中分离到类短短芽孢杆菌(B.parabrevis),对发酵液中铅的去除效率高达30.27%[18],但并未探明该菌株富集铅离子的机制。节杆菌菌属菌株对沉淀态铅有很强的活化效能[19],以及对铅的高抗性水平[20]、吸附铅效果较好[21]等一些富集铅的功能。对节杆菌富铅的生理生化研究也表明,节杆菌菌属菌株对铅的吸附主要是通过细胞成分中的磷酸基团、羰基、羟基、酰胺基团、羧基等活性基团与铅离子发生络合作用[21],吸附铅后可诱导铅离子在细菌表面形成含铅的矿物[22]。本研究首次从植物(小飞蓬)中分离到铅富集内生菌菌株(短芽孢杆菌属和节杆菌属),说明这些菌株是可以与植物进行共生的,但是由于小飞蓬生长缓慢,所以在植物修复重金属污染方面的效果不明显,因此下一步的试验将着眼于将分离的菌株与其他生长快速、生物量大的植物进行共生,将有助于重金属污染地区的土壤修复研究。

[1]杨 刚,伍 钧,唐 亚,等. 铅锌矿业废弃地草本植物重金属耐性研究[J]. 四川环境,2006,25(4):18-21,38.
[2]刘月莉,伍 钧,唐 亚,等. 四川甘洛铅锌矿区优势植物的重金属含量[J]. 生态学报,2009,29(4):2020-2026.
[3]沈洽金,刘德良,郭宇翔,等. 煤矿废弃地重金属含量及3种土著先锋植物吸收特征[J]. 广东农业科学,2011,38(20):134-138.
[4]Schulz B J E,Boyle C J C,Sieber T N.Microbial root endophytes[M]. Berlin:Springer-Verlag,2006:1-13.
[5]马 莹,骆永明,滕 应,等. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报,2013,50(1):195-202.
[6]Glick B R. Phytoremediation:synergistic use of plants and bacteria to clean up the environment[J]. Biotechnology Advances,2003,21(5):383-393.
[7]牛之欣,孙丽娜,孙铁珩. 重金属污染土壤的植物-微生物联合修复研究进展[J]. 生态学杂志,2009,28(11):2366-2373.
[8]Reeves R D. Tropical hyperaccumulators of metals and their potential for phytoextraction[J]. Plant and Soil,2003,249(1):57-65.
[9]Puschenreiter M, Stoger G,Lombi E,et al. Phytoextraction of heavy metal contaminated soils withThlaspigoesingenseandAmaranthushybridus:rhizosphere manipulation using EDTA and ammoniumm sulfate[J]. Plant Nutr Soil Sci,2015,164(6):615-621.
[10]Sheoran I,Singal H,Singh R. Effect of Cadmium and nickel on photosynthesis and the enzymes of the photosynthetic carbon reduction cycle in pigeonpea (CajanuscajanL.)[J]. Photosynthesis Research,1990,23(3):345-351.
[11]Lebeau T,Braud A,Jézéquel K. Performance of bioaugmentation-assisted phytoextraction applied to metal contaminated soils:a review[J]. Environmental Pollution (Barking,Essex:1987),2008,153(3):497-522.
[12]Rajkumar M,Freitas H. Effects of inoculation of plant-growth promoting bacteria on Ni uptake by Indian mustard[J]. Bioresource Technology,2008,99(9):3491-3498.
[13]Ma Y,Rajkumar M,Freitas H. Improvement of plant growth and nickel uptake by nickel resistant-plant-growth promoting bacteria[J]. Journal of Hazardous Materials,2009,166(2/3):1154-1161.
[14]Ma Y,Prasad M N,Rajkumar M,et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances,2011,29(2):248-258.
[15]周德庆,徐德强. 微生物学实验教程[M]. 北京:高等教育出版社,2013:33-35.
[16]Thompson J D,Gibson T J,Plewniak F,et al. The CLUSTAL_X Windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24):4876-4882.
[17]Shin M N,Shim J,You Y,et al. Characterization of lead resistant endophyticBacillussp. MN3-4 and its potential for promoting lead accumulation in metal hyperaccumulatorAlnusfirma[J]. Journal of Hazardous Materials,2012,199/200:314-320.
[18]柯 野,卢星燕,曾松荣,等. 粤北大宝山矿区土壤中抗铅菌株的筛选鉴定[J]. 安徽农业大学学报,2016,43(3):489-493.
[19]王旭梅,盛 楠,王红旗. 铅抗性细菌的筛选及其对铅活化的研究[J]. 东北农业大学学报,2010,41(6):64-67.
[20]Zhang H B,Duan C Q,Hu B,et al. Dynamic of heavy metals in a lead-zinc tailings deposited in different years[J]. Journal of Agro-Environmental Science,2003,22(1):67-69.
[21]金 羽,曲娟娟,李 影,等. 一株耐铅细菌的分离鉴定及其吸附特性研究[J]. 环境科学学报,2013,33(8):2248-2255.
[22]陈 志,邹情雅,潘晓鸿,等. 铅锌矿尾矿坝分离节杆菌12-1对Pb2+的耐受和吸附性能研究[J]. 农业生物技术学报,2014,22(11):1394-1401.
