生物质炭固定化融合菌株F14方法的研究及其对芘的去除
2018-03-26纪婷婷秦梓菲
张 松 ,侯 彬 ,纪婷婷 ,刘 阳 ,黄 飞 ,秦梓菲 ,卢 静 *
(1.中北大学环境与安全工程学院,太原 030051;2.华南农业大学资源环境学院,广州 510642)
多环芳烃(PAHs)是一种广泛存在的环境污染物,主要来源于有机材料的不完全燃烧[1],其本身具有的半挥发性、低溶解性、难生物降解性使得其不易被去除[2]。根据苯环数量的不同,多环芳烃可以分为低环芳烃和高环芳烃,高环芳烃由于稳定性和疏水性强,比低环芳烃具有更持久性[3],而环境中存在的能够以高分子量多环芳烃作为唯一碳源的微生物较少[4],寻求高效修复高环芳烃的方法引起了国内外学者的重视。芘作为一种四环多环芳烃,常被选为研究高环芳烃降解的模型化合物。
使用微生物修复环境中的多环芳烃被证明是最经济环保的[5],但传统的微生物修复存在生物可利用性低、容易受环境影响、与土著菌存在竞争等问题[6]。固定化微生物作为一种绿色高效的修复方法,具有保护微生物、可重复使用、操作简单等优点[7],与传统生物修复相比效率更高[8]。近年来,固定化微生物技术在修复有毒化合物如原油[9]、苯酚[10]、蒽[11]、荧蒽[12]、多氯联苯[13]等方面有着广泛的应用。
微生物的固定化可以通过很多方式来实现,如吸附法、包埋法、交联法和共价结合法,为了提高固定化颗粒的性质,同时使污染物去除率更高,目前许多研究采用添加吸附剂而成的吸附-包埋-交联的复合式固定化方法[6]。其中用作吸附固定化载体的材料多种多样,如天然吸附基质[14]、农作物秸秆[9]、蜂窝煤渣[15],生物质炭是近年来发展起来的一种吸附剂,它是缺氧条件下,生物质经高温热解的产物,是一类富含碳的材料,具有较大的比表面积和丰富的孔隙结构,并且制备生物质炭的原材料来源广泛[16-18]。研究表明生物质炭是一种很有潜力的固定化材料,添加生物质炭可以促进受污染土壤的生物修复[19-21]。然而对生物质炭的研究多集中于将生物质炭直接添加于土壤促进受污染土壤的生物修复[22-23],本实验选择将生物质炭固定化融合菌株用于对芘的去除。
F14是以菲降解菌GY2B和芘降解菌GP3A为亲本,通过原生质体技术构建而成的一株可以高效降解多环芳烃的融合菌株。F14对三环的菲具有比亲本GY2B更高的降解能力(12 h对初始浓度为100 mg·L-1菲的降解率为99%),但是对四环的芘的降解能力较低(10 d对初始浓度为100 mg·L-1芘的降解率仅有18%)[24-25]。为了提高融合菌株F14对芘的去除效果,以便于后续在实际土壤中的应用,本研究以不同温度下玉米秸秆制得的生物质炭为固定化材料,并添加聚乙烯醇和海藻酸钠,对融合菌株F14进行固定化,比较了添加不同温度制备的生物质炭的固定化小球的性质,并探究了将固定化小球用于去除芘的效果及降解动力学,旨在为固定化微生物技术高效修复环境中的芘提供理论依据和技术支撑。
1 材料与方法
1.1 试剂与仪器
芘购自西格玛公司,纯度为98%;聚乙烯醇(PVA)、无水氯化钙、亚甲基蓝均购自天津光复试剂有限公司;海藻酸钠(SA)和无水硫酸钠购自国药集团化学试剂有限公司;硼酸和正己烷购自天津科密欧化学试剂有限公司;营养肉汤购自广东环凯微生物科技有限公司。以上试剂均为分析纯。
将无水硫酸钠于马弗炉中400℃灼烧4 h后放入干燥器内备用,正己烷重蒸后使用,医用脱脂棉用二氯甲烷抽提72 h,通风橱风干后放入干燥器内备用。
UV-6000PC型紫外-可见分光光度计(上海元析仪器有限公司);Ultimate高效液相色谱仪(Thermo Scientific);TriStar 3020 II型物理吸附仪(美国 Micromeritics公司);1027HT型超声波清洗器(深圳市洁拓超声波清洗设备有限公司);RE-201D型旋转蒸发器(郑州特尔仪器设备有限公司);HC-3018高速离心机(安徽中科中佳科学仪器有限公司);立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);超净工作台(苏净集团安泰公司);水浴恒温振荡器(天津市欧诺仪器仪表有限公司);恒温振荡器(太仓华利达实验设备有限公司);电子天平(上海奥豪斯仪器有限公司)。
1.2 培养基
无机盐基础培养液(MSM)[26]:分别取5 mL磷酸盐缓冲液(KH2PO48.5 g·L-1、K2HPO4·H2O 21.75 g·L-1、Na2HPO4·12H2O 33.4 g·L-1、NH4Cl 5.0 g·L-1);3 mL MgSO4水溶液(22.5 g·L-1);1 mL CaCl2水溶液(36.4 g·L-1);1 mL FeCl3水溶液(0.25 g·L-1);1 mL 微量元素(MnSO4·H2O 39.9 mg·L-1、ZnSO4·H2O 42.8 mg·L-1、(NH4)6Mo7O24·4H2O 34.7 mg·L-1),定容至 1 L,并将培养基的pH调节为6.8~7.0。
本实验过程中所用到的玻璃器皿和溶液均在121℃下高压蒸汽灭菌30 min。
1.3 实验方法
1.3.1 融合菌株F14的复壮
将融合菌株F14加入营养肉汤中,32℃、150 r·min-1摇床培养,24 h后将营养肉汤菌液离心10 min(6000 r·min-1),菌体用磷酸盐缓冲液清洗3次并重新溶解于磷酸盐缓冲液中,最终制得一定浓度的菌悬液用于后续实验。
1.3.2 生物质炭的制备
将玉米秸秆烘干粉碎后填满于密闭的热解盒中,放入马弗炉中通10~20 min氮气,分别在300、500℃和700℃3种温度下热解2 h,冷却至室温后取出研磨过60目筛,储存于干燥器中备用。
1.3.3 固定化材料比例的优化
PVA和SA的混合载体机械强度高、稳定性强、传质性能较好,但是PVA和SA的浓度,以及二者的比例都会对固定化小球的性能造成很大影响。为了确定PVA和SA的最佳组合比例,选取PVA浓度为6%、8%和10%,SA浓度为 0.3%、0.5%和 1%进行研究。
将不同浓度的PVA溶液和SA溶液分别于90℃水浴振荡器和60℃水浴锅中溶解,一段时间后将二者60℃混合于水浴振荡器中继续溶解,待溶液混合均匀停止溶解。当混合液降至室温,与滴入4%饱和硼酸的CaCl2水溶液交联6 h,观察交联过程中小球的成球效果,同时测定交联完成后小球的性能,以此来确定PVA和SA的最佳比例。
1.3.4 固定化微生物小球的制备
在上述确定的最优PVA和SA条件下制备生物质炭固定化小球:将300℃制备的一定量生物质炭加入菌悬液中混合均匀,并与溶解好的PVA和SA的混合液进行混合,室温下静置。一段时间后与滴入4%饱和硼酸的CaCl2水溶液交联30 min,然后将形成的小球转移至1 mol·L-1的无水硫酸钠溶液继续交联6 h。交联完成后用生理盐水洗涤3次备用。分别用500℃和700℃制备的生物质炭重复以上实验,并测定各条件下小球的性能。
1.3.5 固定化小球性能的测定
直径:用游标卡尺测量不同条件下制备的固定化小球的直径,每组小球测30颗,求平均值。
机械强度:将固定化小球浸泡在无机盐培养基中,放于摇床上振荡,10 d后观察小球的破碎程度。
膨胀系数:测定固定化小球在无机盐培养基中振荡10 d后小球的直径,测得的平均直径与原小球直径之比即为膨胀系数。
传质性能:配制2%的亚甲基蓝乙醇溶液(亚甲基蓝溶液需现配现用)。滴加配好的亚甲基蓝乙醇溶液30滴于500 mL蒸馏水中,混合均匀后用于小球传质性能的测定。取此溶液分别加入固定化小球50颗放于摇床上振荡,24 h后在波长665 nm下,分别测定放小球的亚甲基蓝溶液的吸光度和原亚甲基蓝溶液的吸光度,比较测得的吸光度值大小,通过吸光度值的变化可间接反映固定化小球传质性能的好坏。
1.3.6 比表面积(BET)的测定
将不同条件下制备的固定化小球进行冷冻干燥,利用TriStar 3020 II型物理吸附仪进行液氮吸附脱附实验,测定小球的比表面积和孔径。
1.3.7 扫描电镜分析(SEM)
利用扫描电镜观察不同条件制备的小球的表面结构。首先将各种方法制备的小球用磷酸盐缓冲液清洗3次,然后在2.5%的戊二醛溶液中(4℃)固定化12 h以上,用不同浓度的乙醇溶液脱水后进行真空冷冻干燥,并溅射镀金膜,预处理完成的样品被切开放置在JEOL JEM6490LV扫描电子显微镜下进行观察。
1.3.8 固定化小球对芘的去除
将制备好的固定化小球加入初始浓度为50 mg·L-1的含芘无机盐培养基,培养9个周期,每个周期10 d,测定其剩余芘浓度,并在一个周期后与游离菌进行比较。由于实验过程中所用的芘浓度均大于芘在水中的溶解度(0.135 mg·L-1左右),因此芘的不溶性晶体在溶液中的分布是不均匀的,萃取时必须整瓶萃取。具体步骤为:(1)实验结束后,分别向锥形瓶中加入10 mL正己烷超声萃取15 min,倒入分液漏斗,弃去水相收集有机相,该过程重复2次;(2)将收集的有机相过无水硫酸钠;(3)放于旋转蒸发器上浓缩至1~2 mL;(4)定容到一定体积,用高效液相色谱仪进行测定。使用后的固定化小球用生理盐水冲洗回收,重复使用。
2 结果与讨论
2.1 固定化材料的最佳结合比例
将PVA和SA按不同比例组合后,对制备的固定化小球的性质进行了测试。根据交联过程中小球的成球效果,初步筛选出4组成球较好的小球,分别是6%PVA+1%SA、8%PVA+0.5%SA、8%PVA+1%SA 和10%PVA+0.5%SA。对这4组小球的传质性能和机械性能进行测试,结果如表1所示。4组小球在无机盐培养基中浸泡后都没有破碎,其中8%PVA+1%SA和10%PVA+0.5%SA传质性能最好,综合考虑小球的成球效果、传质性能和机械强度确定8%PVA+1%SA为最佳比例,在此条件下制得的固定化小球呈规则球形,大小均匀,如图1所示。
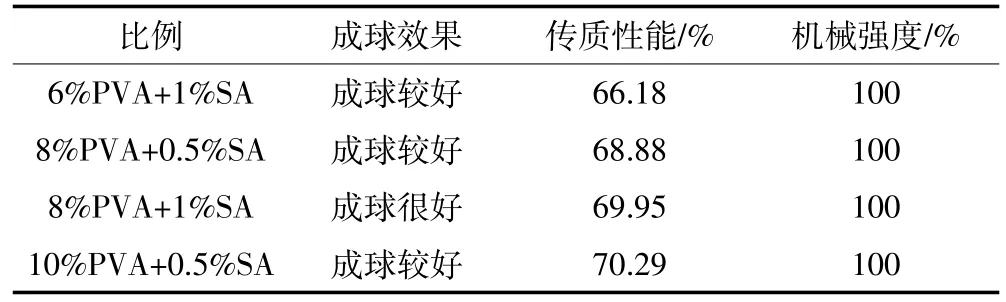
表1 不同固定化材料比例小球的性能Table 1 Performance of immobilized microbial beads
图1 固定化微生物小球外观效果Figure 1 The appearance images of the immobilized microorganism beads
2.2 不同生物质炭制备的固定化小球的性能分析
无生物质炭和不同温度下制备的生物质炭的固定化小球的直径、机械性能和传质性能如表2所示。由表2可以看出,所有条件下制备的小球的直径无明显差别,大约为3 mm左右。这比Huang等[27]用煤渣包埋芘和苯并芘降解菌制备的小球的直径(6~8 mm)明显低。而有研究表明,粒径越小降解率越高[28]。同时,所有固定化小球均能保持良好的机械性能,即在无机盐培养基中振荡10 d后没有任何破碎,满足了小球在生物处理废水中需要的高稳定性[29]。可以发现,在加入生物质炭后,小球的膨胀系数有了略微的下降,而膨胀系数越低,小球的稳定性越好[30]。与不添加生物质炭的小球相比,添加生物质炭制备的固定化小球传质性能明显提高,其中700℃制备的生物质炭效果最好。

表2 固定化微生物小球的性能Table 2 Performance of immobilized microbial beads
2.3 不同生物质炭制备的固定化小球的表面形态及孔结构分析
分别对不同固定化小球的表面性质和孔结构进行了考察,结果如表3所示。添加生物质炭后小球的比表面积都有不同程度的提高,其中添加700℃生物质炭制备的小球比表面积最大,孔径最小,有利于微生物和载体基质的接触,同时对有机物也有较好的吸附性能,进而提高了微生物对有机物的去除率。
小球的SEM图如图2所示,很明显可以发现添加生物质炭的小球表面比不添加生物质炭的小球更粗糙,更有利于微生物的吸附。结合表3的比表面积和图2的微观结构图可以得出700℃生物质炭表面凹凸不平、比表面积最大,有利于吸附。因此,在接下来的实验选择700℃生物质炭做进一步研究。
2.4 芘去除效果的研究
2.4.1 游离菌和固定化菌对芘的去除
实验研究了游离菌、固定化菌和不含微生物的生物质炭空白小球对初始浓度为50 mg·L-1芘的去除,结果如图3所示。由图3可以看出,固定化菌对芘的去除明显高于游离菌,游离菌对芘的去除率只有37.38%,而固定化菌的去除效率最高可达到94.91%。这可能是由于固定化载体可以为微生物的生长提供更好的场所,同时能够使细胞保持更高的活性。比较固定化菌和空白小球对芘的去除,可以看出空白小球对芘具有吸附作用,且吸附在小球上的芘可以被F14降解,因此推测固定化小球对芘的去除是依靠吸附和生物降解的协同作用。除此之外,为了评估瓶壁和细胞对芘的吸附作用,设置控制组实验研究无细胞和灭活细胞对初始浓度为50 mg·L-1芘的去除,结果表明芘的消耗仅有4.60%和6.03%,可以忽略不计。
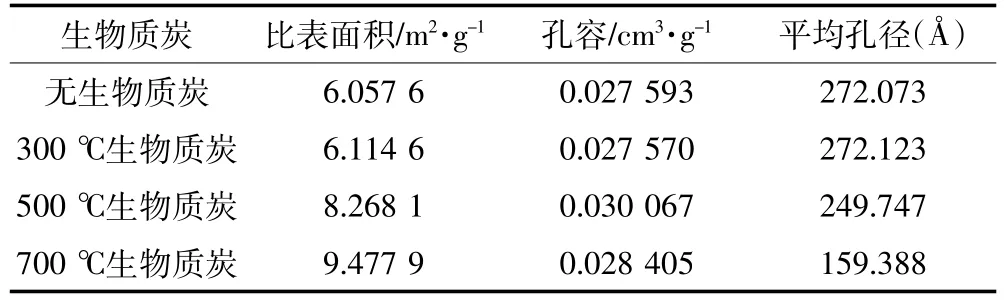
表3 固定化微生物小球的比表面积和孔结构Table 3 Special surface area and porosity of immobilized microbial beads
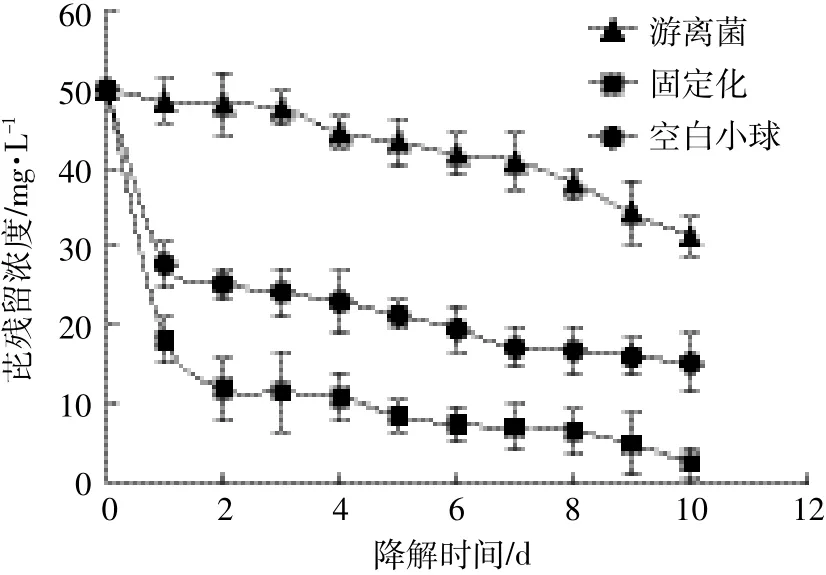
图3 芘降解曲线Figure 3 Curves of pyrene degradation
2.4.2 融合菌株F14降解芘的动力学方程
为了更好地研究游离菌和固定化菌对芘的降解,本实验将游离菌和固定化菌分别投加到初始浓度为50 mg·L-1的含芘无机盐培养基中,通过测定不同降解时间下芘的浓度,计算游离菌和固定化菌对芘的降解动力学。Monod方程是历史上首先提出并且被广泛接受的动力学方程[31]。其中底物降解速度与底物浓度之间的关系式为:

式中:v为底物降解速度;c为底物浓度;Ks为饱和常数,又称半速度常数。
当c>>Ks时,降解过程遵循零级反应动力学,底物与时间的关系式为:

当c<<Ks时,降解过程遵循一级反应动力学,底物与时间的关系式为:

式中:c为底物浓度;t为降解时间;k0和k1分别为零级和一级降解动力学降解速度常数;a和b为常数。
对游离菌和固定化菌对芘降解的数据分别按一级反应和零级反应方程形式拟合,线性拟合得出,其降解曲线均符合一级动力学模型,其中动力学方程、模型参数k及半衰期结果如表4所示。由表可以看出,固定化菌对芘的降解速率明显高于游离菌。

表4 游离菌和固定化菌对芘降解的一级动力学模型参数Table 4 Parameters and statistical indexes of the first-order kinetic model for pyrene degradation by free cells and immobilized microbial beads
2.4.3 固定化小球用于去除芘的使用次数
小球9个周期的10 d去除率重复率实验结果如图4所示。结果表明,前8个周期小球的去除率下降得非常缓慢,前8个周期去除率能达到80%以上,说明小球去除效果较好,可以重复使用。8个周期后小球的去除效率急剧下降,可能由于前8个周期的使用,使小球内降解菌的活性下降,载体材料的吸附性下降,吸水后小球内部空隙率变小等原因导致。
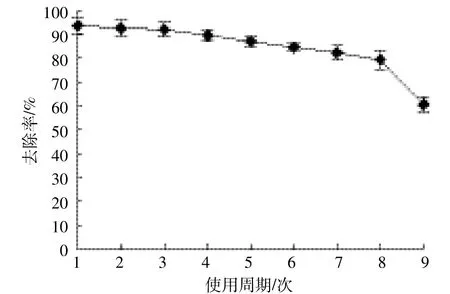
图4 固定化小球重复使用率Figure 4 Repeated times of immobilized beads
3 结论
(1)研究以由菲降解菌GY2B和芘降解菌GP3A融合而成的菌株F14为微生物进行固定化,确定了载体PVA和SA的最佳组合比例为8%和1%。
(2)以300、500℃和700℃制备的生物质炭为吸附剂,采用“吸附-包埋-交联”的复合式固定化方法制备固定化微生物小球,并比较了固定化小球的性能,其中700℃制备的生物质炭的固定化小球性能较好。
(3)与游离菌相比,固定化菌对芘的去除效率明显较高,且符合一级反应动力学规律;而固定化小球可以重复使用高达9次。
[1]Abdel-Shafy H I,Mansour M S M.A review on polycyclic aromatic hydrocarbons:Source,environmental impact,effect on human health and remediation[J].Egypt JPetrol,2015,3(11):1-17.
[2]Li X J,Tong D L,Graeme A,et al.Adsorption of pyrene onto the agricultural by-product:Corncob[J].Bull Environ Contam Toxicol,2016,96(1):113-119.
[3]Xu H X,Li X H,Sun Y Y,et al.Biodegradation of pyrene by free and immobilized cells of Herbaspirillum chlorophenolicum Strain FA1[J].Water Air Soil Pollut,2016,227(4):1-12.
[4]Wang S X,Li X J,Liu W,et al.Degradation of pyrene by immobilized microorganisms in saline-alkaline soil[J].Journal of Environmental Sciences,2012,24(9):1662-1669.
[5]Saurabh J S,Kannan P.Surfactant aided biodegradation of pyrene using immobilized cells of Mycobacterium frederiksbergense[J].International Biodeterioration&Biodegradation,2011,65(1):73-77.
[6]李 婧.以玉米秸秆吸附-包埋-交联的复合固定化方法固定微生物处理芘的研究[D].广州:华南理工大学,2012.LI Jing.Removal of pyrene by immobilized microorganism using preadsorption on corn stalk-embedding-crosslinking immobilization method[D].Guangzhou:South China University of Technology,2012.
[7]Muftah H E,Mourad A H,Riham S.Evaluation of the characteristics of polyvinyl alcohol(PVA)as matrices for the immobilization of Pseudomonas putida[J].International Biodeterioration&Biodegradation,2013,85:413-420.
[8]Wang J L,Quan X C,Han L P,et al.Microbial degradation of quinoline by immobilized cells of Burkholderiapickettii[J].Water Research,2002,36(9):2288-2296.
[9]童 乐,何丽媛,郭楚玲,等.以农作物秸秆固定化混合菌去除原油[J].环境工程学报,2016,10(5):2707-2713.TONG Le,HE Li-yuan,GUO Chu-ling,et al.Degradation of crude oil using mixed bacteria immobilized by straw[J].Chinese Journal of Environmental Engineering,2016,10(5):2707-2713.
[10]Park M R,Kim D J,Choi J W,et al.Influence of immobilization of bacterial cells and TiO2on phenol degradation[J].Water,Air and Soil Pollution,2013,224(3):1473.
[11]Xie H,Liu H Y,Xie Y Q,et al.Fabrication of a novel immobilization system and its application for removal of anthracene from soil[J].Biochemical EngineeringJournal,2015,97(6):8-16.
[12]Xie H,Chen Y J,Wang C,et al.The removal of fluoranthene by Agaricus bisporus immobilized in Ca-alginate modified by Lentinus edodes nanoparticles[J].RSC Advances,2015,5(56):44812-44823.
[13]胡金星,苏晓梅,韩慧波,等.固定化微生物技术修复多氯联苯污染土壤的应用前景[J].应用生态学报,2014,25(6):1806-1814.HU Jin-xing,SU Xiao-mei,HAN Hui-bo,et al.Application prospect about bioremediation of polychlorinated biphenyls-contaminated soil with immobilized microorganism technique:A review[J].Chinese Journal of Applied Ecology,2014,25(6):1806-1814.
[14]刘金苓,钟玉鸣,王丽娇,等.厌氧氨氧化微生物的吸附、包埋固定化效果初探[J].环境科学学报,2010,30(3):470-476.LIU Jin-ling,ZHONG Yu-ming,WANG Li-jiao,et al.Preliminary study on nitrogen removal with anaerobic ammonium oxidizing(ANAMMOX)bacteria immobilized in absorbent and entrapping materials[J].ActaScientiae Circumstantiae,2010,30(3):470-476.
[15]余美琼,杨金杯,陈文韬,等.改性蜂窝煤渣吸附Cr(Ⅵ)的动力学和热力学性能[J].环境工程学报,2013,7(12):4741-4747.YU Mei-qiong,YANG Jin-bei,CHEN Wen-tao,et al.Adsorption kinetics and thermodynamics of Cr(Ⅵ)on modified honeycomb-cinder[J].Chinese Journal of Environmental Engineering,2013,7(12):4741-4747.
[16]Sardar K,Muhammad W,Ding F H,et al.The influence of various biochars on the bioaccessibility and bioaccumulation of PAHs and potentially toxic elements to turnips(BrassicarapaL.)[J].Journal of Hazardous Materials,2015,300:243-253.
[17]Aabid H L,Ghulam R N,Mumtaz A G,et al.Biochar for sustainable soil health:A review of prospects and concerns[J].Pedosphere,2015,25(5):639-653.
[18]Deng F C,Liao C J,Yang C,et al.Enhanced biodegradation of pyrene by immobilized bacteria on modified biomass materials[J].International Biodeterioration and Biodegradation,2016,110:46-52.
[19]Cao Y N,Yang B S,Song Z H,et al.Wheat straw biochar amendments on the removal of polycyclic aromatic hydrocarbons(PAHs)in contaminated soil[J].Ecotoxicology and Environmental Safety,2016,130:248-255.
[20]Rajapaksha A U,Chen S S,Zhang M,et al.Engineered/designer biochar for contaminant removal/immobilization from soil and water:Potential and implication of biochar modification[J].Chemosphere,2016,148:276-291.
[21]Chen B L,Yuan M X,Qian L B.Enhanced bioremediation of PAH-contaminated soil by immobilized bacteria with plant residue and biochar as carriers[J].JSoils Sediments,2012,12(9):1350-1359.
[22]Chinedum A,Zaiton A M,Zahara I,et al.The impact of biochars on sorption and biodegradation of polycyclic aromatic hydrocarbons in soils:A review[J].Environ Sci Pollut Res,2015,22(5):3314-3341.
[23]Carlos G D,Irene A B,Enrique E.Combination of biochar amendment and mycoremediation for polycyclic aromatic hydrocarbons immobilization and biodegradation in creosote-contaminated soil[J].Journal of Hazardous Materials,2015,285:259-266
[24]Lu J,Guo C L,Zhang M L,et al.Biodegradation of single pyrene and mixtures of pyrene by a fusant bacterial strain F14[J].International Biodeterioration and Biodegradation,2014,87:75-80.
[25]Lu J,Guo C L,Li J,et al.A fusant of Sphingomonas sp.GY2B and Pseudomonas sp.GP3A with high capacity of degrading phenanthrene[J].World JMicrobiol Biotechnol,2013,29(9):1685-1694.
[26]卢 静.融合菌株F14的构建及其降解多环芳烃的性能研究[D].广州:华南理工大学,2012.LU Jing.Construction of fusant strain F14 and performance study on degrading PAHs[D].Guangzhou:South China University of Technology,2012.
[27]Huang R Y,Tian W J,Liu Q,et al.Enhanced biodegradation of pyrene and indeno(1,2,3-cd)pyrene using bacteria immobilized in cinder beads in estuarine wetlands[J].Marine Pollution Bulletin,2016,102(1):128-133.
[28]Nedal M,Abraham S,Isam S.Modeling the effect of immobilization of microorganisms on the rate of biodegradation of phenol under inhibitory conditions[J].Water Research,2010,44:5252-5259.
[29]Takayuki T,Kaoru I,Hiroyuki I,et al.Fabrication of poly(vinyl alcohol)hydrogel beads crosslinked using sodium sulfate for microorganism immobilization[J].Process Biochemistry,2011,46(2):566-571.
[30]Takayuki T,Kaoru I,Hiroyuki I,et al.A comparison of sodium sulfate,sodium phosphate,and boric acid for preparation of immobilized Pseudomonas putida F1 in poly(vinyl alcohol)beads[J].Polym Bull,2012,69(3):363-373.
[31]甄丽莎,谷 洁,胡 婷,等.石油烃类污染物降解动力学和微生物群落多样性分析[J].农业工程学报,2015,31(15):231-238.ZHEN Li-sha,GU Jie,HU Ting,et al.Kinetics of petroleum hydrocarbon degradation in soil and diversity of microbial community during composting[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(15):231-238.
