Parkin在肺鳞状细胞癌中的表达及其与临床病理特征的相关性研究
2018-03-24彭星辰四川大学华西医院头颈部肿瘤科四川成都610041
孙 羽,何 燕,彭星辰(四川大学华西医院头颈部肿瘤科,四川 成都 610041)
Parkin基因是在帕金森病的研究中被鉴定出来,近期的研究显示Parkin在多种肿瘤中发生缺失和突变[1,2],如宫颈癌(5.6%)、结肠直肠癌(2.4%~5.6%)、胃癌(4.6%)、皮肤黑色素瘤(3.5%)、肺腺癌(2.7%~3.1%)和子宫内膜样癌(2.1%)[3,4]。Parkin的缺失和突变会导致肿瘤的发生,提示Parkin为抑癌基因。目前多数关于Parkin与肺癌关系的研究是通过动物实验来实现,使用人类组织标本进行的研究偏少[3~6]。在本研究中,我们通过检测Parkin在肺鳞状细胞癌中的表达水平,分析其与肺鳞状细胞癌临床病理特征的关系,初步揭示Parkin在肺鳞状细胞癌中的作用。
1 材料与方法
1.1材料收集2016年1月至2017年1月在我院行手术切除并经术后病理确诊为肺鳞状细胞癌的60例患者的手术病理标本。纳入标准:①为单纯肺鳞状细胞癌的患者,未合并其他的恶性肿瘤;②符合临床诊断及病理诊断标准。其中男50例,女10例,年龄(57.5±12.5)岁,高、中、低分化的患者各20例,淋巴结转移患者31例,远处转移13例。试剂及仪器:Parkin抗体(Santa Cruz sc-32282,Santa Cruz Biotechnology);石蜡切片机(LEICA RM2255);电热恒温干燥箱(GZX-DH.300BS-Ⅱ,上海跃进医疗器械有限公司);低温生化培养箱(上海跃进医疗器械有限公司),染色机(Leica.Autostainer XL 四川泰运医疗器械有限公司)。
1.2方法将在病理科收集到的标本的石蜡块,进行连续切片,片厚约3.5 μm,常规HE染色用自动染色机(Leica.Autostainer XL)染色。免疫组织化学染色(为二步法):在70 ℃的烤箱中放置石蜡切片1 h;切片脱蜡:依次放入三瓶二甲苯中,每瓶浸泡10 min,再依次放入95%、95%、80%的乙醇中,每瓶浸泡2 min;依次用自来水和蒸馏水冲洗,每次20秒,用PBS缓冲液冲洗3次,每次3 min;用高温高压法修复组织:用高压锅加热EDTA PH8修复液,将切片放入沸腾的修复液中,待高压锅阀门喷气开始计时,修复时间持续3 min;用流水冲洗已停止喷气的高压锅,为其降温,再在室温中静置15 min;用PBS缓冲液冲洗切片3次,每次3 min;为清除内源性过氧化物酶,将切片浸泡在3%过氧化氢水溶液中5 min;8)用PBS缓冲液冲洗切片3次,每次3 min;擦干切片组织周围的液体,滴加一抗;放入4 ℃冰箱内过夜;用PBS缓冲液冲洗切片3次,每次3 min,甩掉一抗;滴加聚合物增强剂(流程及要求同之前的一抗),室温下孵育15~20 min;用PBS缓冲液冲洗切片3次,每次3 min;进行DAB显色,显色时间5 min左右;用苏木素复染细胞核,持续时间为30秒;分化、返蓝,并随机抽取几张切片镜下观察;梯度酒精脱水,二甲苯透明,中心树胶封片。
1.3免疫组化的结果判断标准在高倍光学显微镜下(×100倍)观察切片组织染色情况,组织的染色强度为0~3(即不存在、轻度、中度和强烈);被染色细胞的百分比也被得分为0~3分(即0分0%~5%;1分6%~25%;2分26%~50%;3分51%~100%),Parkin蛋白染色分数=组织的染色强度评分分数×被染色细胞百分比的评分分数。
1.4统计学方法应用GraphPad Prism 5统计软件数据分析。采用均数±标准差表示计量资料,多组样本比较采用非参数的方差分析,两两间的比较采用的非参数t检验。P< 0.05为差异有统计学意义。
2 结果
2.1不同分化程度的癌组织的Parkin表达在高、中、低分化的肺鳞状细胞癌的组织切片中Parkin蛋白的染色分数分别为(6.100±1.410)、(2.800±1.642)及(1±1.076),三组之间差异均有统计学意义(P< 0.0001),肺鳞癌的分化程度越低,Parkin蛋白的染色分数越低。
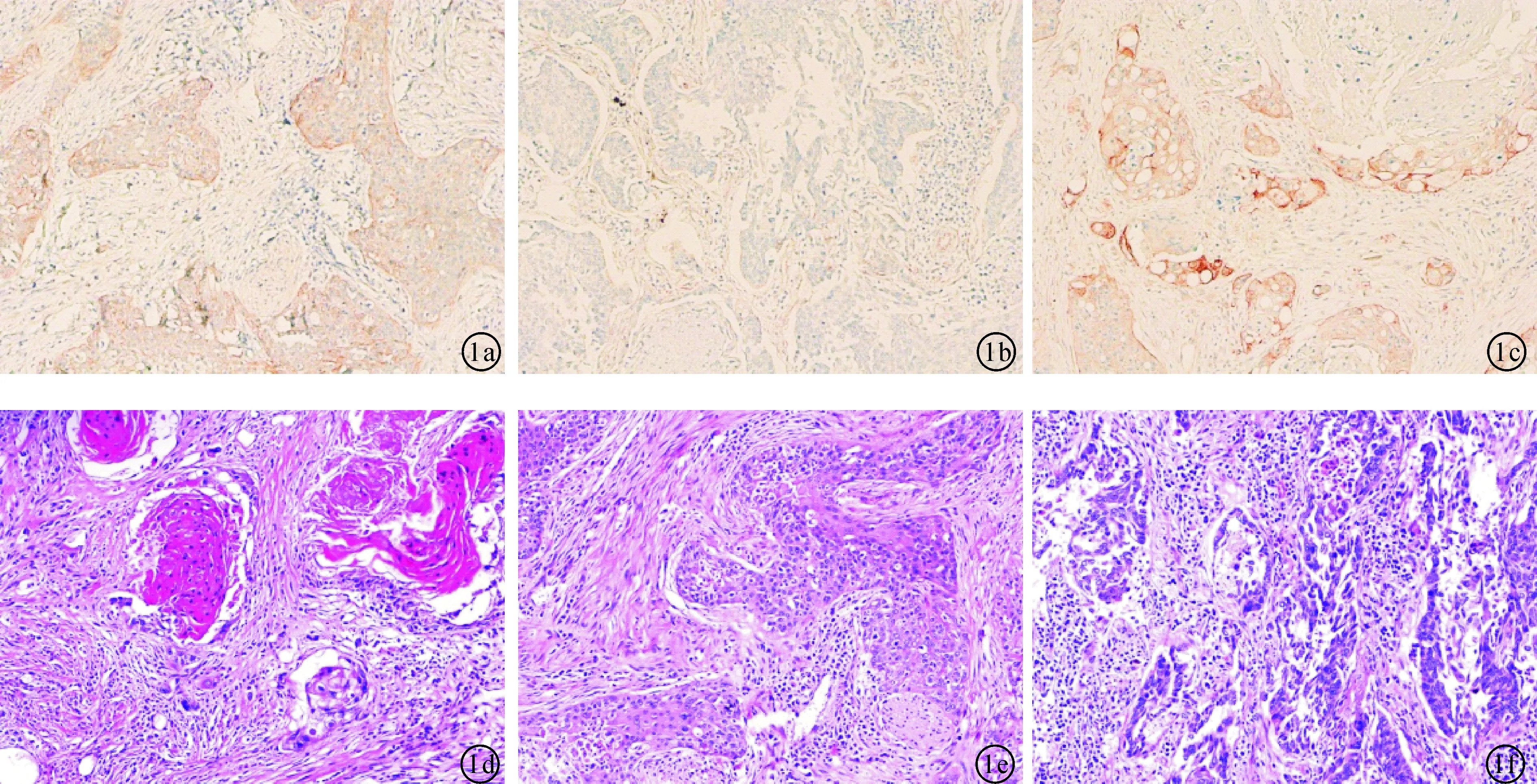
图1 肺鳞状细胞癌组织的病理染色(×100)a:高分化组的Parkin染色;b:中分化组的Parkin染色;c:低分化组的Parkin染色;d:高分化组的HE染色e:中分化组的HE染色;f:低分化组的HE染色。
2.2在肺鳞状细胞癌原发灶中Parkin表达水平与淋巴结转移的关系在淋巴结转移阳性组及阴性组中,Parkin蛋白在肺鳞状细胞癌原发灶中的染色分数分别(1.677±1.701),(5.103±2.059),t=7.046,df=58。淋巴结转移阳性组的Parkin蛋白在原发灶中的染色分数明显低于淋巴结转移阴性组,差异有统计学意义(P< 0.0001)。
2.3在肺鳞状细胞癌原发灶中Parkin染色分数与远处转移的关系在存在远处转移组及不存在远处转移组中,Parkin蛋白在肺鳞状细胞癌原发灶中染色分数分别为(0.462±0.776),(4.170±2.190),t=5.971,df=58。存在远处转移组的Parkin蛋白在原发灶中的染色分数明显低于无远处转移组,差异有统计学意义(P< 0.0001),存在远处转移组的Parkin蛋白在原发灶中的染色分数明显低于无远处转移组。
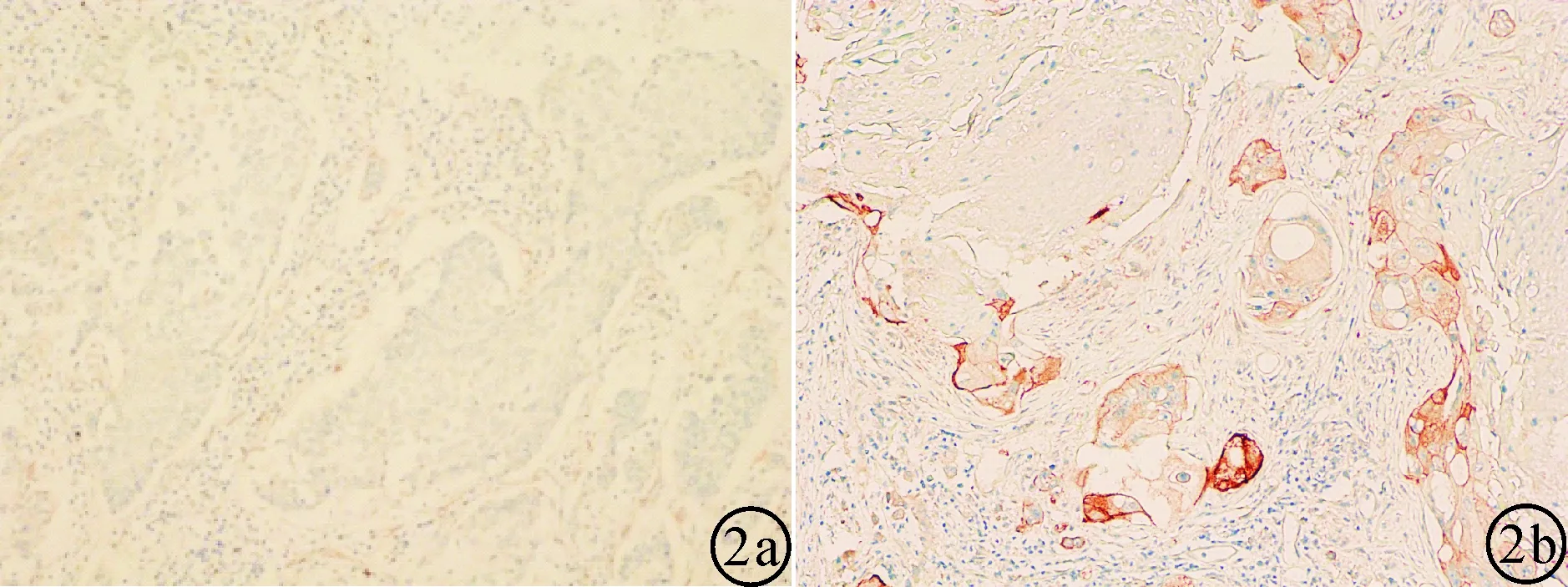
图2 在高倍光学显微镜下(*100倍)肺鳞状细胞癌原发灶中Parkin的免疫组化染色分数与淋巴结转移的关系。a:淋巴结转移阳性组;b:淋巴结转移阴性组。
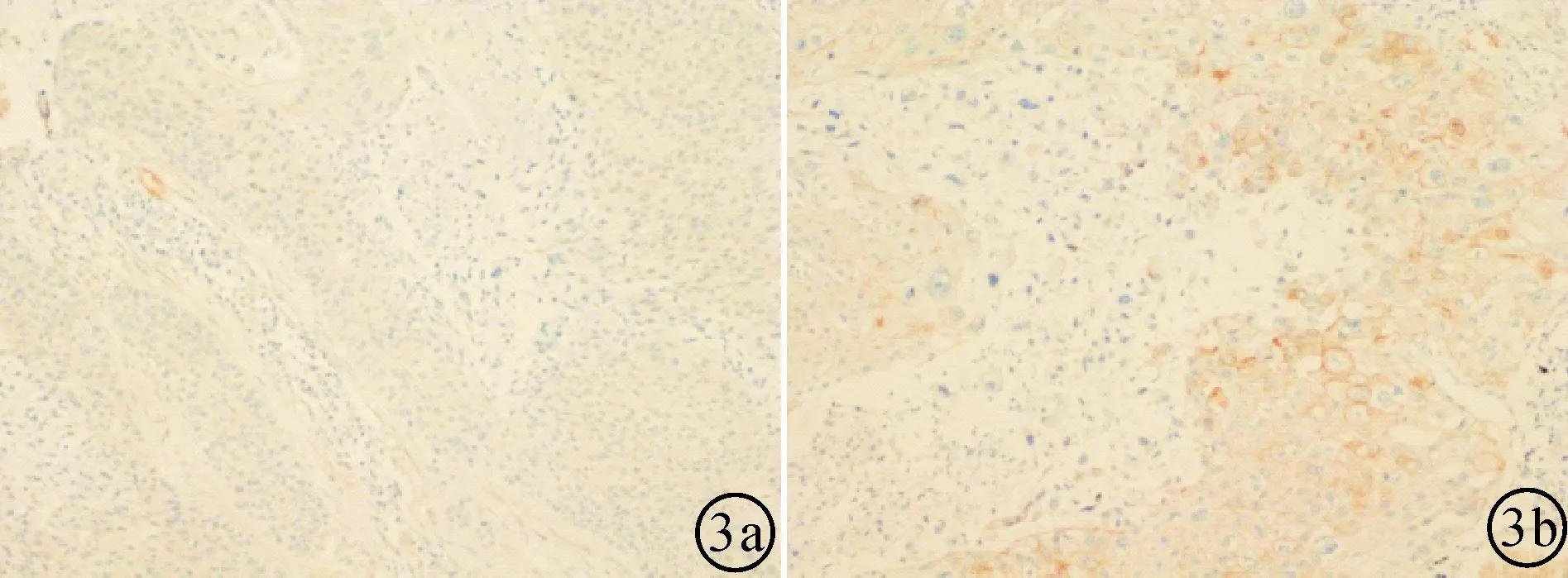
图3 在高倍光学显微镜下(*100倍)肺鳞状细胞癌原发灶中Parkin的免疫组化染色分数与远处转移的关系。a:远处转移组;b:无远处转移组。
3 讨论
我国肺癌的发病率及死亡率久居恶性肿瘤的第一位[7]。近些年针对肺癌治疗方面的研究发现,肺腺癌组织亚型中存在可治疗的分子靶点,针对这些靶点已经获准生产的药物,在治疗晚期肺癌上已取得令人瞩目和兴奋的进展[8,9]。但遗憾的是目前针对肺鳞状细胞癌或小细胞肺癌还没有发现可治疗的分子靶点[10]。而肺鳞状细胞癌又是肺癌中最常见的一种类型。发掘可用于药物研发的肺鳞状细胞癌新型生物靶点,将具有非常重要的意义。
目前多数研究是通过动物实验来阐明Parkin与肺癌的关系,使用人类组织标本的研究偏少[3~6]。本课题通过免疫组化检测Parkin在人肺鳞状细胞癌中的表达水平,分析其与肺鳞状细胞癌临床病理特征的关系,初步揭示Parkin在肺鳞状细胞癌中的作用。本研究结果显示肺鳞状细胞癌的分化程度越低,Parkin蛋白的染色分数越低;淋巴结转移阳性组的Parkin蛋白在原发灶中的染色分数明显低于淋巴结转移阴性组;存在远处转移组的Parkin蛋白在原发灶中的染色分数明显低于无远处转移组。
既往的研究发现在恶性肿瘤中频繁发生Parkin的缺失或突变[1,2]。如Poulogiannis等将敲除Parkin的3号外显子的老鼠与APC/min的老鼠进行杂交,发现肠道腺瘤的发病率升高及腺瘤发生时间提前[11]。Fujiwara等通过敲除Parkin的3号外显子繁育出Parkin-/-的小鼠,与野生型小鼠相比,Parkin小鼠更容易发生原发性肝细胞癌(HCC)[12]。Sun等利用小分子的干扰RNA(siRNAs)来抑制了小鼠细胞内的Parkin表达,发现Parkin表达的缺失刺激了胰腺癌细胞的增殖和扩散[13]。上述研究均表明Parkin具有抑制肿瘤的功能,支持本课题的观点。
综上所述,肺鳞状细胞癌的分化程度越低,Parkin蛋白的染色分数越低;淋巴结转移阳性组的Parkin蛋白在原发灶中的染色分数明显低于淋巴结转移阴性组;存在远处转移组的Parkin蛋白在原发灶中的染色分数明显低于无远处转移组。揭示了Parkin可能可以抑制肺鳞状细胞癌的发生、发展,为Parkin基因治疗在肺鳞状细胞癌中的使用提供了基础研究的数据。
[1] Kitada,Asakawa S,Hattpri N,et al.Mutation in the parkin gene cause autosomal recessive juvenile parkinsonism[J].Nature,1998,392:605-608.
[2] Quinsay MN,Lee Y,Rikka S,et al.Bnip3 mediates permeabilization of mitochondria and release of cytochrome c via a novel mechanism[J].J Mol Cell Cardio,2010,48(6):1146-1156.
[3] Cerami E,Gao J,Dogrusoz U,et al.The cBio cancer genomics portal:an open platform for exploring multidimensional cancer genomics data[J].Cancer Discov,2012,2:401-404.
[4] Gao J,Aksoy BA,Dogrusoz U,et al.Integrative analysis of complex cancer genomics and clinical profiles using the cBioPortal[J].Sci Signal,2013,6(269):pl1.
[5] D’Amico AG,Maugeri G,Magro G,et al.Expression pattern of Parkin isoforms in lung adenocarcinomasl[J].Tumor Biology,2015,36(7):5133-5141.
[6] SeungBaek Lee,Jun She,Bo Deng,et al.Multiple-level validation identifies PARK2 in the development of lung cancer and chronic obstructive pulmonary diseasel[J].Oncotarget,2016,7 (28):44211-44223.
[7] Wangqing Chen,Rongshou Zheng MPH,Peter D,et al.cancer statistics in China,2015[J].CA,2016,2(66):115-132.
[8] Reck M,Heigener DF,Mok T,et al.Management of non-small-cell lung cancer:recent developments[J].Lancet,2013,382:709-719.
[9] Mok TS.Personalized medicine in lung cancer:what we need to know[J].Nat Rev Clin Oncol,2011,23;8(11):661-668.
[10]Byers LA,Rudin CM.Small cell lung cancer:Where do we go from here [J].Cancer,2015,121:664-672.
[11]Poulogiannis G,McIntyre RE,Dimitriadi M,et al.PARK2 deletions occur frequently in sporadic colorectal cancer and accelerate adenoma development in Apc mutant mice[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107:15145-15150.
[12]Fujiwara M,Marusawa H,Wang HQ,et al.Parkin as a tumor suppressor gene for hepatocellular carcinoma[J].Oncogene,2008,27:6002-6011.
[13]Sun XD,Liu M,Hao JH,et al.Parkin deficiency contributes to pancreatic tumorigenesis by inducing spindle multipolarity and misorientation[J].Cell Cycle,2013,12:1133-1141.
