不同化学试剂和处理方式加倍小麦单倍体植株的效果
2018-03-24尹米琦张双喜范春捆王坤杨王静王轲杜丽璞叶兴国
尹米琦,张双喜,范春捆,王坤杨,王静,王轲,杜丽璞,叶兴国
不同化学试剂和处理方式加倍小麦单倍体植株的效果
尹米琦1,张双喜2,范春捆3,王坤杨1,王静1,王轲1,杜丽璞1,叶兴国1
(1中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程,北京 100081;2宁夏农林科学院农作物研究所,银川 750105;3西藏自治区农牧科学院农业研究所,拉萨 850032)
【目的】长期以来,小麦单倍体植株染色体加倍主要采用移栽前秋水仙素溶液通气浸泡分蘖节方法,该方法存在操作复杂、污染环境等问题,而且秋水仙素毒性较强、用量较大、价格较高。本研究的目的是建立小麦单倍体植株简便、安全、高效的加倍方法,寻找可以替代秋水仙素用于小麦单倍体植株加倍的化学试剂。【方法】通过小麦品系Fielder花药培养,小麦品种科农199、新春9号和小麦品系CB037、中国春(CS)与玉米自交系郑58杂交获得小麦单倍体植株,小麦品系中国春与甘肃黑麦杂交获得小麦-黑麦双单倍体植株,利用0、5、10和20 mmol·L-1秋水仙素溶液分别采取分蘖节加注、叶片涂抹和培养基表面添加方式对不同来源小麦单倍体植株进行加倍,并采用培养基表面添加0、30、60和120 μ·L-1甲基胺草磷、炔苯酰草胺和氟乐灵溶液对小麦单倍体植株及小麦-黑麦双单倍体植株加倍,比较不同加倍方法和3种除草剂的加倍效果,确定各个加倍试剂的适宜浓度。【结果】不同浓度秋水仙素溶液(0、5、10和20 mmol·L-1)加注小麦与玉米杂交单倍体植株分蘖节部位对小麦单倍体植株不具有加倍效果,不宜在小麦单倍体植株加倍中采用。10 mmol·L-1秋水仙素溶液涂抹拔节期小麦单倍体植株叶片的加倍率为7.7%,其他3个秋水仙素溶液浓度没有加倍成功,也不适合小麦单倍体植株加倍。培养基表面添加4个浓度秋水仙素溶液处理小麦花药培养单倍体植株的加倍率分别为26.7%、42.9%、73.3%和85.7%。表明培养基表面添加秋水仙素溶液对小麦单倍体植株的加倍效果最好,适宜浓度至少为20 mmol·L-1。培养基表面添加0、30、60和120 μmol·L-1炔苯酰草胺溶液处理小麦与玉米杂交单倍体植株的加倍率分别为0、0—57.1%、28.6%—75.0%和0—100%,其他2种除草剂处理小麦与玉米杂交单倍体植株没有成功;培养基表面添加120 μmol·L-1炔苯酰草胺溶液处理小麦与黑麦杂交双单倍体植株的加倍率为9.0%,添加其他3个浓度炔苯酰草胺溶液和其他3种加倍试剂均没有结实。【结论】60—120 μmol·L-1浓度炔苯酰草胺溶液对小麦单倍体植株加倍具有较好效果,培养基表面添加适宜浓度秋水仙素和炔苯酰草胺溶液对小麦单倍体植株加倍有效,而且简单易行。
小麦;单倍体植株;远缘杂交;花药培养;加倍试剂
0 引言
【研究意义】小麦是世界重要的粮食作物之一,培育优良品种是提高小麦产量的关键措施[1-2]。在众多小麦育种方法中,单倍体育种具有基因纯合速度快、育种年限短、提高育种效率的优势。小麦单倍体植株诱导及其染色体加倍不但是培育小麦新品种的关键技术,也是用于小麦遗传分析和基因定位中创建DH群体的重要方法。【前人研究进展】小麦单倍体植株可以通过小麦与玉米杂交后染色体排除[3-4]、花药培养[5-7]和小孢子培养[8-12]3种途径获得。其中,花药培养具有强烈的基因型依赖性,多数小麦品种或F1杂种的花药培养难以获得愈伤组织和再生植株;虽然小孢子培养对基因型的依赖性较小,但试验操作复杂,容易污染,周期较长;小麦与玉米杂交方式诱导单倍体植株几乎不受基因型的限制,操作容易,周期较短,但成胚率较低[3-4]。在获得植株的倍性方面,小麦与玉米杂交后通过幼胚拯救获得单倍体植株几乎不能自然加倍[4],花药培养方式获得单倍体植株的自然加倍率20%—30%[13],小孢子培养方式获得单倍体植株的自然加倍率30%—40%[11]。为了确保纯合二倍体植株的获得并提高单倍体植株的加倍效率,需要利用秋水仙素(cochicine)对幼苗或愈伤组织进行染色体加倍[14-15]。迄今为止,对小麦单倍体植株进行染色体加倍利用最多的方法是苗期分蘖节处理加倍,即将幼苗从培养基中取出,放入含秋水仙素0.02%—0.1%的水溶液中,在通气泵介导的供氧条件下处理5—10 h,然后取出幼苗,流水冲洗3—4 h,最后移栽在花盆中。该方法的加倍率一般为50%—60%,加倍植株生长发育正常[16-19]。利用0.2%秋水仙素对小麦单倍体植株进行5 h浸根处理,加倍率也只有37.5%[17]。需要说明的是,这两种方法操作比较繁琐,步骤较多,容易污染人体和水源。为了提高单倍体植株加倍效率,减少秋水仙素对环境的污染和人体接触秋水仙素的机率,一些实验室也探索过在花药培养愈伤组织诱导培养基中加入0.02%—0.1%的秋水仙素,单倍体植株染色体加倍率30%—60%[16-17,19],不能满足小麦细胞工程育种的需要。另外,秋水仙素是一种毒性比较强的化学试剂,不但对操作人员的安全性不高,而且也容易导致水源污染,需要寻找一种安全、无残留、易降解的加倍试剂替代秋水仙素。在玉米诱导系诱导的单倍体植株加倍中,利用0.04%的甲基胺草磷(amiprophos-methyl)除草剂溶液在三叶期至五叶期滴心处理,能够获得20%—30%的加倍率(对照处理加倍率为0)[20]。【本研究切入点】目前,小麦单倍体植株染色体加倍普遍采用移栽前秋水仙素溶液通气浸泡分蘖节方法,存在操作复杂、环境污染、毒性较强、成本较高等问题。另外,甲基胺草磷、炔苯酰草胺(propyzamide)和氟乐灵(trifluralin)等除草剂对单倍体植株的加倍作用和地上部施用加倍方法仅在玉米等少数几种植物中有报道,在小麦中还没有尝试。鉴于目前小麦单倍体加倍技术存在的一些缺点,需要建立一种简便、高效、安全的单倍体植株加倍方法。【拟解决的关键问题】本研究通过对甲基胺草磷、氟乐灵、炔苯酰草胺和秋水仙素等化学试剂加倍小麦单倍体植株的方法和效果进行比较,确定高效加倍小麦单倍体植株的适宜方法和试剂及其用量,为提高小麦单倍体植株加倍效率和加倍单倍体育种效率奠定基础。
1 材料与方法
1.1 植物材料
所用的普通小麦(,AABBDD,2n=6X=42)材料为科农199、中国春(CS)、新春9号、Fielder和CB037,均由中国农业科学院作物科学研究所小麦遗传转化实验室保存,甘肃黑麦(,RR,2n=2X=14)由北方民族大学任贤教授提供,玉米(,2n=2X=20)自交系郑58花粉由中国农业科学院作物科学研究所刘允军博士提供。
1.2 化学试剂和加倍处理设置
染色体加倍化学药剂秋水仙素、甲基胺草磷、炔苯酰草胺和氟乐灵购自西格玛-奥德里奇公司(纯度均为99%以上)。秋水仙素直接用蒸馏水溶解,配置4个加倍处理浓度为0、5、10和20·L-1,4℃低温保存。甲基胺草磷、炔苯酰草胺和氟乐灵先用无水乙醇加1%吐温20(TWEEN-20)充分溶解,再加水溶解到适宜浓度,配置4个加倍处理浓度为0、30、60和120 μ·L-1,4℃低温保存。
1.3 小麦单倍体诱导方法
1.3.1 小麦与玉米杂交 2013年9月将小麦品种科农199和新春9号、小麦品系CB037和中国春种植在中国农业科学院作物科学研究所试验农场,越冬前覆盖塑料布,返青期揭开塑料布。2014年2月将玉米自交系郑58分期种植在中国农业科学院作物科学研究所温室。小麦进入抽穗期后,选择开花前一天的麦穗,人工去雄、套袋,3 d后收集玉米新鲜花粉授于去雄后的小麦,分别于授粉后24和48 h用含2,4-二氯苯氧乙酸(2,4-D)100 mg·L-1的水溶液喷洒杂交穗各1次;授粉后16—17 d取样杂交穗,收集幼嫩籽粒,70%酒精表面消毒1 min,15%次氯酸钠灭菌20 min,无菌水冲洗5次;在解剖镜下取出小麦单倍体幼胚,胚轴端向上接种至1/2MS培养基(1/2MS + 20 g·L-1蔗糖 + 2.4 g·L-1植物凝胶,pH 5.8)上,每个培养管接种3—4个幼胚;先在黑暗、25℃条件下培养3 d,然后在光照、25℃条件下培养20 d,获得单倍体植株[21-22]。
1.3.2 小麦花药培养 2013年9月将小麦品系Fielder种植在中国农业科学院作物科学研究所试验农场,越冬前覆盖塑料布,返青期揭开塑料布。在小麦孕穗期取处于单核靠边期的幼穗,用塑料袋包裹后置于4℃冰箱中预处理3 d。接种前用70%酒精充分擦拭叶鞘部位进行表面消毒,在洁净工作台中用手剥去叶鞘,然后用镊子剥去颖壳,取出花药接种在W14愈伤组织诱导培养基(W14 + 2 mg·L-12,4-D + 0.5 mg·L-1激动素(KT)+ 100 g·L-1蔗糖 + 2.4 g·L-1植物凝胶,pH 5.8)上,先在生化培养箱中30℃、黑暗条件下预培养3 d,然后转到28℃、黑暗下培养30—45 d。将产生的直径1 mm左右的愈伤组织转移到1/2 MSNK分化培养基(1/2MS+0.5 mg·L-1萘乙酸(NAA)+1 mg·L-1KT + 20 g·L-1蔗糖 + 2.4 g·L-1植物凝胶,pH 5.8)上,在(25±1)℃、光照条件(3 500 Lx,16 h)下培养20—25 d分化单倍体植株[23-24]。
1.3.3 小麦与黑麦杂交 2015年2月将小麦品系中国春和黑麦品系甘肃黑麦种植在中国农业科学院作物科学研究所网室,甘肃黑麦每5 d种植一期,共种植4期。中国春抽穗时及时人工去雄、套袋,3 d后授以黑麦花粉,30 d后直接收获杂交籽粒,室温下放置通过休眠[22, 25]。然后,杂交籽粒用70%酒精表面消毒2 min,15%次氯酸钠灭菌20 min,无菌水冲洗5次,取出成熟胚,胚轴端向上接种至1/2MS培养基(1/2MS + 20 g·L-1蔗糖 + 2.4 g·L-1植物凝胶,pH 5.8)上,每个培养管接种4—5个成熟胚,在光照、25℃条件下培养20 d,获得双单倍体植株。
1.4 染色体加倍方法
1.4.1 小麦单倍体植株分蘖节加注秋水仙素 离体培养的小麦单倍体幼苗高度8—10 cm、根系健壮时,移栽到盛有草炭土(大汉园艺产品,货号为KLASMAN422)的花盆(直径25 cm,高度20 cm;每个花盆中均匀掺入20 g奥绿缓释肥)中,每个花盆移栽3—4株,移栽后浇250 mL自来水,每株苗用透光塑料水杯罩住,放入5—8℃、光照条件的低温生长室中缓苗。移栽10 d后移去水杯,15 d后将花盆移至25℃、光照条件的植物生长室中生长。在生长室中生长7 d左右时,用微量移液器在每株植株分蘖节部位加注2 mL不同浓度(0、5、10和20·L-1)的秋水仙素溶液。24 h后每个花盆中浇250 mL自来水,每3 d浇一次。成熟期调查结实性,收获后进行细胞遗传学检查,判别染色体加倍效果。
1.4.2 小麦单倍体植株叶片涂抹秋水仙素 离体培养的小麦单倍体幼苗高度8—10 cm、根系健壮时,移栽到温室中。拔节期用棉签蘸取不同浓度的秋水仙素溶液(0、5、10和20·L-1),反复涂抹新生叶片中部。成熟期调查结实性,收获后进行细胞遗传学检查,判别单倍体植株染色体加倍效果。
1.4.3 小麦单倍体植株培养基表面添加化学试剂 离体培养的玉米花粉诱导的小麦单倍体植株和小麦与黑麦杂交产生的小麦-黑麦双单倍体植株在试管中生长健壮后(苗高8—10 cm,根系健壮),用微量移液器向每个试管中的培养基表面加入2 mL不同浓度秋水仙素溶液(0、5、10和20·L-1)和甲基胺草磷、炔苯酰草胺及氟乐灵溶液(0、30、60和120 μ·L-1,处理24 h后流水冲洗30 s。玉米花粉诱导的小麦单倍体植株移栽到花盆(基质为KLASMAN422,每个花盆中均匀掺入20 g奥绿缓释肥),在25℃生长室中生长;小麦-黑麦双单倍体植株移栽到温室,生长期间温度20—28℃。成熟期调查结实性,收获后进行细胞遗传学检查,判别染色体加倍效果。
1.5 根尖细胞染色体制片
小麦单倍体试管苗移栽前取1—2 cm长度的根尖,成熟小麦种子萌发处理3—4 d后取相同长度的根尖,冰水处理24 h,浸泡在3﹕1的酒精与乙酸溶液中固定24 h,放入95%酒精中保存。经固定的根尖用1 N HCl在60℃下水解14 min,然后用醋酸洋红进行染色,在显微镜下观察单倍体植株染色体并拍照。
2 结果
2.1 分蘖节加注秋水仙素对小麦单倍体植株加倍效果的影响
从小麦品种科农199与玉米自交系郑58杂交后的40个麦穗上收集了506个幼嫩籽粒,共接种单倍体幼胚43个,获得31株单倍体植株(图1)。单倍体植株移栽后生长7 d左右时,用微量移液器在每株植株分蘖节部位加注2 mL浓度分别为0、5、10和20·L-1秋水仙素溶液进行加倍处理,每个浓度水平处理7—8株。结果表明,不同浓度秋水仙素溶液处理的小麦单倍体植株都没有结实(表1),与不加倍处理(对照)的结果相同,表明秋水仙素溶液加注分蘖节部位对小麦单倍体植株不具有加倍效果。
2.2 叶片涂抹秋水仙素对小麦单倍体植株加倍效果的影响
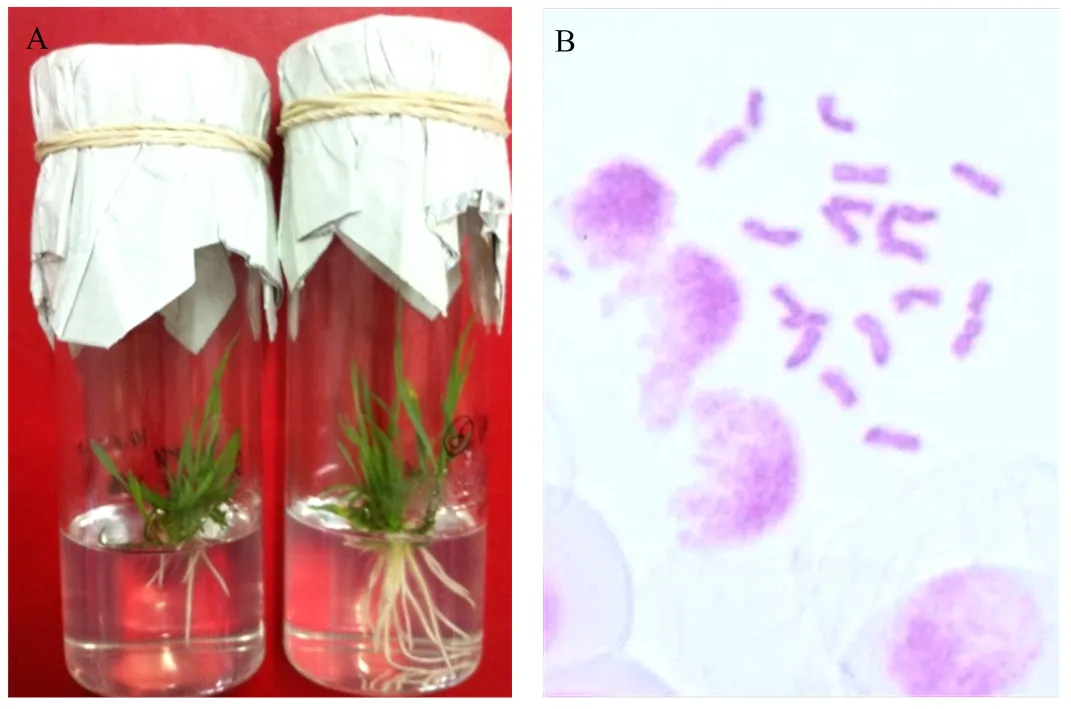
小麦品种新春9号与玉米自交系郑58杂交56穗,收集620个幼嫩籽粒,接种单倍体幼胚62个,获得了49株单倍体植株(图2)。移栽到温室中生长至拔节后期时,分别用浓度为0、5、10和20·L-1秋水仙素溶液涂抹小麦单倍体植株上部叶片进行加倍处理,每个浓度水平处理12—13株。经结实性调查和细胞学检测(图2),10·L-1秋水仙素浓度处理的小麦单倍体植株有1株结实,加倍率为7.7%;0、5和20·L-1秋水仙素浓度处理和对照处理的单倍体植株都没有结实,加倍率为0(表2)。表明秋水仙素溶液涂抹小麦单倍体植株叶片虽有加倍效果,但加倍效果很差。

表1 不同浓度秋水仙素溶液分蘖节加注方法小麦单倍体植株的加倍效果
A:幼胚拯救培养获得的单倍体植株;B:单倍体植株染色体组成(n=21)

表2 不同浓度秋水仙素溶液涂抹小麦单倍体植株的加倍效果
2.3 培养基表面添加秋水仙素对小麦单倍体试管植株加倍效率的影响
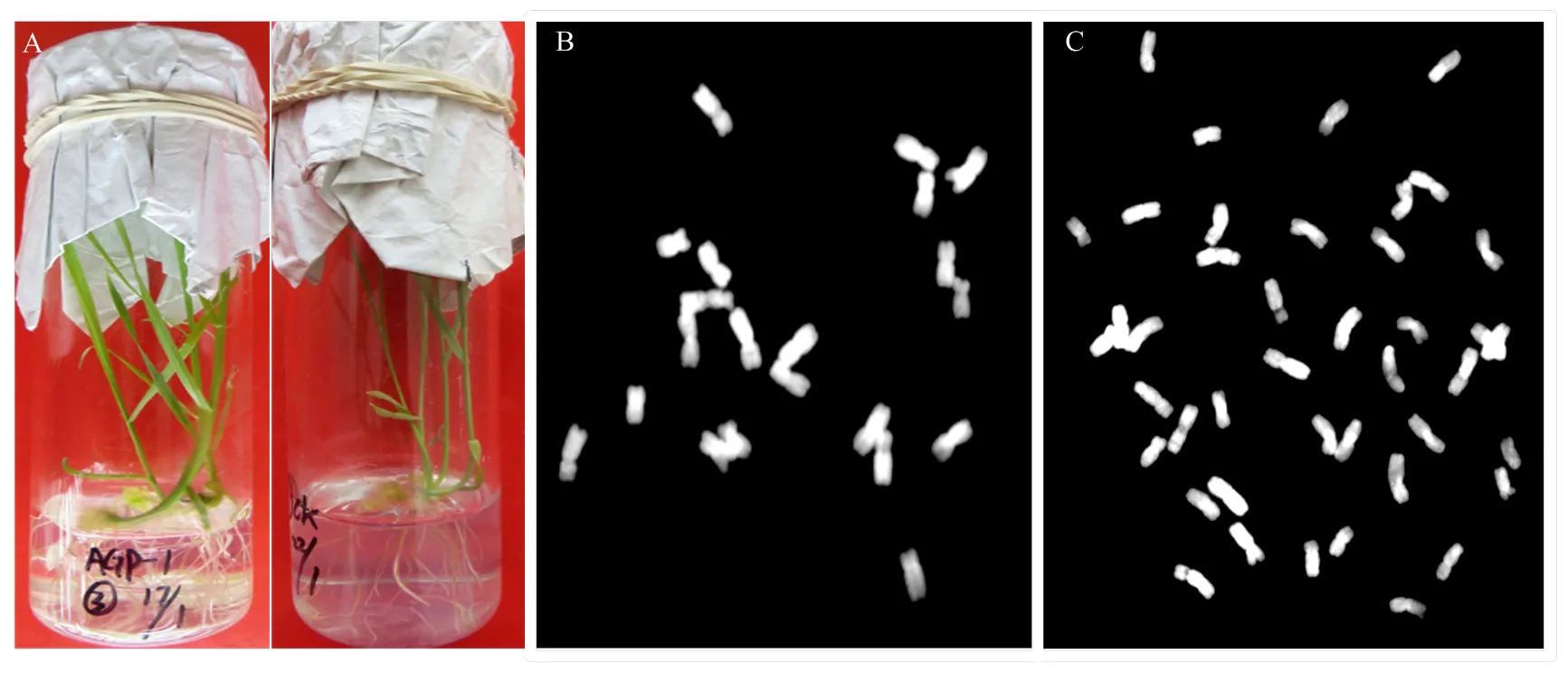
对小麦品系Fielder进行花药培养,获得51株单倍体植株。试管苗生长足够健壮时,在培养基表面添加浓度为0、5、10和20·L-1的秋水仙素溶液进行加倍处理,每个浓度水平处理7—15株。经结实性调查和细胞学检测(图3),秋水仙素溶液4个浓度处理Fielder花药培养单倍体植株的加倍率分别为26.7%、42.9%、73.3%和85.7%(表3)。结果表明,随着秋水仙素的增加,单倍体植株染色体加倍率提高;与玉米花粉诱导的单倍体相比,来源于花药培养的单倍体植株有一定程度的自然加倍率。
A:幼胚拯救培养获得的单倍体植株;B:单倍体植株染色体组成(n=21);C:加倍单倍体植株染色体组成(2n=42)
2.4 培养基表面添加不同除草剂对小麦单倍体试管植株加倍效果的影响
2.4.1 培养基表面添加不同除草剂对小麦与玉米杂交单倍体植株加倍效果的影响 小麦品系中国春与玉米自交系郑58种杂交获得118株单倍体植株,小麦品系CB037与玉米自交系郑58种杂交获得28株单倍体植株。试管苗生长足够健壮时,在培养基表面添加浓度为30、60和120 μ·L-1甲基胺草磷、炔苯酰草胺和氟乐灵溶液进行染色体加倍,同时设置不加倍处理做为对照。植株成熟后经结实性调查和细胞学检测,对照处理没有结实,3个浓度甲基胺草磷和氟乐灵溶液处理中国春单倍体植株都没有结实,3个浓度炔苯酰草胺溶液处理中国春单倍体植株的加倍率分别为0、28.6%和0,3个浓度炔苯酰草胺溶液处理CB037单倍体植株的加倍率分别为57.1%、75.0%和100%(表4)。结果表明,培养基表面添加60 μ·L-1炔苯酰草胺溶液对中国春与玉米杂交单倍体植株具有加倍效果,30—120 μ·L-1炔苯酰草胺溶液对CB037与玉米杂交诱导的小麦单倍体植株具有加倍效果,另外2种除草剂各种浓度对小麦与玉米杂交产生的小麦单倍体植株都不具有加倍效果。

A:花药愈伤组织诱导;B:单倍体植株;C:单倍体植株染色体组成(n=21);D:加倍单倍体植株染色体组成(2n=42)

表3 培养基表面添加不同浓度秋水仙素溶液后小麦花药培养单倍体植株加倍效果
表4 不同浓度与种类除草剂处理不同小麦基因型与玉米杂交诱导小麦单倍体植株加倍情况
2.4.2 培养基表面添加不同加倍试剂对小麦与黑麦杂交双单倍体植株加倍效果的影响 小麦品系中国春与甘肃黑麦杂交后收获种子,室温下放置2个月后将成熟胚进行离体培养直接成苗。试管苗生长比较健壮时,在培养基表面添加浓度为30、60和120 μ·L-1甲基胺草磷、炔苯酰草胺和氟乐灵溶液,以及浓度为5、10和20·L-1秋水仙素溶液进行染色体加倍,同时设置不加倍处理做为对照。经结实性调查和细胞学检测(图4),对照处理没有结实,3个浓度甲基胺草磷、氟乐灵和秋水仙素溶液处理中国春与甘肃黑麦杂交双单倍体植株都没有结实,30和60 μ·L-1炔苯酰草胺溶液处理双单倍体植株也没有结实,120 μ·L-1炔苯酰草胺溶液处理双单倍体植株的加倍率为9.0%(表5)。

表5 不同种类与浓度的化学试剂处理中国春与甘肃黑麦杂交双单倍体植株加倍情况
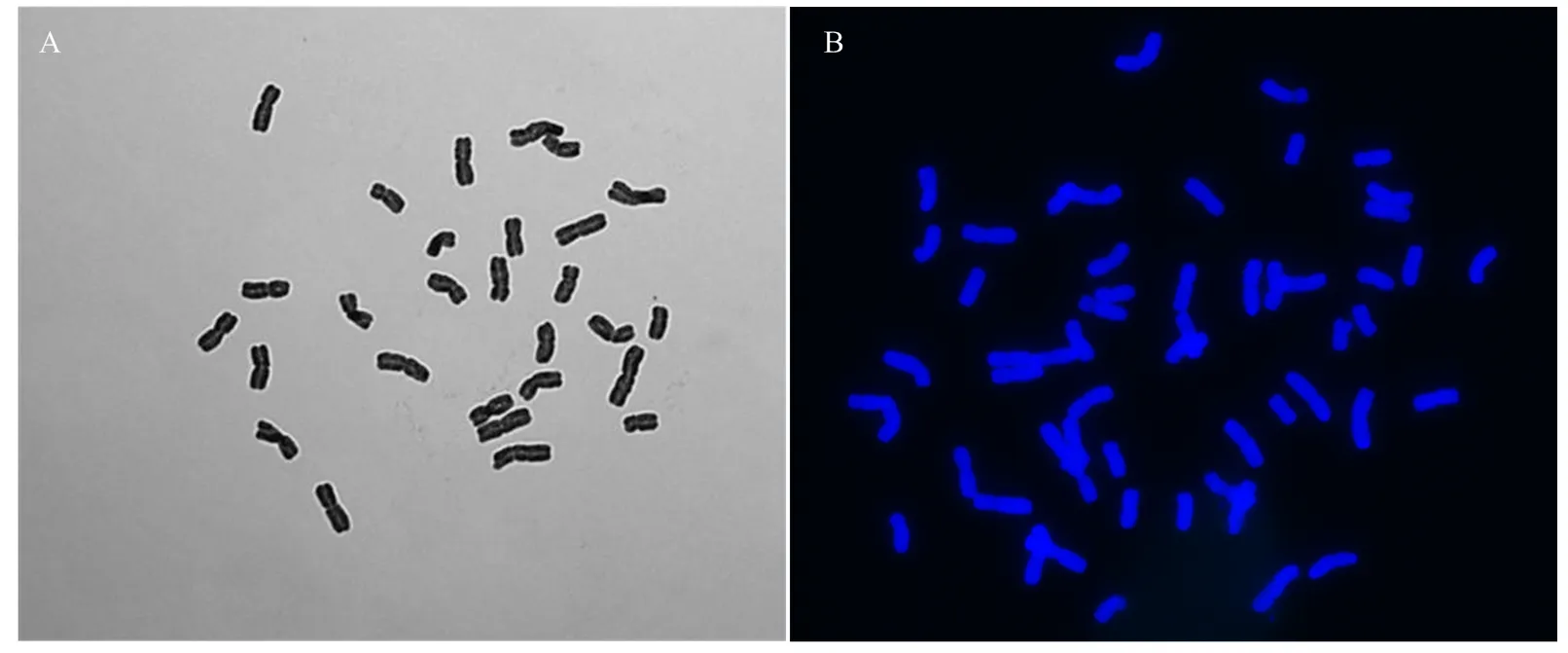
A:中国春与甘肃黑麦杂交植株染色体数目(n=28);B:中国春与甘肃黑麦杂交种加倍后染色体数目(2n=56)
3 讨论
秋水仙素诱导染色体加倍的作用机制已比较清楚,即抑制处于有丝分裂中期细胞中纺锤丝的形成[26],复制的染色体没有分离。相对而言,关于甲基胺草磷、氟乐灵、炔苯酰草胺等除草剂诱导染色体加倍机理的研究还不够明确。研究表明,甲基胺草磷和氟乐灵抑制了细胞微管的组装,干扰了有丝分裂的正常进行,具有一定加倍效果[27];甲基胺草磷阻碍纺锤丝的形成,促进细胞微核的产生[28-29];炔苯酰草胺具有阻止细胞有丝分裂启动和纺锤丝形成的双重作用,将细胞分裂停留在中期[30],具有较好的加倍效果。在加倍玉米花粉来源单倍体愈伤组织的研究中发现,炔苯酰草胺能加倍玉米染色体[31]。在玉米单倍体植株三叶期至五叶期利用不同浓度除草剂(甲基胺草磷、炔苯酰草胺及氟乐灵)滴心处理进行染色体加倍,发现3种除草剂浓度20—160 mmol·L-1都有加倍效果,其中,80 mmol·L-1甲基胺草磷加倍效果最好,且对不同玉米自交系单倍体植株的加倍效果存在显著差异[20]。
本研究中,利用不同浓度秋水仙素溶液涂抹小麦与玉米杂交产生小麦单倍体植株拔节后期新生叶片,仅10·L-1秋水仙素处理获得了7.7%的加倍率,其他处理没有发现结实植株。为了摸索简易、高效加倍单倍体植株的方法,用培养基表面添加不同浓度秋水仙素溶液对小麦与玉米杂交产生小麦单倍体植株移栽后进行分蘖节加注处理,没有获得结实植株。同时,用不同浓度秋水仙素溶液对小麦花药培养单倍体植株试管苗进行培养基表面添加处理,10和20·L-1秋水仙素浓度处理获得了70%以上的加倍率,高于目前报道的分蘖节浸泡加倍方法[11, 16-19]。表明培养基表面添加秋水仙素加倍小麦单倍体植株效果理想,叶片涂抹秋水仙素加倍小麦单倍体植株效果很差,分蘖节加注秋水仙素对小麦单倍体植株不具有加倍效果。培养基表面添加秋水仙素还具有操作简单、环境污染少的优点。
为了寻找加倍小麦单倍体植株的环境友好型加倍试剂,参考玉米中的研究结果,利用不同浓度甲基胺草磷、炔苯酰草胺、氟乐灵及秋水仙素溶液分别对小麦与玉米杂交产生的小麦单倍体植株和小麦与黑麦杂交产生的双单倍体植株进行了培养基表面添加处理,30—120 μmol·L-1炔苯酰草胺处理CB037与玉米杂交产生的小麦单倍体植株获得了57.1%—100%的加倍率,处理中国春与玉米杂交产生的小麦单倍体植株仅120 μmol·L-1炔苯酰草胺浓度获得了28.6%的加倍率,甲基胺草磷和氟乐灵不同浓度处理均没有加倍成功,表明炔苯酰草胺对小麦单倍体植株具有加倍效果,60—120 μmol·L-1炔苯酰草胺是培养基表面添加方式加倍小麦单倍体植株的适宜浓度,这与惠国强等[20]在玉米中获得的结果不完全一致。利用炔苯酰草胺加倍中国春和CB037单倍体植株的加倍效果存在显著差异,不同小麦基因型间加倍效率的差异可能与遗传因素有关,这与除草剂加倍玉米单倍体植株的结果一致[20],说明染色体加倍率可能也是一种可遗传的性状。不同小麦基因型加倍效率的差异可能也与加倍处理后植株生长的环境条件和生长习性有关。由于获得中国春和CBO37单倍体植株的时期不同步,分别进行了加倍处理,且中国春单倍体植株在人工气候条件下生长发育缓慢、植株不够健壮。处理小麦与黑麦杂交产生的双单倍体植株仅120 μmol·L-1炔苯酰草胺浓度获得了9.0%的加倍率,另外2种除草剂和秋水仙素不同处理均没有加倍成功,表明炔苯酰草胺对小麦与黑麦双单倍体植株也具有加倍效果。相比小麦单倍体植株,小麦与黑麦双单倍体植株加倍率非常低,这可能与不同小麦单倍体植株的遗传组成有关。小麦与黑麦双单倍体植株来源小麦雌配子与黑麦雄配子的结合,含有小麦单倍染色体组和黑麦单倍染色体组,可能具有相对高的遗传稳定性,对加倍试剂处理具有较强的耐受性。为了提高炔苯酰草胺对小麦与黑麦双单倍体植株的加倍效果,我们进一步增加了其处理浓度(0.5—5.0m·L-1炔苯酰草胺
另外,本研究在利用各个浓度甲基胺草磷、炔苯酰草胺、氟乐灵和秋水仙素溶液加倍小麦与黑麦双单倍体植株中均出现了一定比率维持在幼苗生长状态的植株,这些植株在温室中生长了4个月(2016年9月—2017年1月)没有拔节,而其他植株都正常完成了生命周期。将这些植株移栽到花盆中放在室外生长,也一直没有拔节,而它们的双亲中国春和甘肃黑麦都属春性。目前这些植株在低温生长室进行春化处理,拟深入研究这些畸形苗发生的分子机制。
相比花药培养,利用玉米花粉诱导小麦单倍体植株几乎没有小麦基因型的依赖性,试验操作也比较简单,但小麦单倍体胚诱导率是该技术进一步利用的限制因素。陈新民等[18,26]报道不同玉米基因型诱导不同小麦基因型单倍体胚的成胚率一般为15%—20%。中国农业科学院作物科学研究所小麦遗传转化实验室诱导小麦单倍体胚的频率一直比较低(5%—10%),也尝试利用玉米诱导系和处理液中添加阿拉伯葡聚糖蛋白(arabinogalactan proteins,AGP)等方式提高成胚率[32],结果仍然不尽理想。将继续探讨提高成胚率的技术,以提高小麦单倍体育种和转基因育种(加速转基因材料纯合)的效率。
4 结论
培养基表面添加10—20 mmol·L-1秋水仙素溶液对小麦单倍体植株加倍效果明显,而且简单易行;叶片涂抹秋水仙素溶液加倍效率较低,分蘖节加注秋水仙素溶液不能加倍小麦单倍体植株。在选用的3种除草剂中,只有炔苯酰草胺对小麦单倍体植株具有加倍效果;培养基表面添加60—120 μ·L-1浓度的炔苯酰草胺溶对小麦单倍体植株加倍作用明显。
[1] SHEWRY P R. Wheat., 2009, 60(6): 1537-1553.
[2] 何中虎, 夏先春, 陈新民, 庄巧生. 中国小麦育种进展与展望. 作物学报, 2011, 37(2): 202-215.
HE Z H, XIA X C, CHEN X M, ZHUANG Q S. Progress of wheat breeding in China and the future perspective., 2011, 37(2): 202-215. (in Chinese)
[3] LAURIE A D, BENNETT M D. Wheat × maize hybridization., 1986, 28(2): 313-316.
[4] 陈新民, 徐惠君, 周俊芳, 刘俊秀, 张宏哲. 提高小麦×玉米胚培养植株产生频率的研究. 中国农业科学, 1996, 29(4): 29-32.
CHEN X M, XU H J, ZHOU J F, LIU J X, ZHANG H Z. A study on the increasing frequencies of plant production during embryo culture in crosses between wheat and maize., 1996, 29(4): 29-32. (in Chinese)
[5] 欧阳俊闻, 胡含, 庄家骏, 曾君祉. 小麦花粉植株的诱导及其后代的观察. 中国科学, 1973, 16(1): 72-82.
OUYANG J W, HU H, ZHUANG J J, ZENG J Z. Induction of pollen plants from anthers ofL. cultured., 1973, 16(1): 72-82. (in Chinese)
[6] TUVESSON I K D, PEDERSEN S, ANDERSEN S B. Nuclear genes affecting albinism in wheat (L.) anther culture., 1989, 78(6): 879-883.
[7] LASHERMES P. Improved anther culture method for obtaining direct regeneration in wheatL.)., 1992, 46: 99-102.
[8] TOURAEV A, INDRIANTO A, WRATSCHKO I, VICENTE O, HEBERLE-BORS E. Efficient microspore embryogenesis in wheat (L.) induced by starvation at high temperatures., 1996, 9(4): 209-215.
[9] SHARIATPANAHI M E, BELOGRADOVA K, HESSAMVAZIRI L, HEBERLE-BORS E, TOURAEV A. Efficient embryogenesis and regeneration in freshly isolated and cultured wheat (L.) microspores without stress pretreatment., 2006, 25(12): 1294-1299.
[10] LIU W, ZHENG M Y, KONZAK C F. Improving green plant production via isolated microspore culture in bread wheat (L.)., 2002, 20: 821-824.
[11] ZHENG M Y, WENG Y, LIU W, KONZAK C F. The effect of ovary-conditioned medium on microspore embryogenesis in common wheat (L.)., 2002, 20: 802-807.
[12] LIU W G, ZHENG M Y, ENRIQUE A P, KONZAK F C. Highly efficient doubled-haploid production in wheat (L.)induced microspore embryogenesis., 2002, 42(3): 686-692.
[13] 李志武, 徐惠君, 叶兴国. 小麦花药培养中染色体加倍技术. 作物杂志, 1996(4): 24-26.
LI Z W, XU H J, YE X G. Chromosome doubling technique in wheat anther culture., 1996(4): 24-26. (in Chinese)
[14] ZAMANI I, GOULI-VAVDINOUDI E, KOVACS G,XYNIAS I, ROUPAKIAS D, BARNABAS B. Effect of parental genotypes and colchicine treatment on the androgenic response of wheat F1hybrids., 2003, 122(4): 314-317.
[15] SORIANO M, CISTUE L, VALLES M P, CASTILLO A M. Effects of colchicineon anther and microspore culture of bread wheat (L.)., 2007, 91(3): 225-234.
[16] 赵爱菊, 尤帅. 小麦花药诱导产生单倍体植株的染色体加倍技术研究. 河北农业科学, 2013, 17(2): 57-60.
ZHAO A J, YOU S. Study on the chromosome doubling of haploid wheat plants produced by anther culture., 2013, 17(2): 57-60. (in Chinese)
[17] 杨丽萍, 朱晋云, 李楠. 花培苗染色体加倍技术研究. 生物技术进展, 2011,1(6): 436-439.
YANG L P, ZHU J Y, LI N. Chromosome doubling technique for anther culture of winter wheat., 2011, 1(6): 436-439. (in Chinese)
[18] 陈新民, 王凤菊, 李思敏, 张文祥. 小麦与玉米杂交产生小麦单倍体与双单倍体的稳定性. 作物学报, 2013, 39(12): 2247-2252.
CHEN X M, WANG F J, LI S M, ZHANG W X. Stable production of wheat haploid and doubled haploid by wheat × maize cross., 2013, 39(12): 2247-2252. (in Chinese)
[19] OUYANG J W, LIANG H, JIA S E, ZHANG C, ZHAO T H, HE L Z, JIA X. Studies on the chromosome doubling of wheat pollen plants., 1994, 98(2): 209-214.
[20] 惠国强, 杜何为, 杨小红, 刘光辉, 王振通, 张义荣, 郑艳萍, 严建兵, 张铭堂, 李建生.不同除草剂加倍玉米单倍体的效率.作物学报, 2012, 38(3): 416-422.
HUI G Q, DU H W, YANG X H, LIU G H, WANG Z T, ZHANG Y Y, ZHENG Y P, YAN J B, ZHANG M T, LI J S. Doubling efficiency of maize haploids treated by different herbicides., 2012, 38(3): 416-422. (in Chinese)
[21] ZHANG W, WANG K, LIN Z S, DU L P, MA H L, XIAO L L, YE X G. Production and identification of haploid dwarf male sterile wheat plants induced by corn inducer., 2014, 55: 26.
[22] 王坤杨, 张伟, 张双喜, 刘宏伟, 王轲, 杜丽璞, 林志珊, 叶兴国. 化学杀雄剂SQ-1和阿拉伯葡聚糖蛋白对小麦品种间杂交及远缘杂交成胚率的影响. 中国农业科学, 2016, 49(24): 4824-4832.
WANG K Y, ZHANG W, ZHANG S X, LIU H W, WANG K, DU L P, LIN Z S, YE X G. Effect of chemical hybridization agent SQ-1 and arabinogalactan proteins on the embryos obtaining in wheat intervarietal and wild crosses., 2016, 49(24): 4824-4832. (in Chinese)
[23] 叶兴国, 徐惠君, 徐琼芳, 杜丽璞, 李志武. 小麦花药培养力的基因型差异和配合力分析. 中国农业科学, 1997, 30(6): 49-54.
YE X G, XU H J, XU Q F, DU L P, LI Z W. Genetic analysis and combining ability evaluation of the anther culture response in common wheat., 1997, 30(6): 49-54. (in Chinese)
[24] 韩晓峰, 陶丽莉, 殷桂香, 刘晓蕾, 杜丽璞, 魏亦勤, 晏月明, 叶兴国. 基因型和环境条件对小麦花药培养效果的影响. 作物学报, 2010, 36(7): 1209-1215.
HAN X F, TAO L L, YIN G X, LIU X L, DU L P, WEI Y Q, YAN Y M, YE X G. Effect of genotype and growing environment on anther culture in wheat.2010, 36(7): 1209-1215. (in Chinese)
[25] 叶兴国, 樊路, 韩敬花. 普通小麦基因系与黑麦的杂交及回交研究. 作物学报, 1992, 18(6): 447-452.
YE X G, FAN L, HAN J H. Study on crosses and backcrosses of common wheat () mutants,,with rye ()., 1992, 18(6): 447-452.(in Chinese)
[26] WEDZONY M, FORSTER B P, ZUR I, GOLEMIER E, SZECHYNSKA-HEBDA M, DUBAS E, GOTEBIOWSKA G, WEDZONYL M. Progress in doubled haploid technology in higher plants//TOURAEY A, FORSTER B P, JAIN S M. eds.. Springer, Dordrecht, 2009: 1-33.
[27] STADLER J, PHILLIPS R, LEONARD M. Mitotic blocking agents for suspension cultures of maize ‘Black Mexican Sweet’ cell lines., 1989, 32(3): 475-478.
[28] BLANCO H G, ROZANDI A, LEIDERMAN L. Experimentation with herbicides in the cultivation of onion (L) to evaluate the efficiency of 16 herbicides applied pre-emergence to weeds., 1982, 48(5): 113-134.
[29] RAMULU K S, VERHOEVEN H A, DIJKHUIS P. Mitotic blocking, micronucleation, and chromosome doubling by oryzalin, amiprophos- methyl, and colchicine in potato., 1991, 160(2/3): 65-71.
[30] 刘支前. 除草剂拿草特对菟丝子幼苗茎尖分生区有丝分裂的影响. 实验生物学报, 1995, 28(2): 209-213.
LIU Z Q. Effect of pronamide on the mitosis in the shoot meristems of dodder seedlings., 1995, 28(2): 209-213. (in Chinese)
[31] BEAUMONT V H, WIDHOLM J M. Ploidy variation of pronamide-treated maize calli during long term culture., 1993, 12(11): 648-651.
[32] 陈新民, 何中虎, 刘春来, 王德森, 张勇, 贾继增, 张运宏. 利用小麦×玉米诱导单倍体技术育成小麦新品种中麦533. 麦类作物学报, 2011, 31(3): 427-429.
CHEN X M, HE Z H, LIU C L, WANG D S, ZHANG Y, JIA J Z, ZHANG Y H. New wheat variety Zhongmai533 developed by wheat×maize cross., 2011, 31(3): 427-429. (in Chinese)
(责任编辑 李莉)
Effects of Different Chemicals and Treatment Methods on Chromosome Doubling of Haploid Wheat Plants
YIN MiQi1, ZHANG ShuangXi2, FAN ChunKun3, WANG KunYang1, WANG Jing1, WANG Ke1, DU LiPu1, YE XingGuo1
(1Institute of Crop Science, Chinese Academy of Agricultural Sciences/National Key Facility for Gene Resources and Genetic Improvement, Beijing 100081;2Crop Research Institute, Ningxia Academy of Agri-Forestry Sciences, Yinchuan 750105;3Agricultural Institute, Tibet Academy of Agricultural and Animal Husbandry Sciences, Lasa 850032)
【Objective】The treatment of tillering node with colchicine in a pump solution has long been widely used for chromosome doubling of haploid wheat plants before transplanting. However, this method has some disadvantages, for example, complicated manipulation and environmental or container pollution. Moreover, colchicine is some toxic, and large amount of application is not cost effective. The purposes of this study were to develop a simple, safe and efficient method for chromosome doubling of wheat haploid plants, and to evaluate a chemical that is suitable for the replacement of colchicine for chromosome doubling in wheat. 【Method】The haploid wheat plants were obtained by anther culture for wheat line Fielder, and by crossing with the maize inbred line Zheng58 for wheat cultivars/lines Kenong199, Xinchun9, Chinese Spring and CB037chromosome elimination. Wheat line Chinese Spring was also crossed with rye line Gansu Heimai to produce wheat-rye double haploid plants. Chromosome doubling of different wheat haploid plants was conducted using the colchicine solutions at the concentrations of 0, 5, 10, and 20 mmol·L-1through tiller node adding after transplanting, leaf painting after transplanting, and medium surface adding before transplanting. Additionally, the supplement of amiprophos-methyl, trifluralin, and propyzamide at the concentrations of 0, 30, 60 and 120 μ·L-1on medium surface adding was used to double chromosomes of the wheat haploid plants and the wheat-rye double haploid plants. The efficiency of chromosome doubling by different treatment methods was compared and the optimal concentrations of different chemicals were determined. 【Result】Results indicated that the application of different concentrations of colchicine (0, 5, 10, and 20 mmol·L-1) by tiller node adding couldn’t be able to double the wheat haploid plants from the cross of wheat and maize, so it is not useful in chromosome doubling of wheat haploid plants. A doubling frequency of 7.7% was found when 10 mmol·L-1colchicine was applied by leaf painting for the wheat haploid plants from maize pollen induction at jointing stage, but no haploid plant was doubled with other three concentrations of colchicine solutions, suggesting that this treatment method was also not useful for the doubling of the wheat haploid plants. The frequencies of chromosome doubling for the wheat haploid plants generated from anther culture treated with the four colchicine concentrations by medium surface adding were 26.7%, 42.9%, 73.3%, and 85.7%, respectively. It is demonstrated that the supplement of colchicine solution on medium surface adding resulted in the highest efficiency of chromosome doubling for the wheat haploid plants and the optimal concentration is at least 20 mmol·L-1. The frequency of chromosome doubling for the haploid plants generated from the cross of wheat and maize by medium surface adding of propyzamide at the concentrations of0, 30, 60, and 20 μ·L-1was0, 0-57.1%, 28.6%-75.0%, and 0-100%. however, the other two herbicides used by this method were not effective in chromosome doubling. The frequency of chromosome doubling by medium surface adding of 120 μ·L-1propyzamide for the wheat-rye double haploid plants was 9.0%. No seed was produced by the other three concentrations of propyzamide and the other three agents (amiprophos-methyl, trifluralin, and colchicine). 【Conclusion】It is concluded that propyzamide at the concentration of 60-120 μ·L-1produced promising results of chromosome doubling for the wheat haploid plants. The medium surface adding of colchicine and propyzamideat appropriate concentrations is effective and easily adopted to double chromosomes of wheat haploid plants.
wheat; haploid plants; distant hybridization; anther culture; doubling agents
2017-09-12;
2017-12-28
国家重点研发计划(2016YFD0102001)、中国农业科学院科技创新工程
尹米琦,Tel:010-8210-5173;E-mail:yinmiqi@sohu.com。张双喜,Tel:0956-84001033;E-mail:shxzhang@163.com。尹米琦和张双喜为同等贡献作者。
叶兴国,Tel:010-8210-5173;E-mail:yexingguo@caas.cn
