RNAi结肠癌HOXB7基因表达对癌细胞增殖及凋亡的机制研究①
2018-03-23朱克祥袁得峰张正聪吕鹏飞白小平
朱克祥 袁得峰 张正聪 吕鹏飞 白小平
(兰州大学第一医院普外二科,甘肃省生物治疗与再生医学重点实验室,兰州 730000)
结肠癌是常见的消化道恶性肿瘤,其发病率及死亡率呈不断上升趋势。到目前为止,结肠癌的发病机制仍不十分清楚[1]。肿瘤的发生是一个涉及多种生物学变化的复杂病理过程,包括原癌基因异常表达、抑癌基因失活等。目前已发现多个潜在的结肠癌肿瘤分子标记物,但仍需发现有效用于结肠癌分子诊断及治疗的分子标记物[2,3]。同源异形盒基因HOXB7定位于17q21.3人类染色体,属于同源异形盒HOX家族B簇,HOXB7编码的同源蛋白,可作为转录调节因子,与黏附因子、血管内皮生长因子、细胞外基质相关信号等相互作用,抑制或激活相应序列的靶基因,进而参与多种生物学过程,目前其作用机制尚未清楚[4]。有研究表明,HOXB7在多种肿瘤中呈现高表达,口腔鳞状细胞癌HOXB7的表达与临床分期、淋巴结转移及Ki-67表达显著相关[5];卵巢癌中HOXB7的表达与癌细胞的增殖和迁移有关[6]。HOXB7在结肠癌中也呈现高表达,但对结肠癌生物学特性的影响研究的尚未清楚[7]。本研究中通过RNAi沉默结肠癌细胞中HOXB7基因表达,检测细胞增殖及凋亡情况,并进一步研究其作用机制。
1 材料与方法
1.1材料
1.1.1细胞株 人结肠癌SW480细胞株购自中国典型培养物保存中心。
1.1.2主要试剂和仪器 胎牛血清、RPMI1640培养基、LipofectamineTM2000转染试剂盒均购自美国Invitrogen公司;考马斯亮蓝蛋白测定试剂盒购自南京建成生物工程研究公司;DAB显色试剂盒购自北京中杉金桥生物科技有限公司;CCK8试剂盒购自美国Promega公司;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒购自碧云天生物技术研究所;HOXB7、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、Notch1、Hes1均购自美国Abcam公司;RT-PCR试剂盒购自日本Rermentas公司;酶标仪购自美国Bio-Tek公司;流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞培养 取出液氮罐中保存的SW480细胞株,快速复温后置于37℃、5%CO2培养箱中,用含有10%胎牛血清的RPMI1640培养液培养。细胞呈单层贴壁生长后,每隔2 d换液1次。取生长至对数期的细胞用于实验研究。
1.2.2转染 收集生长状态良好的细胞,转染前1 d 以5×104个/孔接种至6孔细胞培养板中,细胞生长至约80%融合时,收集细胞进行转染。转染通过LipofectamineTM2000脂质体介导法,转染分为3组:空白组、阴性对照组及HOXB7转染组,空白组是未转染的细胞,阴性对照组及转染组分别加入合成的阴性对照siRNA及HOXB7-siRNA。
1.2.3转染效果检测 通过RT-PCR及Western blot检测转染效果。RT-PCR操作步骤如下:收集转染后48 h的细胞,利用RNA提取试剂盒提取细胞中的总RNA,逆转录为cDNA,以cDNA为模板对HOXB7的表达进行扩增。HOXB7及内参GAPDH的引物由上海生工合成。引物序列如下:HOXB7 F:5′-GAGCCGAGTTCCTTCAACAT-3′,R:5′-TCTGGTAGCGGGTGTAGGTC-3′。GAPDH F:5′-ATGACCCCTTCATTGACC-3′,R:5′-GAAGATGGTGATGGG-ATTTC-3′。PCR反应条件及反应体系按照试剂盒的操作进行。实验重复3次,取Ct均值,通过2-ΔΔCt法进行统计。
Western blot检测蛋白表达简要步骤如下:收集细胞,提取细胞中的蛋白,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),并且电转移至硝酸纤维素膜,5%的脱脂奶粉封闭2 h,分别与HOXB7(1∶1 000稀释)、GAPDH(1∶2 000稀释)一抗及辣根过氧化物酶标记的羊抗鼠IgG二抗进行作用,室温孵育1 h,DAB显色。以目的蛋白的灰度值除以内参的灰度值以校正误差,所得结果代表某样品目的蛋白相对含量。
1.2.4CCK8法检测SW480细胞的增殖情况 将对数生长期的SW480细胞浓度调整为3×104个/ml,以每孔100 μl接种于96孔细胞培养板中,常规培养。按照上述分组进行转染,分别于转染后的24、48、72、96 h收集细胞。每孔细胞加入10 μl的CCK8溶液,37℃孵育4 h。酶标仪检测570 nm各个孔的光密度值(OD),每组设置6个复孔,实验重复3次。
1.2.5Annexin V-FITC/PI双染法检测细胞凋亡情况 分组收集转染48 h的细胞于离心管中,离心,弃上清;磷酸缓冲液洗涤,再离心,收集细胞,按照细胞凋亡盒检测说明进行操作。
1.2.6Bcl-2、Bax、Notch1、Hes1蛋白表达检测 通过Western blot检测Bcl-2、Bax、Notch1、Hes1蛋白表达,检测方法参照1.2.3方法。
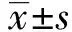
2 结果
2.1siRNA沉默HOXB7后SW480细胞中HOXB7的表达 HOXB7的siRNA转染SW480细胞48 h后,RT-PCR及Western blot分别检测各组细胞中HOXB7的mRNA及蛋白表达,结果如图1和表1所示,与空白组比较,阴性对照组HOXB7的mRNA及蛋白表达无统计学差异(P>0.05),而HOXB7转染组HOXB7的mRNA及蛋白表达均显著降低(P<0.05)。
2.2沉默HOXB7表达降低SW480细胞增殖 CCK8法检测沉默HOXB7表达24、48、72、96 h后细胞的增殖变化,结果如表2所示,转染24 h后三组细胞的OD值间差异无统计学意义,48、72、96 h后,HOXB7转染组OD值均显著低于空白组(P>0.05),阴性对照组OD值与空白组差异无统计学意义(P>0.05)。
2.3沉默HOXB7表达诱导SW480细胞凋亡 沉默HOXB7表达48 h后,收集细胞,流式细胞仪检测细胞凋亡率变化,Western blot检测凋亡相关蛋白Bcl-2和Bax的蛋白表达,结果如图2、3和表3所示,与空白组比较,HOXB7转染组细胞凋亡率显著升高,Bcl-2蛋白显著下调表达,Bax蛋白显著上调表达(P<0.05)。
2.4沉默HOXB7表达下调Notch1信号通路表达 Western blot检测沉默HOXB7表达后Notch1信号通路相关蛋白Notch1、Hes1的表达变化,结果如图4和表4所示,与空白组比较,HOXB7转染组Notch1、Hes1蛋白表达显著降低(P<0.05)。
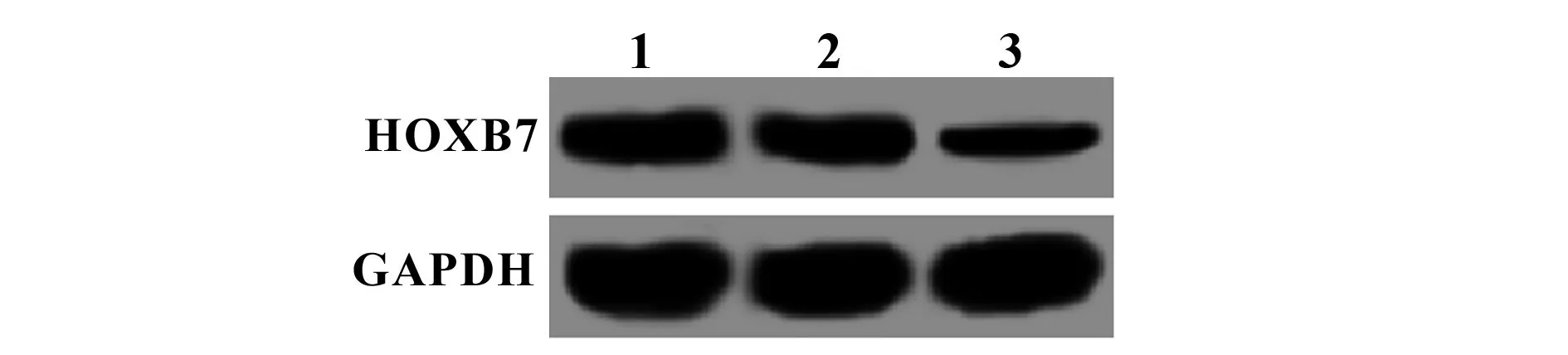
图1 siRNA沉默HOXB7后SW480细胞中HOXB7的蛋白表达Fig.1 Protein expression of HOXB7 in SW480 cells after HOXB7 was silenced by siRNANote:1.Blank group;2.NC group;3.HOXB7 transfection group.
表1siRNA沉默HOXB7后SW480细胞中HOXB7的mRNA及蛋白表达
Tab.1mRNAandproteinexpressionofHOXB7inSW480cellsafterHOXB7wassilencedbysiRNA

GroupsmRNAofHOXB7ProteinofHOXB7Blankgroup1 000±0 0710 587±0 054NCgroup0 991±0 0620 568±0 051HOXB7transfectiongroup0 206±0 0251)0 276±0 0361)
Note:Compared with the blank group,1)P<0.05.
表2沉默HOXB7表达后SW480细胞增殖的变化
Tab.2ProliferationofSW480cellsafterHOXB7expressionwassilenced

GroupsOD24h48h72h96hBlankgroup0 205±0 0090 386±0 0150 611±0 0260 826±0 035NCgroup0 204±0 0100 381±0 0120 589±0 0240 803±0 033HOXB7tran⁃sfectiongroup0 202±0 0081)0 247±0 0101)0 346±0 0171)0 456±0 0291)
Note:Compared with the blank group,1)P<0.05.

图2 沉默HOXB7表达后SW480细胞凋亡情况Fig.2 Apoptosis of SW480 cells after HOXB7 expression was silenced

图3 沉默HOXB7表达后Bcl-2和Bax的蛋白表达Fig.3 Protein expression of Bcl-2 and Bax after HOXB7 expression was silencedNote:1.Blank group;2.NC group;3.HOXB7 transfection group.
表3沉默HOXB7表达后SW480细胞凋亡率及Bcl-2和Bax蛋白表达
Tab.3ApoptosisrateofSW480cellsandexpressionofBcl-2andBaxproteinafterHOXB7expressionwassilenced

GroupsApoptosisrate(%)Bcl⁃2BaxBlankgroup1 28±0 470 315±0 0320 113±0 012NCgroup1 29±0 450 327±0 0330 111±0 011HOXB7transfectiongroup9 79±0 881)0 056±0 0101)0 521±0 0421)
Note:Compared with the blank group,1)P<0.05.

图4 沉默HOXB7表达后Notch1、Hes1的蛋白表达Fig.4 Protein expression of Notch1 and Hes1 after HOXB7 expression was silencedNote:1.Blank group;2.NC group;3.HOXB7 transfection group.
表4Westernblot检测Notch1、Hes1的蛋白表达
Tab.4ProteinexpressionofNotch1andHes1weredetectedbyWesternblot
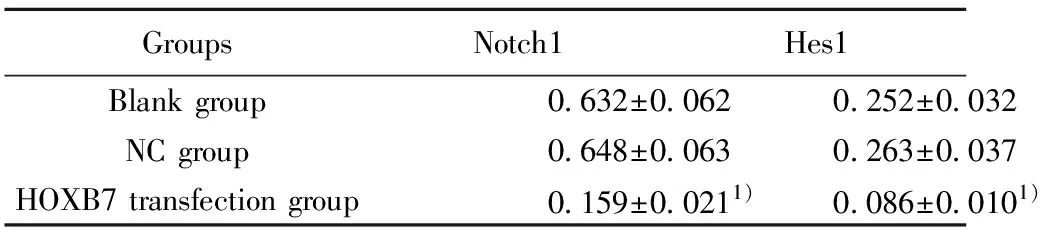
GroupsNotch1Hes1Blankgroup0 632±0 0620 252±0 032NCgroup0 648±0 0630 263±0 037HOXB7transfectiongroup0 159±0 0211)0 086±0 0101)
Note:Compared with the blank group,1)P<0.05.
3 讨论
结肠癌具有较高的发病率和死亡率,在各类恶性肿瘤中位居第三位,对人类的健康和生存造成了严重的威胁。现阶段,虽然随着医疗技术的发展,结肠癌的五年生存率有很大的提高,但仍有一部分患者死于术后肿瘤复发[8]。肿瘤的发生是一个长期连续过程,涉及多种基因及信号转导系统的调节。寻找与结肠癌发生相关的生物因子并研究其在发生及发展过程中的生物学作用机制,仍然是一个重要的命题。HOXB7是HOX家族成员,不仅参与正常组织器官的生长发育,且在肿瘤中的高表达影响肿瘤细胞的侵袭和转移[9]。目前在多种肿瘤中均可检测到HOXB7的高表达。胃癌细胞中HOXB7可通过上调细胞周期相关蛋白、侵袭相关分子及磷酸化的AKT水平,进而促进癌细胞的生长、侵袭、迁移能力[10];肝癌细胞中利用RNA干扰技术下调HOXB7的表达可抑制癌细胞的增殖、侵袭、迁移及黏附,阻滞细胞于G0-G1期[11]。结肠癌中HOXB7也呈现高表达,其表达与T分期、有无远处转移、ki-67水平等多个临床病理参数相关[12]。这提示HOXB7在结肠癌的发生及发展中是一个潜在的分子治疗靶点。但其对结肠癌生物学特性及影响机制并不明确。
为了研究HOXB7对结肠癌细胞增殖及凋亡的影响,本研究通过RNAi沉默HOXB7的表达,发现结肠癌细胞的增殖显著降低,凋亡增加。这提示HOXB7基因与结肠癌的增殖及凋亡有关。同时进一步探讨引起凋亡的机制。细胞凋亡受到多种基因的调控,其中Bcl-2家族在细胞凋亡过程中发挥关键作用。Bcl-2家族有促凋亡基因和抑凋亡基因,Bcl-2是抑凋亡基因,Bax是促凋亡基因,有研究指出细胞的凋亡与两者的比率有关。当Bcl-2表达降低,而Bax表达升高,则促进细胞的凋亡,反之则抑制细胞的凋亡[13,14]。为了证明HOXB7是否可通过调控Bcl-2和Bax的表达引起结肠癌细胞凋亡,检测Bcl-2和Bax的蛋白表达,发现抑制HOXB7基因表达后Bcl-2显著下调表达,而Bax表达上调。这说明抑制HOXB7基因表达可通过调节Bcl-2和Bax的表达诱导结肠癌细胞凋亡。
Notch1信号通路是Notch信号通路之一,是一条高度保守的信号通路[15]。近些年的研究发现,该信号通路在乳腺癌、食管癌等多种肿瘤中有过度表达,与肿瘤的发生及发展密切相关[16,17]。结直肠癌中Notch1信号通路的高表达在其发展过程中有致癌作用,且与患者的总生存期及预后差有关[18]。因此有人提出Notch1信号通路可作为判断结直肠癌预后及治疗的潜在生物标记。Hes1基因是Notch1信号通路下游重要的效应子,是其是否激活的标志。Notch1、Hes1蛋白表达检测结果显示,抑制HOXB7基因表达后Notch1、Hes1蛋白表达降低。
综上所述,通过RNAi阻断结肠癌HOXB7基因表达可通过抑制Notch1信号通路降低癌细胞的恶性增殖,并诱导细胞凋亡。诱导细胞凋亡可能与下调Bcl-2和上调Bax表达有关。该研究为进一步研究结肠癌的基因治疗奠定了基础。肿瘤的发生及发展是受多种因素影响的,为了更好地研究HOXB7在结肠癌中的作用,有必要研究其与侵袭、迁移等生物学特性及相关基因之间的关系。
[1] Todaro M,Gaggianesi M,Catalano V,etal.CD44v6 is a marker of constitutive and reprogrammed cancer stem cells driving colon cancer metastasis[J].Cell Stem Cell,2014,14(3):342-356.
[2] Yothers G,O′Connell MJ,Lee M,etal.Validation of the 12-gene colon cancer recurrence score in NSABP C-07 as a predictor of recurrence in patients with stage Ⅱ and Ⅲ colon cancer treated with fluorouracil and leucovorin (FU/LV) and FU/LV plus oxaliplatin[J].J Clin Oncol,2013,31(36):4512-4519.
[3] Dalerba P,Sahoo D,Paik S,etal.CDX2 as a prognostic biomarker in stage Ⅱ and stage Ⅲ colon cancer[J].N Engl J Med,2016,374(3):211-222.
[4] Nguyen Kovochich A,Arensman M,Lay AR,etal.HOXB7 promotes invasion and predicts survival in pancreatic adenocarcinoma[J].Cancer,2013,119(3):529-539.
[5] Marcinkiewicz KM,Gudas LJ.Altered epigenetic regulation of homeobox genes in human oral squamous cell carcinoma cells[J].Exp Cell Res,2014,320(1):128-143.
[6] Kelly Z,Moller-Levet C,McGrath S,etal.The prognostic significance of specific HOX gene expression patterns in ovarian cancer[J].Int J Cancer,2016,139(7):1608-1617.
[7] Soret C,Martin E,Duluc I,etal.Distinct mechanisms for opposite functions of homeoproteins Cdx2 and HoxB7 in double-strand break DNA repair in colon cancer cells[J].Cancer Lett,2016,374(2):208-215.
[8] Ogata-Kawata H,Izumiya M,Kurioka D,etal.Circulating exosomal microRNAs as biomarkers of colon cancer[J].PLoS One,2014,9(4):e92921.
[9] Jin K,Park S,Teo WW,etal.HOXB7 is an ERα cofactor in the activation of HER2 and multiple ER target genes leading to endocrine resistance[J].Cancer Discov,2015,5(9):944-959.
[10] Cai J,Xu X,Mou YP,etal.Upregulation of HOXB7 promotes the tumorigenesis and progression of gastric cancer and correlates with clinical characteristics[J].Tumor Biol,2016,37(2):1641-1650.
[11] Komatsu H,Iguchi T,Masuda T,etal.HOXB7 expression is a novel biomarker for long-term prognosis after resection of hepatocellular carcinoma[J].Anticancer Res,2016,36(6):2767-2773.
[12] Iman M,Samaneh Mostafavi S,Shahriar Arab S,etal.HOXB7 and Hsa-miR-222 as the potential therapeutic candidates for metastatic colorectal cancer[J].Recent Patents Anti-cancer Drug Discov,2016,11(4):434-443.
[13] Sharifi S,Barar J,Hejazi MS,etal.Roles of the Bcl-2/Bax ratio,caspase-8 and 9 in resistance of breast cancer cells to paclitaxel[J].Asian Pac J Cancer Prev,2014,15(20):8617-8622.
[14] 冯俊伟,张志勇,王爱军,等.结直肠癌组织中 TAZ 表达与 Bcl-2,Bax,Caspase-3 的关系及临床意义[J].中国老年学杂志,2014,34(19):5419-5420.
Feng JW,Zhang ZY,Wang AJ,etal.The relationship and clinical significance of TAZ expression in colorectal cancer tissue with Bcl-2,Bax,Caspase-3[J].Chin J Gerontol,2014,34(19):5419-5420.
[15] Wael H,Yoshida R,Kudoh S,etal.Notch1 signaling controls cell proliferation,apoptosis and differentiation in lung carcinoma[J].Lung Cancer,2014,85(2):131-140.
[16] 李秀芹,韩玉贞,曾令瑞,等.乳腺癌组织 Notch1 和 JAG1 蛋白表达与分子分型相关性研究[J].中华肿瘤防治杂志,2017,24(5):297-301.
Li XQ,Han YZ,Zeng LR,etal.Expression and significance of Notch1 and JAG1 proteins in different subtypes of breast cancer[J].Chin J Cancer Prevention Treatment,2017,24(5): 297-301.
[17] Ogawa R,Ishiguro H,Kimura M,etal.NOTCH1 expression predicts patient prognosis in esophageal squamous cell cancer[J].Eur Surg Res,2013,51(3-4):101-107.
[18] Fender AW,Nutter JM,Fitzgerald TL,etal.Notch-1 promotes stemness and epithelial to mesenchymal transition in colorectal cancer[J].J Cell Biochem,2015,116(11):2517-2527.
