FoxO1基因对Jurkat细胞FoxO1-KLF2-S1P1通路的调节作用①
2018-03-23刘萍萍倪文鹏李倩如
闫 飞 刘萍萍 张 键 赵 瑞 倪文鹏 李倩如 杜 英
(郑州大学基础医学院免疫学系,郑州 450001)
叉头蛋白O1(Forkhead box protein O1,FoxO1)是一种重要的转录因子,在许多组织表达,参与细胞凋亡、DNA损伤修复、肿瘤发生和糖代谢等重要生命过程[1,2]。文献资料显示,FoxO1表达量在T、B淋巴细胞和卵巢组织显著高于其他组织[3],提示FoxO1在这些组织和细胞中有更为重要的作用。研究已发现FoxO1在T细胞中有三个重要的靶基因,即编码IL-7Rα亚单位(IL-7Rα)、L-选择素(CD62L)和KLF2(Kruppel-like factor 2)的基因[4],FoxO1能通过IL-7Rα和KLF2调节初始T细胞生存和归巢[5]。KLF2能进一步调节鞘胺醇-1-磷酸受体(Sphingosine-1-phosphate receptor 1,S1P1)、CD62L、CCR7等分子在细胞的表达[6],其中S1P1和CD62L是调节淋巴细胞在血液循环和外周免疫器官分布的重要分子,也是T细胞在胸腺分化成熟的重要标志[7-9]。我们在对重症肌无力(Myasthenia gravis,MG)患者胸腺细胞异常分化的研究中,发现MG患者胸腺组织中FoxO1、KLF2和S1P1 mRNA和蛋白表达水平均显著高于对照组[10],但这些分子在MG患者胸腺中高表达在疾病发生和胸腺细胞亚群异常中的作用尚不清楚,为探讨FoxO1高表达对胸腺细胞和T细胞功能的影响,我们采用分子生物学技术构建了人FoxO1表达和干扰(shRNA)慢病毒载体,通过转染Jurkat细胞(人急性T细胞白血病细胞)人为造成FoxO1高表达和低表达细胞模型,分析FoxO1对下游分子KLF2、S1P1、CD62L、CCR7分子的影响。
1 材料与方法
1.1实验材料、试剂 FoxO1cDNA购于北京义翘神州生物;T4 DNA Ligase、PrimeScriptTMRT reagent Kit with gDNA Eraser、Marker、SYBR®Primix Ex Tap,均购自日本TaKaRa公司;DL2000、DL5000,Clon Express Multis One Step Cloning Kit购于南京Vazyme公司;KOD-Plus-Neo购于日本Toyobo公司;载体质粒pCDH-CMV-EF1-copGFPGFP购于上海生物风公司;载体质粒pMAGi1.1、HEK293T细胞和Jurkat细胞,由郑州大学基础医学院实验中心赠送;包装质粒pCMV-VSV-G和pCMV-dR8.2 dvpr购于Addgene公司;限制性内切酶XbaⅠ和NotⅠ,Western blot蛋白marker为PageRulerTMPrestained Protein Ladder(10~180 kD)购于美国Therm公司;限制性内切酶AgeⅠ和EcoRⅠ购于日本TaKaRa公司;无内毒素质粒提取试剂盒和琼脂糖凝胶回收试剂盒购于美国Axygen公司;大肠杆菌DH5α感受态细胞购于北京鼎国昌盛生物科技有限公司;FoxO1抗体和KLF2抗体购于英国Abcom公司;CD4、CD8、S1P1、CCR7和CD69抗体购于美国BD公司;CD62L抗体购于美国Biolengd公司。
1.2实验方法
1.2.1引物设计 根据GenBank中人FoxO1 cDNA(NM-005438.4)序列设计带酶切位点的FoxO1引物:FoxO1-F-XbaⅠ:5′-gattctagagctagcgaattc ATGGCCGAGGCGCCTCAG-3′;FoxO1-R-NotⅠ:5′-gatccttgcggccgcggatcc TCAGCCTGACACCCAGCTATG-3′,由苏州金唯智公司合成。FoxO1-shRNA序列:序列1:CCGGGGAGAAGAGCTGCATCCATTTCAAGAGAATG-GATGCAGCTCTTCTCCTTTTTTG;序列2:AATTCA-AAAAAGGAGAAGAGCTGCATCCATTCTCTTGAAAT-GGATGCAGCTCTTCTCC。
1.2.2目的基因扩增 以FoxO1 cDNA为模板,PCR扩增带酶切位点的基因片段。反应体系为:10×Buffer 5 μl ,2 mmol/L dNTPs 5 μl,25 mmol/L MgSO42 μl,10 μmol/L FoxO1-F-XbaⅠ/FoxO1-R-NotⅠ 1.5 μl,cDNA 1 μl(10 ng),灭菌去离子水33 μl,KOD-Plus-Neo 1 μl,总体积50 μl。PCR反应条件:94℃ 2 min;98℃ 10 s,57℃ 30 s,68℃ 2 min,38循环;68℃ 5 min。产物经琼脂糖凝胶电泳和胶回收,得到带酶切位点的FoxO1片段。
1.2.3质粒的重组、扩增和鉴定 将pCDH-CMV-EF1-copGFP质粒用限制性内切酶XbaⅠ和NotⅠ双酶、电泳和回收,与FoxO1片段连接,得到pCDH-CMV-EF1-copGFP-FoxO1表达质粒。FoxO1-shRNA序列退火形成双链,AgeⅠ+EcoRⅠ酶切载体pMAGic 1.1,两者以T4连接酶连接,得到pMAGic 1.1-FoxO1-shRNA干扰质粒。将重组质粒转化DH5α细菌,并进行阳性克隆筛选、PCR扩增和测序鉴定。
1.2.4慢病毒包装和滴度检测 将上述重组质粒20 μg(表达质粒和干扰质粒)分别与pCMV-dR8.2 dvpr 12 μg、pCMV-VSV-G 10 μg混匀,转染HEK293T细胞。37℃、5%CO2培养过夜、换液,48 h和72 h观察荧光,收集上清。采用有限稀释法进行慢病毒滴度检测,病毒滴度=GFP+细胞数×稀释倍数。
1.2.5慢病毒载体感染Jurkat细胞 Jurkat细胞按1.25×105个/孔接种于24孔板,感染指数MOI=30,Polybrene=4 μg/ml。试验分组:FoxO1过表达组(FoxO1-overexpression group,感染表达慢病毒)、低表达组(FoxO1-inteferece group,感染干扰慢病毒)、对照组(control group,感染不含FoxO1表达基因或干扰基因的慢病毒)。
1.2.6荧光定量PCR 收集各组Jurkat细胞,Trizol法提取总RNA,按照TaKaRa公司的反转录及荧光定量试剂盒说明书进行反转录及荧光定量PCR,使用ABI7500Fast Real-time PCR System检测和分析FoxO1、S1P1、CCR7、CD62L和CD69 mRNA水平。
1.2.7Western blot 收集各组细胞,经RIPA裂解液提取细胞总蛋白,100℃水浴变性,依次经SDS-PAGE凝胶电泳和转膜、5%BSA封闭、一抗4℃孵育过夜和二抗室温孵育2 h后,用化学发光法在Bio-Rad凝胶成像仪上拍照,检测FoxO1、磷酸化的FoxO1(p-FoxO1)和KLF2蛋白表达水平。
1.2.8流式细胞术 收集各试验组细胞,分别加入PE标记的CCR7单抗、CD62L单抗,eFluor660或APC标记的S1P1、CD69单抗,每组2个重复孔,并设同型抗体对照,上流式细胞仪(BD Accuri-C6)检测并分析细胞表面S1P1、CCR7、CD62L和CD69分子表达。
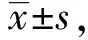
2 结果
2.1FoxO1重组质粒的鉴定 两种重组质粒分别转化DH5α感受态细菌后,随机挑取菌落进行质粒提取、PCR扩增和电泳,观察到5个表达质粒电泳结果均为阳性,9个干扰质粒中有2、4和6号为阳性,如图1。选取阳性菌落进行质粒提取并测序,经NCBI-blast验证确定重组阳性克隆。
2.2表达和干扰慢病毒对Jurkat细胞的感染效率 两种慢病毒载体分别感染Jurkat细胞120 h后,于荧光倒置显微镜下观察GFP荧光,计数,感染效率>70%,如图2。
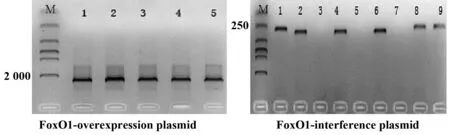
图1 FoxO1重组质粒鉴定结果Fig.1 Results of FoxO1 recombinant plasmid identification
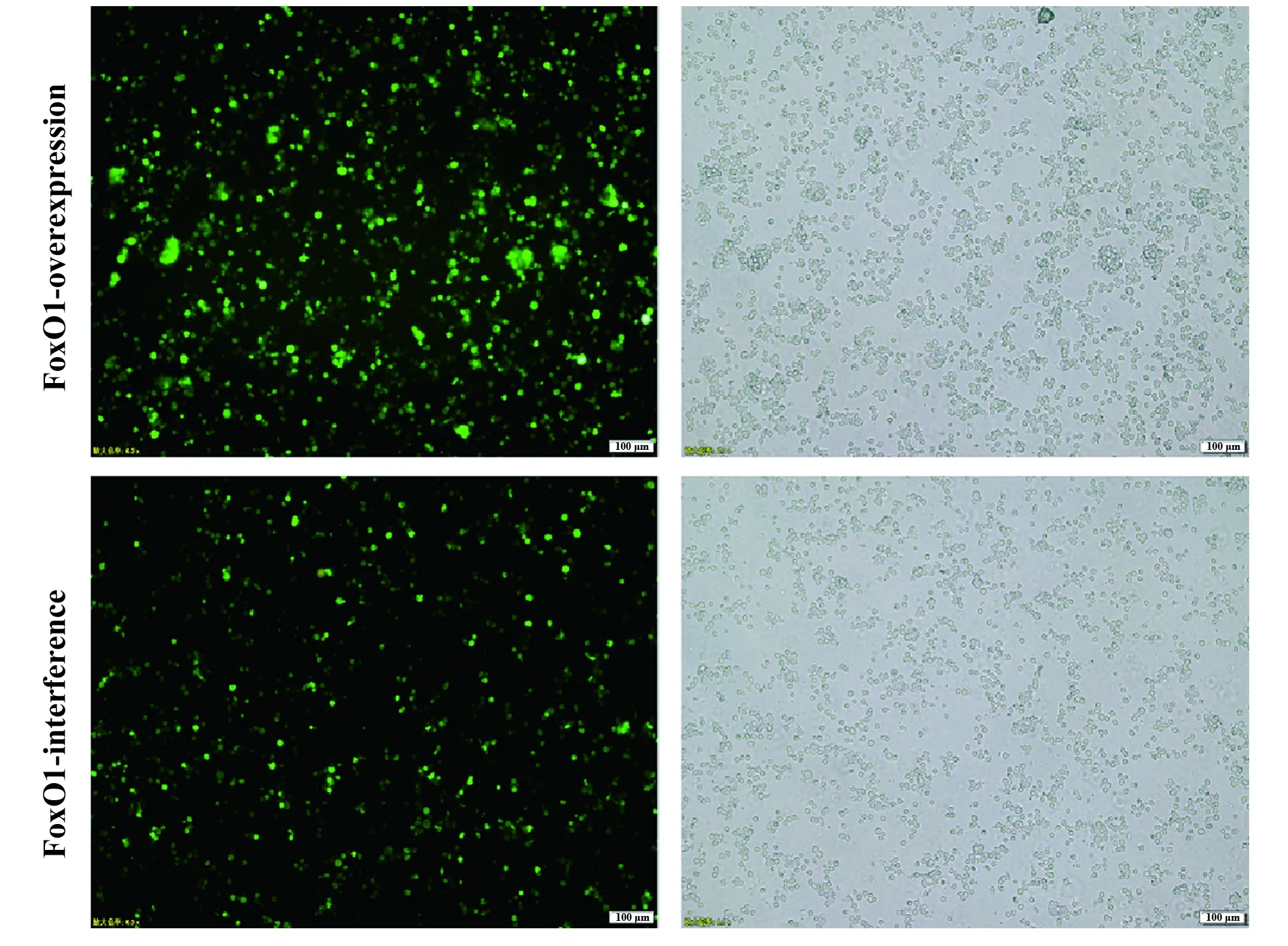
图2 Jurkat细胞感染慢病毒载体后120 h荧光倒置显微镜下GFP表达情况Fig.2 GFP expression in Jurkat cells under Fluorescence Inversion Microscope System after infection of 120 hNote:n=6.
2.3FoxO1基因对其下游分子mRNA在Jurkat细胞表达的影响 FoxO1基因转染120 h, 结果如图3所示过表达组FoxO1(35.25±0.94)、KLF2(1.81±0.51)、S1P1(1.42±0.16)和CD62L(1.61±0.11)mRNA水平均显著增高(P<0.05);CCR7(0.95±0.17)和CD69(1.12±0.12)未见改变(P>0.05);干扰组FoxO1(0.69±0.13)、 KLF2(0.52±0.07)、 S1P1(0.20±0.02)和CD62L(0.50±0.08)降低(P<0.05),CD69(6.58±3.30)升高(P<0.05),CCR7(2.66±1.09)未见改变(P>0.05)。
2.4FoxO1基因对FoxO1、p-FoxO1和KLF2蛋白水平的影响 如图4所示,FoxO1表达载体感染Jurkat细胞120 h后,FoxO1、p-FoxO1 和KLF2均高于对照组;干扰载体转染在72 h(图6A)和120 h后Jurkat细胞p-FoxO1、 FoxO1和KLF2低于对照组,干扰载体转染120 h比72 h时Jurkat细胞p-FoxO1、 FoxO1和KLF2表达抑制更显著。
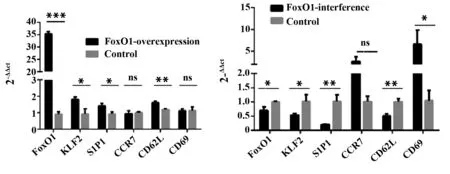
图3 Jurkat细胞感染FoxO1慢病毒感染120 h后mRNA表达的变化Fig.3 Change of mRNA level in Jurkat cells after infection of 120 hNote:n=6;*.P<0.05;**.P<0.01;***.P<0.000 1.
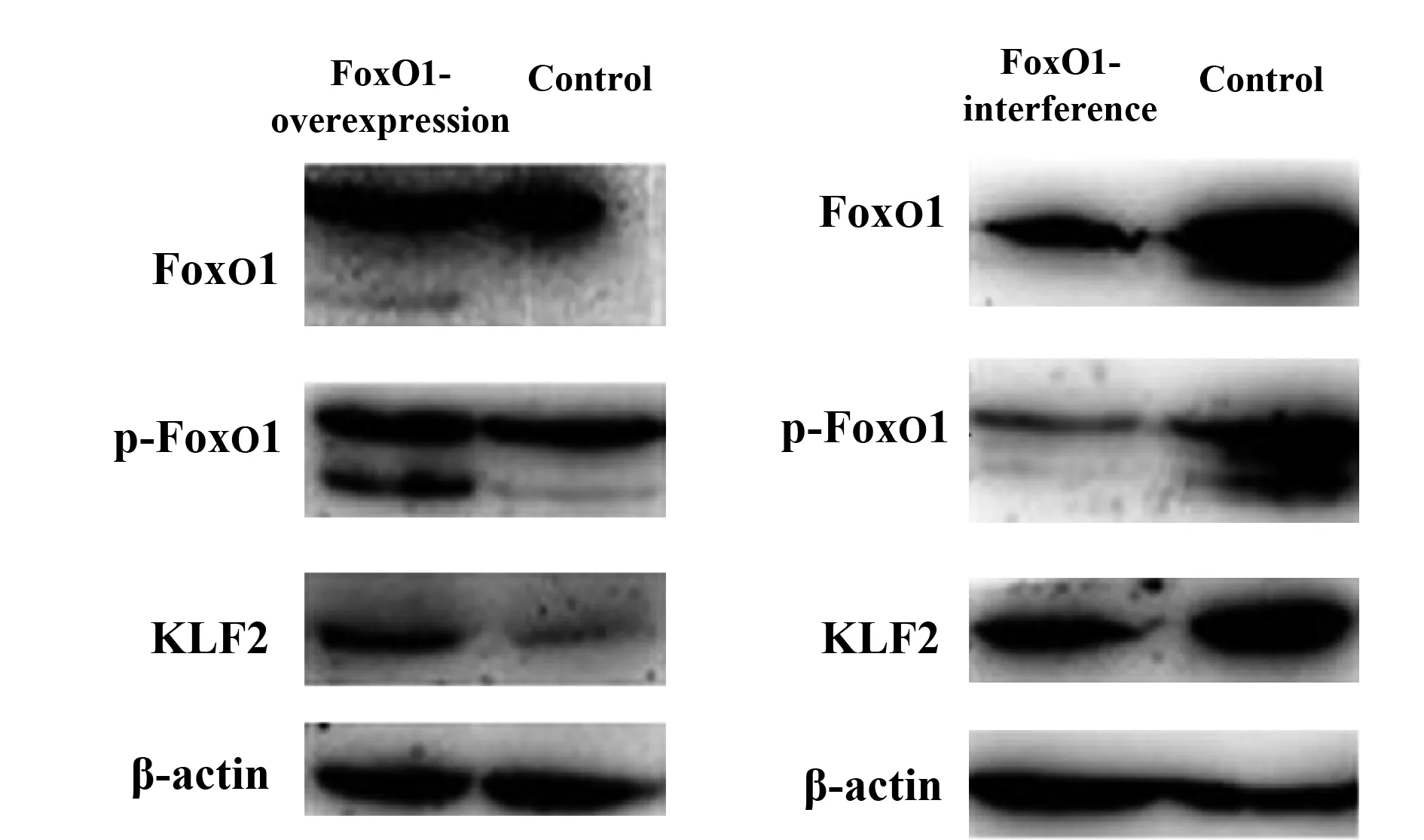
图4 Jurkat细胞FoxO1慢病毒感染120 h后,FoxO1、p-FoxO1和KLF2蛋白水平的改变Fig.4 Change of FoxO1,p-FoxO1 and KLF2 expression in Jurkat cells after infection of 120 hNote:n=6.

图5 过表达组在感染120 h后,GFP+Jurkat细胞S1P1、CCR7、CD62L和CD69的改变Fig.5 Change of S1P1,CCR7,CD62L and CD69 expression in GFP+ Jurkat cells after infection of 120 h in FoxO1-overexpression groupNote:n=6;*.P<0.05.
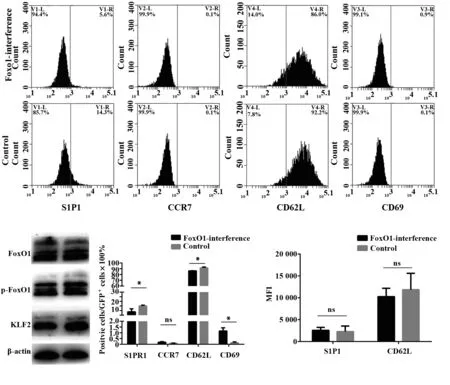
图6 干扰组在感染72 h后 ,GFP+Jurkat细胞S1P1、CCR7、CD62L和CD69的改变Fig.6 Change of S1P1,CCR7,CD62L and CD69 expression in GFP+ Jurkat cells after infection of 72 h in FoxO1-interference groupNote:A.The result of Western blot;B,C,D.The result of FCM;n=6;*.P<0.05.

图7 干扰组在感染120 h后,GFP+Jurkat细胞S1P1、CCR7、CD62L和CD69的改变Fig.7 Change of S1P1,CCR7,CD62L and CD69 expression in GFP+ Jurkat cells after infection of 120 h in FoxO1-interference group Note:n=6;*.P<0.05.
2.5FoxO1基因对Jurkat细胞S1P1、CD62L分子表达的影响 流式细胞分析结果显示:表达载体转120 h后,S1P1+细胞(4.72±1.14)和CD62L+细胞(79.03±0.03)百分比与对照组(分别为2.70±0.03,68.74±0.79)相比显著升高(P<0.05),CD69+染细胞和CCR7+细胞百分比无显著变化(P>0.05);S1P1和CD62L在平均荧光强度方面并没有显著改变(P>0.05),如图5。干扰载体转染72 h,S1P1+细胞(6.98±1.95)和CD62L+( 86.22±0.35)细胞百分比显著下降(对照组分别为15.12±1.13和92.20±0.25)P<0.05,CD69+细胞百分比(1.21±0.3)显著高于对照组(0.09±0.06),P<0.05,CCR7+细胞百分比未见改变;S1P1和CD62L在平均荧光强度方面并没有显著改变(P>0.05),如图6;至120 h S1P1+细胞(24.71±0.52)和CD69+细胞(2.59±0.46)呈现出增高趋势,与对照组(分别为4.02±0.87和0.05±0.1,P<0.05)相比显著升高,CD62L+细胞水平恢复至转染前水平,CCR7+细胞百分比未见改变;S1P1和CD62L在平均荧光强度方面并无显著改变(P>0.05),如图7。
3 讨论
在哺乳类动物中,转录因子FoxO1高表达于成熟的T、B淋巴细胞[3],在促进T细胞静默和维持外周耐受方面发挥关键作用,T细胞进入血-淋巴循环必须有FoxO1灭活,FoxO1的缺陷将导致T细胞持续活化和自身免疫病[11]。FoxO1通过促进外周调节性T细胞(Treg)的发育和功能而防止自身免疫病的发生[12],细胞体外培养发现FoxO1具有调节CD8+记忆T细胞分化的作用[11],Ouyang等[13]利用绿色荧光蛋白报告基因研究发现,未成熟胸腺细胞低表达FoxO1,分化成熟的胸腺细胞FoxO1表达显著增加,尤其在胸腺Treg比一般CD4单阳性细胞FoxO1增高更加显著,与外周T细胞的FoxO1表达量相似。因此,FoxO1在T细胞分化成熟及T细胞功能等方面均具有重要作用,而且FoxO1可被磷酸化为p-FoxO1,由细胞核转运至细胞质,从而转录功能受到抑制[5]。本文中,我们成功构建了慢病毒FoxO1表达载体和干扰载体,通过感染Jurkat细胞,人为造成FoxO1和p-FoxO1整体水平的过表达和低表达,观察到FoxO1在Jurkat细胞过表达引起一系列FoxO1下游分子(包括KLF2、S1P1和CD62L)mRNA和蛋白表达水平均升高,这与上述文献结果一致。在FoxO1下游分子中,S1P1是一种G蛋白偶联受体,其配体1-磷酸鞘氨醇(S1P)由血管内皮细胞等分泌,能介导成熟胸腺细胞离开胸腺进入外周[14,15],也同样介导成熟淋巴细胞从外周淋巴组织进入血液。CD62L又称L-选择素,其配体主要为内皮细胞和白细胞表面的寡糖基团,与S1P1一起共同影响淋巴细胞的迁移功能。
在FoxO1表达干扰组中,Jurkat细胞在转染72 h 表现为KLF2、S1P1和CD62LmRNA和蛋白水平的降低,但在120 h仅出现KLF2 mRNA水平及Western blot结果蛋白水平的降低,而流式结果与之不符,表现为S1P1+细胞升高,推测其原因是FoxO1基因表达受到干扰后早期可能出现S1P1+细胞的减少,随着细胞自身调节作用而使S1P1+细胞增多,提示该干扰表达载体仅在短期发挥作用。
文献报道已显示出FoxO1-KLF2-S1P1在调节T细胞发育、分化成熟和迁移、功能活性过程中的重要作用[16,17],我们构建的慢病毒FoxO1表达载体和干扰载体能有效调节Jurkat细胞KLF2、S1P1和CD62L等分子的表达,为开展T细胞、胸腺细胞等细胞内FoxO1-KLF2-S1P1信号通路调控和细胞相关功能的研究打下了基础。
[1] Salih DA,Brunet A.FoxO transcription factors in the maintenance of cellular homeostasis during aging[J].Curr Opin Cell Biol,2008,20(2):126-136.
[2] Xin Zhang,Safak Yalcin,Dung-Fang Lee,etal.FoxO1 is an essential regulator of pluripotency in human embryonic stem cells[J].Nat Cell Biol,2011,13(9):1092-1099.
[3] Hedrick SM,Hess Michelini R,Doedens AL,etal.FOXO transcription factors throughout T cell biology[J].Nat Rev Immunol,2012,12(9):649-661.
[4] Chang CF,D′Souza WN,Chen IL,etal.Polar opposites:Erk direction of CD4 T cell subsets[J].J Immunol,2012,189(2):721-731.
[5] Kerdiles YM,Beisner DR,Tinoco R,etal.FoxO1 links homing and survival of naive T cells by regulating L-selectin,CCR7 and interleukin 7 receptor[J].Nature Immunol,2009,10(2):176-184.
[6] Carlson CM,Endrizzi BT,Wu J,etal.Kruppel-like factor 2 regulates thymocyte and T-cell migration[J].Nature,2006,442(7100):299-302.
[7] 余思菲,吴长有.组织定居记忆性T细胞的免疫学特征研究进展[J].中国免疫学杂志,2017,33(7):1093-1100.
She SF,Wu CY.Advances in the immunological characteristics of tissue-dwelling memory T cells[J].Chin J Immunol,2017,33(7):1093-1100.
[8] Maeda Y,Yagi H,Takemoto K,etal.S1P lyase in thymic perivascular spaces promotes egress of mature thymocytes via up-regulation of S1P receptor 1[J].Int Immunol,2013,26(5):245-255.
[9] 陶弋婧,朱顺飞,陈 超,等.microRNA-7基因敲减对小鼠CD4+SP细胞胸腺发育的影响[J].中国免疫学杂志,2015,31(9):1173-1177.
Tao YJ,Zhu SF,Chen C,etal.Influence of microRNA-7 knock down on development of CD4+SP cells in murinethymus[J].Chin J Immunol,2015,31(9):1173-1177.
[10] 张 云,赵俊涛,刘萍萍,等.FoxO1-KLF2-S1P1在MG患者胸腺组织的表达[J].免疫学杂志,2015,31(2):181-184.
Zhang Y,Zhao JT,Liu PP,etal.The pilot study of Foxo1-KLF2-S1P1 in the thymus of patients with myasthenia gravis[J].Immunological J,2015,31(2):181-184.
[11] Teng F,Zhou YB,Jin R,etal.The molecular signature underlying the thymic migration and maturation of TCRab+CD4+CD8-thymocytes[J].PLoS One,2011,6(10):e25567.
[12] Ouyang W,Beckett O,Flavell RA,etal.An essential role of the Forkhead-box transcription factor Foxo1 in control of T cell homeostasis and tolerance[J].Immunity,2009,30(3):358-371.
[13] Ouyang W,Beckett O,Ma Q,etal.Foxo proteins cooperatively control the differentiation of Foxp3+regulatory T cells[J].Nat Immunol,2010,11(7):618-627.
[14] Rao RR,Li Q,Gubbels Bupp MR,etal.Transcription factor Foxo1 represses T-bet-mediated effector functions and promotes memory CD8(+) T cell differentiation[J].Immunity,2012,36(3):374-387.
[15] Ouyang WM,Liao W,Luo CT,etal.Novel Foxo1-dependent transcriptional programs control Treg cell function[J].J Immunol,2013,191(1):187-199.
[16] Borowsky AD,Bandhuvula P,Kumar A,etal.Sphingosine-1-phosphate lyase expression in embryonic and adult murine tissues[J].J Lipid Res,2012,53(9):1920-1931.
[17] Jin R,Aili A,Wang YQ,etal.Critical role of SP thymocyte motility in regulation of thymic output in neonatal Aire-/-mice[J].Oncotarget,2017,8(1):83-94.
