原花青素对人脐静脉内皮细胞功能及miR-221表达的影响
2018-03-22邹燕吴斐季昳弛何雪梅周翔宇
邹燕,吴斐,季昳弛,何雪梅,周翔宇
原花青素(procyanidine,PC)是一类广泛存在于自然界的黄烷-3-醇类化合物,具有抗氧化活性、抗心肌缺血再灌注损伤、抗动脉粥样硬化、保护血管内皮细胞、抗癌、降血压、降血脂、降血糖等生物活性[1-2],血管内皮的功能状态与这些疾病的发生发展及预后都有一定的关系。有研究表明PC可影响内皮细胞的功能,抑制内皮细胞增殖、迁移和血管新生[3-4],也有部分研究报道PC可以促进内皮细胞的增殖和血管新生[5-6]。目前PC的作用机制尚不清楚,其对内皮细胞功能的影响仍须进一步验证。
microRNA(miRNA)是一类非编码小RNA,可通过调控基因表达从而影响细胞的增殖、凋亡、分化、迁移、表型转换等各种生理过程[7-9]。miR-221在多种疾病的发生发展中具有重要作用[10],miR-221可以调节高糖诱导的内皮功能受损、调节内皮细胞NO的释放和炎性反应[11-13]。近期研究表明PC可通过调节microRNA的表达发挥调控细胞脂肪形成、抗癌细胞等生物活性[14-16],但目前PC影响HUVECs的功能是否与miR-221表达变化相关未见报道。本研究观察PC对HUVECs增殖和迁移的影响,并进一步探讨PC对内皮细胞中miR-221表达的影响。
1 材料与方法
1.1 材料、主要试剂 PC购自美国Sigma公司,人脐静脉内皮细胞(HUVECs)购自美国Science Cell公司,胎牛血清(FBS)购自Gibco公司,DMEM低糖培养基为美国HyClone公司产品,CCK-8试剂购自碧云天公司,RNA提取试剂盒、miRNA cDNA第一链合成试剂盒、miRNA荧光定量检测试剂盒、micro RNA上下游引物均购自天根生化有限公司。
1.2 方法
1.2.1 PC溶液的配制及细胞培养 500mg PC粉剂溶于5ml无菌注射用水中使其浓度为100mg/ml,置于–20℃避光保存备用。将HUVECs培养于含10%胎牛血清的DMEM低糖培养基中,置于37℃、5%CO2培养箱。将实验分为对照组及5、25、50、75、100μg/ml PC组,其中对照组不经PC处理,PC组分别予以5、25、50、75、100μg/ml PC处理24h。
1.2.2 CCK-8细胞增殖实验 待细胞培养至对数生长期,调整细胞密度为2×103/ml,每孔100μl接种于96孔培养板,在37℃、5% CO2培养箱中培养24h。待细胞贴壁生长良好时,吸弃原培养液,分别加入终浓度为0(对照)、5、25、50、75、100μg/ml PC的培养基培养24h,每组5个复孔。然后每孔加入5g/L的CCK-8溶液10μl继续培养1h。在酶标仪上检测450nm处的吸光度(OD)值。每组平均5个复孔,重复3次。
1.2.3 细胞划痕实验 在CCK-8实验中,50μg/ml PC能明显抑制HUVECs增殖活性,且不会表现出明显药理学毒性,故后续实验均选择50μg/ml PC进行。待细胞培养至对数生长期,调整细胞密度为2×105/ml,每孔2ml接种于6孔板中,培养24h后,待细胞间形成较紧密连接的单层,用200μl枪头垂直于背后的横线进行划痕。用PBS洗掉漂浮细胞后分别换以终浓度为0(对照)、50μg/ml PC溶液的2% 胎牛血清(FBS)的培养基继续培养。分别于培养0、6、24h时在倒置相差显微镜下观察并拍照,选择5个不同视野分别观察划痕创面愈合情况。采用Image J软件测定划痕面积,划痕愈合率=(0h的划痕面积-6h或24h的划痕面积)/0h的划痕面积×100%。实验重复3次。
1.2.4 荧光定量PCR检测 实验设为对照组和PC 50μg/ml组,分别予以含0、50μg/ml PC的完全培养基处理24h,再用细胞总RNA提取试剂盒提取HUVECs的总RNA,并测定RNA的浓度及完整性,质量检测合格后进行反转录成cDNA,以U6作为参照,再按说明书进行实时荧光定量PCR(RT-qPCR)反应。反应条件如下:95℃预变性15min;94℃20s、60℃ 34s,35个循环。最后通过解链曲线分析扩增产物的特异性,每个样本设置3个复孔,实验重复3次。microRNA的相对表达量用2–ΔΔCt表示,其中∆Ct=Ct目标微小RNA-CtU6,∆∆Ct=∆Ct处理-∆Ct对照。
1.2.5 miR-221的靶基因预测及GO分析、KEGG Pathway分析 在miRWalk数据库(http∶//zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk/index.html)中预测miR-221的靶基因,取Target Scan、mi Randa、miRDB、miRWalk中的靶基因的交集作为预测的靶基因。在DAVID数据库(https∶//david.ncifcrf.gov/)里进行miR-221预测靶基因的GO分析和KEGG Pathway分析,找出与细胞增殖、迁移相关的靶基因和信号通路。
1.3 统计学处理 采用SPSS 17.0统计软件分析,计量资料以表示,CCK-8实验中各组OD值比较采用单因素方差分析,进一步两两比较采用LSD-t检验;对划痕实验和荧光定量PCR检测数据比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 PC对HUVECs增殖活性的影响 在正常培养的条件下,不同浓度PC处理HUVECs 24h,5μg/ml PC对HUVECs的增殖活性影响不大(P>0.05),而25、50、75、100μg/ml PC呈浓度依赖性抑制HUVECs的增殖活性(P<0.01,图1)。虽然25μg/mlPC组能抑制细胞增殖,但是50μg/ml PC组抑制HUVECs增殖活性更强,而75μg/ml PC组和100μg/ml PC组又呈现过强抑制细胞增殖的作用,故后续实验选择了能呈现出一定抑制细胞增殖作用又不呈现明显药理学毒性的50μg/ml浓度PC进行后续实验。

图1 不同浓度的 PC对HUVECs增殖的影响(n=5)Fig.1 Effects of different concentrations of PC on the proliferation of HUVECs (n=5)
2.2 PC对HUVECs迁移能力的影响 HUVECs划痕实验结果提示,划痕6h后,50μg/ml PC组的划痕愈合率(7.85%±0.58%)明显低于对照组(29.71%±2.06%),差异有统计学意义(P=0.0005);划痕24h后,50μg/ml PC组的划痕愈合率(21.10%±0.84%)明显低于对照组(83.60%±4.50%),差异仍有统计学意义(P=0.0002,图2)。

图2 划痕实验检测PC对HUVECs迁移能力的影响Fig.2 Scratching pictures of HUNECs of control group and 50μg/ml PC group at 0, 6, 24h time point PC. Procyanidine
2.3 miR-221的表达变化 荧光定量PCR检测结果显示,U6和miR-221的熔解曲线均为单峰,产物单一,显示引物特异性比较好,无非特异性扩增和引物二聚体干扰(图3)。对照组miR-221的相对表达水平(1.099±0.170)明显低于50μg/ml PC组(3.261±0.205),差异有统计学意义(P<0.0001)。
2.4 miR-221靶基因的预测 在miRWalk数据库中预测has-miR-221的靶基因,取Target Scan、miRanda、miRDB、miRWalk中靶基因的交集作为预测的靶基因,共203个。将这些靶基因在DAVID数据库中进行GO分析和KEGG Pathway分析,结果显示,与细胞增殖有关的靶基因有ADAM17、KIT、ST8SIA1、CDKN1B、EFNB2、EIF5A2、GDF9、HIPK1、KDR、NTF3、PDGFD(图4);与细胞迁移有关的靶基因有ADAM17、KIT、CYR61、KDR、NTF3、PIK3R1、PDGFD、SEMA3C、SEMA6D(图5)。KEGG pathway分析结果如图6,靶基因富集FoxO信号通路(FoxO signaling pathway)、癌症胆碱能代谢信号通路(Choline metabolism in cancer)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、烟瘾信号通路(Nicotine addiction)、逆行内源性大麻素信号通路(Retrograde endocannabinoid signaling)5条信号通路。
3 讨 论
近年来,天然植物类药物(比如PC、白藜芦醇等)因为其毒副作用小、来源广泛等众多优点被广泛用于新药的基础及临床研究中。PC的抗氧化活性、防治心血管疾病、抗肿瘤、抑制血管新生等生物学活性已被证实。在内皮细胞的功能方面,近期的研究表明PC可以影响内皮细胞增殖、迁移和血管新生:Kumar等[4]报道20~40μg/ml原花青素B2-3,3"-二-氧-没食子酸酯(B2G2)可通过调节血管
内皮生长因子受体2/磷脂酰肌醇3激酶/苏氨酸激酶通路(VEGFR2/PI3K/Akt通路)和整合素信号转导通路抑制内皮细胞生长、运动和血管新生,而在10μg/ml的浓度下对内皮的功能无明显影响;也有学者Garcia-Conesa等[3]报道PC在10μg/ml浓度下可抑制HUVECs迁移并调节具有血栓形成型1基序的金属肽酶(ADAMTS1)、凝血酶敏感蛋白1(THBS1)、内皮素-1(ET-1)等迁移增殖相关基因的表达。但马丽等[6]报道PC在10~100μg/ml的浓度下可促进HUVECs增殖,而在200~800μg/ml的浓度下则抑制内皮细胞增殖;Liu等[5]报道PC可能通过减轻高糖条件下对内皮祖细胞的氧化损伤,上调VEGFR-2的表达及其下游信号通路,促进细胞增殖和管形成。而本研究发现5~100μg/ml PC培养HUVECs 24h后,5μg/ml PC对HUVECs的增殖影响不大,25、50、75、100μg/ml的PC呈浓度依赖性抑制HUVECs的增殖,在不呈现明显药理学毒性的条件下,50μg/ml PC可明显抑制HUVECs增殖(P<0.01);在划痕实验中,50μg/ml PC在划痕后6h和24h均能明显抑制HUVECs的迁移(P<0.01)。PC对内皮细胞功能的不一致性可能是因为PC是一类由黄烷-3-醇如儿茶素和表儿茶素等的寡聚或多聚物组成的混合物,而各研究中使用的PC寡聚或多聚物含量组成或结构式并未一致,可能在低浓度时或者某些结构式的条件下可以促进内皮细胞增殖和迁移,而在高浓度或另一种结构式的条件下则抑制内皮增殖和迁移,但其具体作用机制有待进一步研究。
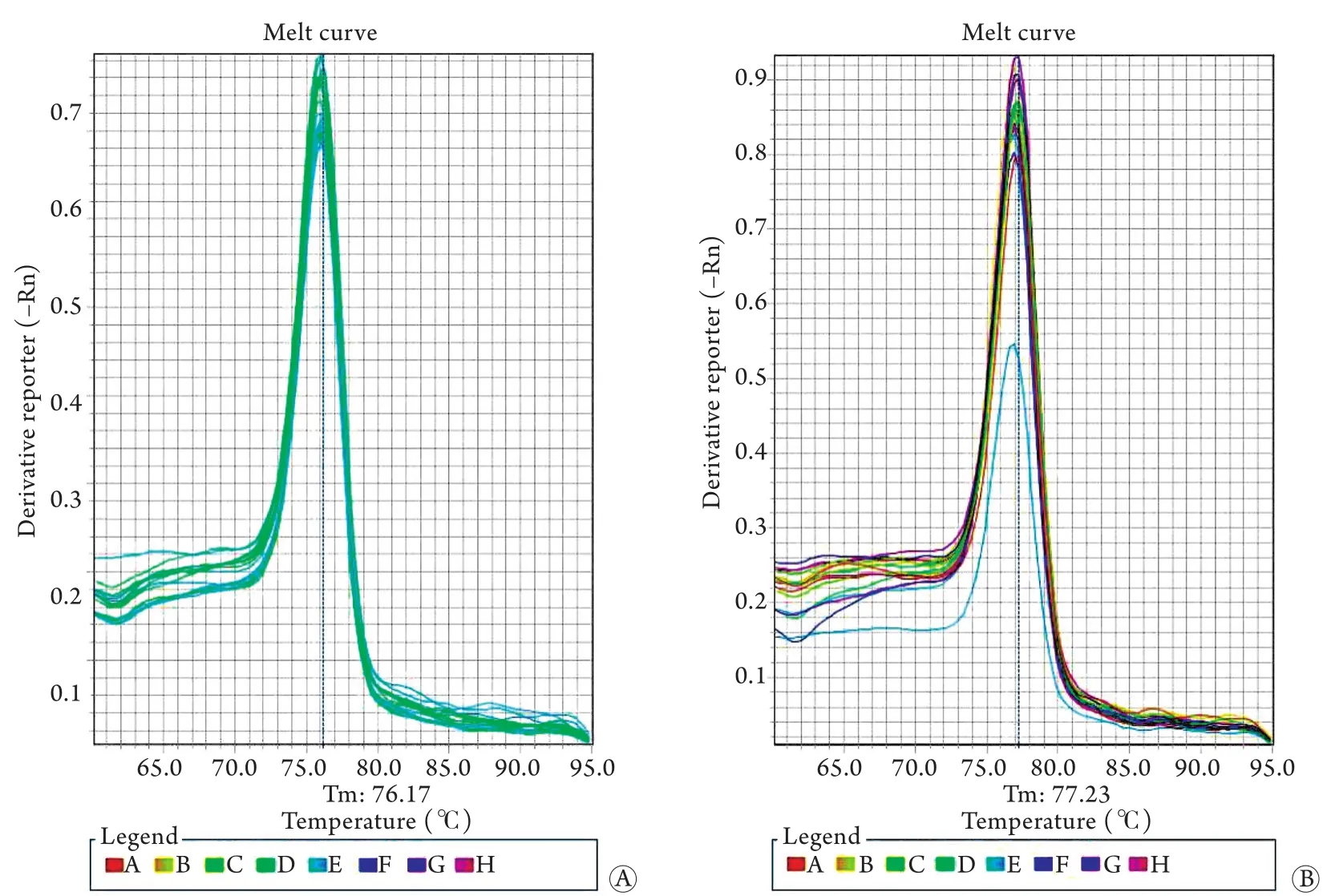
图3 U6和miR-221的熔解曲线Fig.3 The melting curves of U6 and miR-221 A. U6; B. miR-221

图4 与细胞增殖相关的hsa-miR-221靶基因的GO分析Fig.4 GO analysis of hsa-miR-221 target gene related to cell proliferation

图5 与细胞迁移相关的hsa-miR-221靶基因的GO分析Fig.5 GO analysis of hsa-miR-221 target gene related to cell migration

图6 hsa-miR-221的靶基因KEGG信号通路分析结果Fig.6 KEGG pathway analysis of hsa-miR-221 target genes
PC可以调节miRNA的表达变化从而控制细胞的功能,Zhang等[14]报道PC可调节3T3-L1细胞miR-483-5p的表达从而抑制脂肪形成,Mao等[15]报道葡萄籽PC抗肺癌的机制与microRNA-19a/b调节有关,Castell-Auví等[16]还发现PC可以通过改变miRNA的表达模式发挥其对胰岛的生物活性。本研究结果发现50μg/ml PC处理HUVECs 24h后会促进miR-221的表达(P<0.01)。miRNA-221与血管内皮细胞的增殖、迁移、凋亡等功能密切相关,且已有研究发现miR-221可抑制内皮细胞的迁移、黏附、小管形成[17-20]。Zhang等[21]的研究结果显示,在内皮祖细胞(EPC)中,miR-221可通过调控丝氨酸/苏氨酸蛋白酶靶向抑制EPC的增殖。另外,miR-221还可以保护内皮细胞、调节一氧化氮(NO)的释放和炎性反应[11-13]。本研究发现PC可以抑制HUVECs的增殖和迁移(P<0.01)并且可以上调HUVECs的miR-221表达(P<0.01),故推测PC抑制HUVECs增殖和迁移可能与调节miR-221的表达有关。进一步通过miR-221靶基因分析结果发现其靶基因主要与细胞增殖、迁移等功能有关,KEGG Pathway分析得出其靶基因富集FoxO信号通路、癌症胆碱能代谢信号通路、PI3KAkt信号通路、烟瘾信号通路、逆行内源性大麻素信号通路5条信号通路,分析发现FoxO信号通路涉及miR-221靶基因BCL2L11、ATG12、CDKN1B、NLK、PIK3R1、SOD2调控细胞周期、凋亡、自噬、氧化应激和DNA修复,癌症胆碱能代谢信号通路通路涉及miR-221靶基因FOS、LYPLA1、PIK3R1、PDGFD、SLC22A3调控甘油磷脂代谢,PI3K-Akt信号通路涉及miR-221靶基因BCL2L11、KIT、CDKN1B、KDR、PIK3R1、PDGFD、THBS2、YWHAG调控细胞周期、细胞活力,烟瘾信号通路涉及miR-221靶基因GABRG1、GABRG2、SLC17A8调节突触传递,逆行内源性大麻素信号通路涉及miR-221靶基因GABRG1、GABRG2、ITPR2、SLC17A8调节细胞去极化抑制和钙离子释放,其中FoxO信号通路和PI3K-Akt信号通路通过miR-221靶基因参与调控细胞周期、细胞活力、细胞凋亡,因此我们推测PC可能是通过上调miR-221的表达调节FoxO信号通路和PI3K-Akt信号通路来抑制HUVECs的增殖和迁移,其分子机制仍有待进一步验证。
综上所述,本研究发现PC可抑制HUVECs增殖及迁移并上调miR-221的表达,通过miR-221的靶基因分析推测PC抑制HUVECs增殖及迁移的机制可能涉及PIK3R1、BCL2L11、ADAM17、KIT等靶基因和FoxO信号通路、PI3K-Akt信号通路。这为今后PC的基础研究、临床研究及应用提供了理论依据。
【参考文献】
[1]Zhang Y, Wu XX. Research progress on procyanidins[J].Pharmacol Clin Chin Mater Med, 2011, 27(6)∶ 112-116. [张妍, 吴秀香.原花青素研究进展[J].中药药理与临床, 2011,27(6)∶ 112-116.]
[2]Zhang HW, Zhang Yu, Ma CM. Progress in procyanidins research[J].Food Sci, 2015, 36(5)∶296-304. [张慧文, 张玉, 马超美. 原花青素的研究进展[J].食品科学, 2015, 36(5)∶ 296-304.]
[3]Garcia-Conesa MT, Tribolo S, Guyot S,et al. Oligomeric procyanidins inhibit cell migration and modulate the expression of migration and proliferation associated genes in human umbilical vascular endothelial cells[J]. Mol Nutr Food Res,2009, 53(2)∶ 266-276.
[4]Kumar R, Deep G, Wempe MF,et al. Procyanidin B2 3,3″-di-O-gallate inhibits endothelial cells growth and motility by targeting VEGFR2 and integrin signaling pathways[J]. Curr Cancer Drug Targets, 2015, 15(1)∶ 14-26.
[5]Liu Y, Liao WJ, Zhu Z,et al. Effect of procyanidine on VEGFR-2 expression and transduction pathway in rat endothelial progenitor cells under high glucose conditions[J]. Genet Mol Res, 2016, 15(1). doi∶ 10.4238/gmr.15016925.
[6]Ma L, Li BY, Gao HQ. The effect of proanthocyanidins on the proliferation of vascular endothelial cells[J]. Chin J Gerontol,2008, 28(4)∶ 346-347. [马丽, 李保应, 高海青. 原花青素对血管内皮细胞增殖活性的影响[J]. 中国老年学杂志, 2008,28(4)∶ 346-347.]
[7]Deiuliis JA. MicroRNAs as regulators of metabolic disease∶pathophysiologic significance and emerging role as biomarkers and therapeutics[J]. Int J Obes (Lond), 2016, 40(1)∶ 88-101.
[8]Huang CF, Fu QM, Zhou Y,et al. Mechanism of inhibitory effect of miRNA-33a on proliferation of HCT-116 cells[J]. Med J Chin PLA, 2016, 41(9)∶ 725-729. [黄重发, 付启梅, 周怿, 等.miRNA-33a抑制人结肠癌细胞HCT-116增殖的机制研究[J].解放军医学杂志, 2016, 41(9)∶ 725-729.]
[9]Che MW, Yan J, Gong LF,et al. The role of SRF- miRNA-143-KLF-4 signal pathway in the HPMC phenotypic transition inducedviahigh glucose[J]. Med J Chin PLA, 41(12)∶ 998-1004. [车明文, 闫计, 龚莉芳, 等. SRF-miRNA-143-KLF-4信号通路在高糖诱导的人腹膜间皮细胞表型转换中的作用[J].解放军医学杂志, 2016, 41(12)∶ 998-1004.]
[10] Song J, Ouyang Y, Che J,et al. Potential value of miR-221/222 as diagnostic, prognostic, and therapeutic biomarkers for diseases[J]. Front Immunol, 2017, 8∶ 56.
[11] Chen CF, Huang J, Li H,et al. MicroRNA-221 regulates endothelial nitric oxide production and inflammatory response by targeting adiponectin receptor 1[J]. Gene, 2015, 565(2)∶246-251.
[12] Cerda A, Fajardo CM, Basso RG,et al. Role of microRNAs 221/222 on statin induced nitric oxide release in human endothelial cells[J]. Arq Bras Cardiol, 2015, 104(3)∶ 195-201.
[13] Li Y, Song YH, Li F,et al. MicroRNA-221 regulates high glucoseinduced endothelial dysfunction[J]. Biochem Biophys Res Commun, 2009, 381(1)∶ 81-83.
[14] Zhang J, Huang Y, Shao H,et al. Grape seed procyanidin B2 inhibits adipogenesis of 3T3-L1 cells by targeting peroxisome proliferator-activated receptor gamma with miR-483-5p involved mechanism[J]. Biomed Pharmacother, 2017, 86∶ 292-296.
[15] Mao JT, Xue B, Smoake J,et al. MicroRNA-19a/b mediates grape seed procyanidin extract-induced anti-neoplastic effects against lung cancer[J]. J Nutr Biochem, 2016, 34∶ 118-125.
[16] Castell-Auví A, Cedó L, Movassat J,et al. Procyanidins modulate microRNA expression in pancreatic islets[J]. J Agric Food Chem, 2013, 61(2)∶ 355-363.
[17] Poliseno L, Tuccoli A, Mariani L,et al. MicroRNAs modulate the angiogenic properties of HUVECs[J]. Blood, 2006, 108(9)∶3068-3071.
[18] Duan M, Yao H, Hu G,et al. HIV Tat induces expression of ICAM-1 in HUVECs∶ implications for miR-221/-222 in HIV-associated cardiomyopathy[J]. PLoS One, 2013, 8(3)∶ e60170.
[19] Gong AY, Hu G, Zhou R,et al. MicroRNA-221 controls expression of intercellular adhesion molecule-1 in epithelial cells in response to Cryptosporidium parvum infection[J]. Int J Parasitol, 2011, 41(3-4)∶ 397-403.
[20] Zhu N, Zhang D, Chen S,et al. Endothelial enriched microRNAs regulate angiotensin II-induced endothelial inflammation and migration[J]. Atherosclerosis, 2011, 215(2)∶ 286-293.
[21] Zhang X, Mao H, Chen JY,et al. Increased expression of microRNA-221 inhibits PAK1 in endothelial progenitor cells and impairs its functionviac-Raf/MEK/ERK pathway[J]. Biochem Biophys Res Commun, 2013, 431(3)∶ 404-408.
