Sestrin2对高迁移率族蛋白B1诱导树突细胞凋亡的保护作用
2018-03-22王丽雪祝筱梅董宁任超卢中秋姚咏明
王丽雪,祝筱梅,董宁,任超,卢中秋,姚咏明
脓毒症(sepsis)是机体对感染反应失调所致的危及生命的器官功能障碍,包括全身炎症反应、免疫功能紊乱等病理过程[1]。在重症监护病房中,脓毒症的发病率高,治疗困难,是患者死亡的主要原因之一[2-3]。越来越多的证据表明,免疫功能障碍在脓毒症发生发展中具有重要作用,而树突细胞(dendritic cells,DC)凋亡是其关键环节之一[4]。在脓毒症及烧伤模型中脾脏DC显著减少,且DC凋亡及数量下降与脓毒症病情严重程度和不良预后密切相关[5]。高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)是一种重要的脓毒症晚期细胞因子,参与脓毒症状态下多器官损害的发生与发展[6]。本课题组既往研究证实,HMGB1对DC的免疫功能具有双向调节作用,一定浓度的HMGB1刺激可诱导DC成熟,而高浓度HMGB1则可能导致DC的免疫应答反应降低[7],但其确切的调控机制尚不明了。
Sestrins(SESNs)是一类在进化上高度保守的应激诱导蛋白家族,当细胞处于应激状态时其表达上调。SESNs广泛存在于动物体内,其中脊椎动物中具有3种SESNs基因,即SESN1、SESN2和SESN3[8]。Sestrin2(SESN2,亦称Hi95)是SESNs蛋白家族的重要成员,可被多种代谢应激条件激活,如缺氧、DNA损伤、氧化应激和内质网应激(endoplasmic reticulum stress,ERS)等。研究显示,SESN2表达活化在减少活性氧簇(reactive oxygen species,ROS)聚集、维持能量平衡、增强细胞自噬、降低蛋白质合成、减缓代谢性疾病进展和调节细胞生长等方面具有重要作用[9]。本研究探讨HMGB1刺激对未成熟DC细胞系DC2.4中SESN2表达的影响,并通过干预SESN2基因表达进一步观察SESN2在HMGB1诱导的DC凋亡效应中的作用及意义。
1 材料与方法
1.1 主要材料及试剂 小鼠树突细胞系DC2.4购自赛百慷(上海)生物技术股份有限公司。重组人HMGB1(Sigma公司,美国);兔抗小鼠SESN2单克隆抗体(Abcam公司,美国);兔抗小鼠胱天蛋白酶(cleaved-caspase-3)多克隆抗体、兔抗小鼠Bcl-2单克隆抗体、异硫氰酸荧光素(FITC)标记羊抗兔二抗(Cell Signaling Technology公司,美国);SESN2 siRNA干扰病毒、SESN2 LV-RNA过表达病毒(上海汉恒生物科技有限公司);藻红蛋白荧光素(PE)-Annexin V/7-AAD凋亡试剂盒(BD公司,美国)。辣根过氧化物酶(HRP)偶联羊抗兔二抗及羊抗鼠二抗、ECL显影液、BCA蛋白定量试剂盒、预染蛋白Marker均购自北京普利莱基因技术有限公司。
1.2 实验方法
1.2.1 细胞培养及分组 DC2.4细胞加入含10%胎牛血清(FBS)的RPMI 1640培养基中,置37℃、5%CO2培养箱中培养,根据细胞生长状况每2~3d更换培养基继续培养或者进行细胞传代培养。实验一:将复苏后的DC2.4培养至3~4代后进行分组,包括正常对照组及HMGB1组,HMGB1组给予10ng/ml HMGB1分别刺激8、24、48h(n=4);实验二:将细胞分正常对照组和1、10、100ng/ml HMGB1组(n=4),分别给予相应浓度HMGB1刺激48h;实验三:将细胞分为过表达空载体组(NC)、过表达空载体HMGB1(100ng/ml)刺激组(NC+HMGB1)、过表达病毒组(LV-RNA)、过表达病毒HMGB1(100ng/ml)刺激组(LV-RNA+HMGB1)、沉默空载体组(NS)、沉默空载体HMGB1(100ng/ml)刺激组(NS+HMGB1)、沉默病毒组(siRNA)、沉默病毒HMGB1(100ng/ml)刺激组(siRNA+HMGB1)(n=4)。实验一、实验二分组分别用于SESN2表达及细胞凋亡的检测,实验三用于转染病毒后细胞凋亡的检测。
1.2.2 Western blotting检测蛋白表达 收集并裂解细胞,采用BCA法进行蛋白定量。SDS-PAGE电泳分离目的蛋白,采用半干转法将蛋白转移至硝酸纤维膜上,然后置于10%脱脂奶粉中室温封闭2h,一抗(1∶1000)4℃过夜、二抗室温孵育1h后,采用ECL显影试剂盒显影、成像,凝胶成像仪观察,Image J软件分析各组灰度值的强弱。
1.2.3 共聚焦激光显微镜(LSCM)观察SESN2在细胞中的定位 将不同刺激组细胞收集于流式管中,PBS清洗2次,4%多聚甲醛室温下固定30min,PBS清洗2次,0.2% Tritonx-100穿孔约20min;PBS冲洗2次,1% BSA封闭30min,加入一抗(1∶200)4℃孵育过夜,PBS清洗2次,加入荧光二抗(1∶500)37℃孵育1h,PBS清洗1次,将细胞重悬于约10μl PBS中,滴在盖玻片上,再滴加约5μl的封片液,在激光扫描共聚焦显微镜下观察蛋白的表达及其在细胞中的定位。
1.2.4 慢病毒转染 将DC2.4以2×106/ml密度接种于6孔板,参照汉恒生物科技有限公司的慢病毒使用说明书进行操作,转染作用10h后,换用含10%FBS的RPMI 1640完全培养基,继续培养3d,荧光倒置显微镜下观察转染后细胞绿色荧光(GFP)的表达。在最佳转染条件下(siRNA的MOI=30,LV-RNA的MOI=45,聚凝胺(polybrene)终浓度为6μg/ml;其流式检测GFP阳性率均>90%),将制备好的以上细胞按1.2.1中实验三的方法进行分组(n=4),其中各HMGB1组给予浓度为100ng/ml的HMGB1刺激48h。
1.2.5 流式细胞术检测DC2.4细胞凋亡情况 取各组DC2.4细胞,PBS洗2次,加100μl缓冲液重悬细胞,按组别分别加入5μl PE-Annexin V和5μl 7-AAD,室温避光孵育15min,200μl缓冲液重悬细胞,1h内通过流式细胞分析仪检测凋亡率。
1.3 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析(ANOVA),进一步两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结 果
2.1 HMGB1对SESN2蛋白表达的影响 与正常对照组比较,10ng/ml HMGB1刺激不同时间(8、24、48h)后,DC2.4细胞中SESN2蛋白表达水平逐渐升高,其中24h及48h的SESN2蛋白表达水平明显高于正常对照组及8h,且48h的SESN2蛋白表达水平明显高于24h,差异均有统计学意义(P<0.05);刺激8h时的SESN2表达水平有所下降,但与正常对照组比较差异无统计学意义(P>0.05,图1A)。1、10、100ng/ml HMGB1刺激DC2.4细胞48h后,SESN2蛋白表达水平均明显高于正常对照组,且10、100ng/ml HMGB1刺激组SESN2蛋白表达水平明显高于1ng/ml HMGB1刺激组,差异均有统计学意义(P<0.05,图1B)。
2.2 SESN2在DC2.4细胞中的定位及表达 共聚焦激光显微镜分析显示,SESN2蛋白在DC2.4中主要定位于细胞质及核周,100ng/ml HMGB1刺激48h后其表达较正常对照组明显增强(图2A、B)。

图1 HMGB1对DC2.4细胞中SESN2蛋白表达的影响(n=4)Fig. 1 Effect of HMGB1 on the expression of SESN2 in DC2.4 cells (n=4)
2.3 HMGB1对DC2.4细胞凋亡率及凋亡相关蛋白表达的影响 采用上述实验一、二分组的细胞进行检测发现,与正常对照组比较,10ng/ml HMGB1刺激DC2.4不同时间,可诱导DC2.4凋亡逐步增加,以100ng/ml HMGB1作用48h最为显著;不同浓度(1、10、100ng/ml)HMGB1刺激48h均可诱导DC2.4凋亡增加,其中10、100ng/ml HMGB1作用48h后DC2.4细胞凋亡率(分别为17.02%±4.85%、17.48%±4.04%)明显高于正常对照组(7.35%±1.33%),差异有统计学意义(P<0.05,图3A)。Western blotting分析显示,10、100ng/mlHMGB1刺激48h后,DC2.4细胞中cleaved-caspase-3活性明显升高,100ng/ml HMGB1刺激48h后,DC2.4细胞中Bcl-2表达明显降低,与正常对照组比较差异有统计学意义(P<0.05,图3B)。

图2 SESN2蛋白在DC2.4细胞中的定位(共聚焦激光显微镜 ×400)Fig. 2 The localization of SESN2 in DC2.4 cells (laser scanning confocal microscopy ×400)FITC labeled SESN2 protein, the peak absorption is 488nm (green), DAPI stained nucleus, the peak absorption is 340nm (blue)
2.4 调控SESN2表达对HMGB1诱导DC2.4细胞凋亡的影响
2.4.1 转染LV-RNA和siRNA对SESN2表达的影响采用慢病毒转染技术转染SESN2 LV-RNA可显著上调DC2.4细胞中SESN2蛋白的表达,与正常对照组及空载体组比较差异有统计学意义(P<0.01,图4A);而转染SESN2 siRNA后DC2.4细胞中SESN2蛋白表达与空载体组比较明显下调(P<0.05),但与正常对照组比较差异无统计学意义(P>0.05,图4B)。
2.4.2 干预SESN2基因表达对HMGB1诱导的DC2.4细胞凋亡率及凋亡相关蛋白表达的影响 与空载体组比较,SESN2 LV-RNA转染组HMGB1诱导的DC2.4细胞凋亡率明显降低(35.57%±1.69%vs.49.04%±4.87%,P<0.05,图5A、C),且DC2.4细胞中cleaved-caspase-3活性明显下降(P<0.05),而抗凋亡蛋白Bcl-2表达明显增高(P<0.05,图5E)。与空载体组比较,转染SESN2 siRNA沉默SESN2基因表达后,HMGB1诱导的DC2.4细胞凋亡率明显增高(65.96%±2.50%vs. 50.01%±2.07%,P<0.05,图5B、D),且DC2.4细胞中cleaved-caspase-3活性明显升高、抗凋亡蛋白Bcl-2表达明显降低,差异有统计学意义(P<0.05,图5F)。
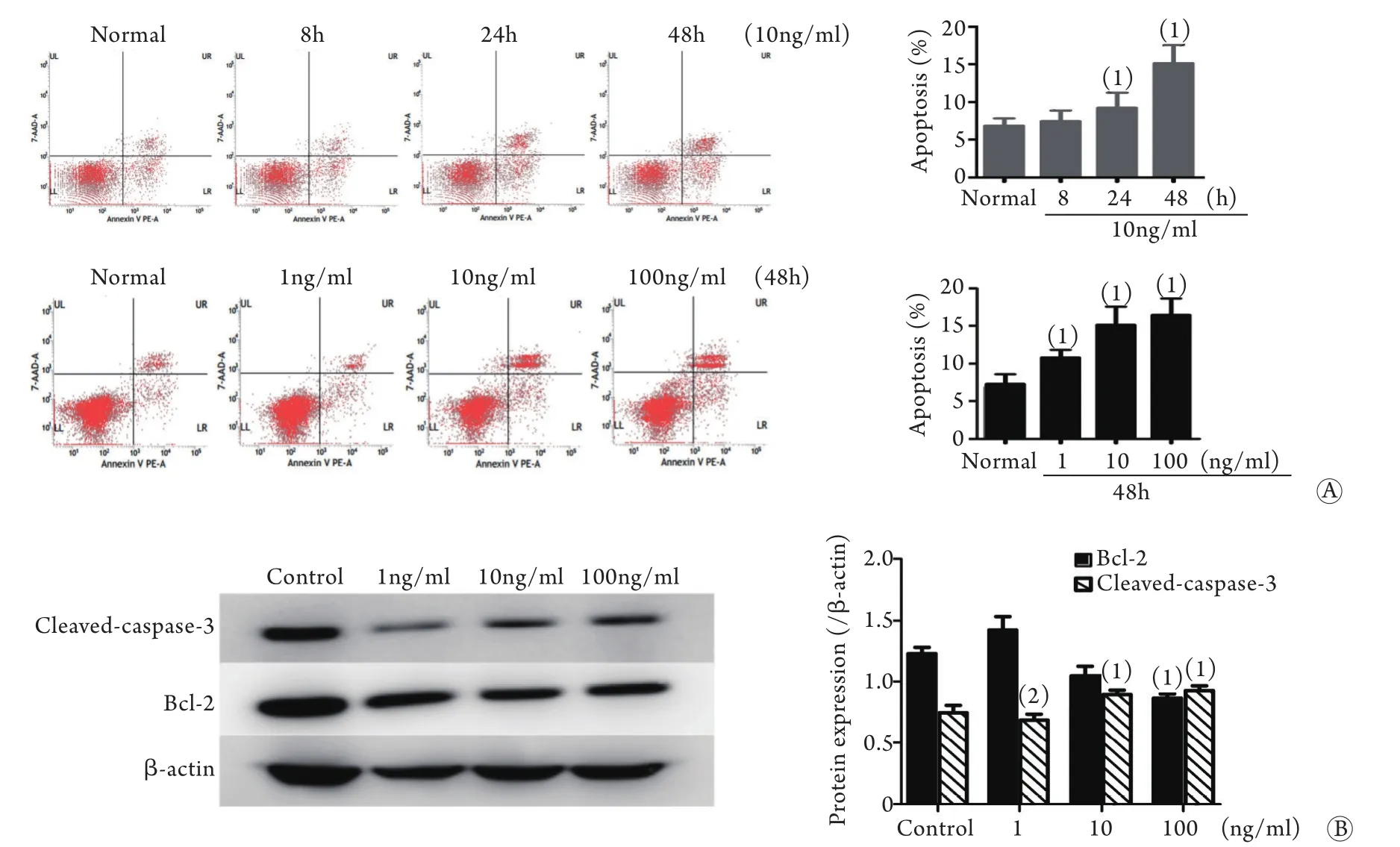
图3 HMGB1对DC2.4细胞凋亡及凋亡相关蛋白表达的影响(n=4)Fig. 3 Effect of HMGB1 on the cell apoptosis of DC2.4 cells and the expression of apoptosis related protein (n=4)

图4 转染SESN2 LV-RNA和SESN2 siRNA对DC2.4细胞中SESN2蛋白表达的影响(Western blotting,n=4)Fig. 4 Effect of LV-RNA or siRNA transfection on the expression of SESN2 in DC2.4 cells (Western blotting, n=4)
3 讨 论
脓毒症是一种复杂的感染并发症,涉及许多交叉级联反应的激活,包括炎症、凝血、氧化应激和细胞凋亡等[10]。在脓毒症的发展过程中,免疫细胞(如DC、T淋巴细胞和巨噬细胞等)的凋亡可导致免疫功能紊乱、多器官功能障碍,甚至引起死亡[11]。DC是体内重要的抗原提呈细胞(APC),是连接固有免疫与适应性免疫的桥梁[12],其凋亡在脓毒症免疫功能异常中具有重要意义,与脓毒症患者预后密切相关[5],而胞外分泌的HMGB1可调节DC的成熟、活化及凋亡[13]。本课题组前期研究证实,HMGB1作为一种潜在的免疫调节因子,参与调节DC和T淋巴细胞的免疫应答及凋亡,但其确切调控机制仍不明确[7,14]。
研究证实,SESNs可通过抑制哺乳动物西罗莫司靶蛋白(mammalian target of rapamycin, mTOR)蛋白激酶活性、抑制ROS积聚,保护机体免受多种应激损伤,对细胞生长及存活具有保护性作用[15]。SESN2是SESNs蛋白家族的重要成员,作为p53蛋白的底物,与细胞凋亡密切相关。在心血管疾病模型小鼠的巨噬细胞中,上调SESN2的表达可有效减轻ox-LDL诱导的细胞凋亡,提示SESN2对于脂质相关性心血管疾病具有保护作用[16]。另有资料显示,在LPS诱导的小鼠脓毒症模型中,SESN2表达水平较正常对照显著上调,而SESN2–/–缺陷小鼠表现为线粒体自噬缺失,最终造成过度炎症反应及死亡率增加[17]。上述研究表明SESN2在炎症性疾病中具有重要作用。本研究进一步探讨了SESN2在HMGB1诱导的DC凋亡中的作用及调节机制,旨在为深刻揭示其免疫学效应和干预途径奠定理论基础。
本实验结果显示,较高剂量HMGB1刺激可诱导DC2.4发生明显凋亡,其中100ng/ml HMGB1刺激48h最为显著,与本课题组前期研究结果一致[18]。SESN2在正常DC2.4中存在表达,HMGB1刺激后其表达明显上调,尤以10、100ng/ml HMGB1作用48h组最为明显;激光共聚焦激光显微镜观察显示,SESN2主要表达于胞质及核周,100ng/ml HMGB1刺激48h后,SESN2表达明显增强,可能与DC在HMGB1刺激下发生成熟异常、功能受损及凋亡有关。本组资料提示,HMGB1对DC2.4细胞凋亡的影响以100ng/ml刺激48h最为明显,因此重点分析了转染SESN2 LV-RNA和siRNA后经100ng/ml HMGB1刺激48h DC2.4细胞凋亡的改变。采用慢病毒转染技术进行观察发现,与空载体组比较,siRNA转染可有效沉默SESN2基因,下调SESN2蛋白的表达,加剧HMGB1诱导的DC2.4细胞凋亡,凋亡相关蛋白cleaved-caspase-3活性明显增强,抗凋亡蛋白Bcl-2表达明显下降;而转染SESN2 LV-RNA可显著上调SESN2蛋白的表达,减轻HMGB1诱导的DC2.4细胞凋亡,凋亡相关蛋白cleaved-caspase-3活性明显下降,抗凋亡蛋白Bcl-2表达明显增加。上述结果提示SESN2对HMGB1诱导的DC2.4细胞凋亡具有明显的保护作用[19]。

图5 干预SESN2基因表达水平对HMGB1诱导的DC2.4细胞凋亡的影响(n=4)Fig. 5 Effect of regulating the gene expression of SESN2 on DC2.4 apoptosis induced by HMGB1 (n=4)
综上所述,本研究结果表明,HMGB1刺激后DC2.4细胞凋亡率和SESN2蛋白表达水平均明显上调,沉默SESN2基因后HMGB1诱导的DC2.4细胞凋亡明显增加,而上调SESN2基因表达对HMGB1诱导的DC2.4细胞凋亡具有保护效应,但其确切信号通路和关键调节环节仍有待深入探讨。进一步深入认识脓毒症状态下SESN2对免疫细胞凋亡的影响与作用,将为脓毒症的免疫调理提供新的思路。
【参考文献】
[1]Singer M, Deutschman CS, Seymour CW,et al. The third international consensus definitions for sepsis and septic shock(sepsis-3)[J]. JAMA, 2016, 315(8)∶ 801-810.
[2]Stevenson EK, Rubenstein AR, Radin GT,et al. Two decades of mortality trends among patients with severe sepsis∶ a comparative meta-analysis[J]. Crit Care Med, 2014, 42(3)∶ 625-631.
[3]Liu V, Escobar GJ, Greene JD,et al. Hospital deaths in patients with sepsis from 2 independent cohorts[J]. JAMA, 2014,312(1)∶ 90-92.
[4]Luan YY, Yao YM, Xiao XZ,et al. Insights into the apoptoticdeath of immune cells in sepsis[J]. J Interf Cytok Res, 2015,35(1)∶ 17-22.
[5]Gautier EL, Huby T, Saint-Charles F,et al. Enhanced dendritic cell survival attenuates lipopolysaccharide-induced immunosuppression and increases resistance to lethal endotoxic shock[J]. J Immunol, 2008, 180(10)∶ 6941-6946.
[6]Wang H, Bloom O, Zhang M,et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science, 1999, 285(5425)∶ 248-251.
[7]Zhu XM, Yao YM, Liang HP,et al. The effect of high mobility group box-1 protein on splenic dendritic cell maturation in rats[J]. J Interf Cytok Res, 2009, 29(10)∶ 677-686.
[8]Lee JH, Budanov AV, Park EJ,et al. Sestrin as a feedback inhibitor of TOR that prevents age-related pathologies[J]. Science, 2010,327(5970)∶ 1223-1228.
[9]Budanov AV, Lee JH, Karin M. Stress in Sestrins take an aging fight[J]. EMBO Mol Med, 2010, 2(10)∶ 388-400.
[10] Yao YM, Zhang YM. Updated insights into the pathogenesis of sepsis[J]. J Med Postgra, 2017, 30(7)∶ 678-683. [姚咏明, 张艳敏. 脓毒症发病机制最新认识[J]. 医学研究生学报, 2017,30(7)∶ 678-683.]
[11] Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression∶ from cellular dysfunctions to immunotherapy[J]. Nat Rev Immunol, 2013, 13(12)∶ 862-874.
[12] Pearce EJ, Everts B. Dendritic cell metabolism[J]. Nat Rev Immunol, 2015, 15(1)∶ 18-29.
[13] Kang R, Chen R, Zhang Q,et al. HMGB1 in health and disease[J]. Mol Aspects Med, 2014, 40(1)∶ 1-116.
[14] Liu QY, Yao YM, Yan YH,et al. High mobility group box 1 protein suppresses T cell-mediated immunityviaCD11clowCD45RBhighdendritic cell differentiation[J]. Cytokine, 2011,54(2)∶ 205-211.
[15] Ben-Sahra I, Dirat B, Laurent K,et al. Sestrin2 integrates Akt and mTOR signaling to protect cells against energetic stress-induced death[J]. Cell Death Differ, 2013, 20(4)∶ 611-619.
[16] Hu HJ, Shi ZY, Lin XL,et al. Upregulation of Sestrin2 expression protects against macrophage apoptosis induced by oxidized lowdensity lipoprotein[J]. DNA Cell Biol, 2015, 34(4)∶ 296-302.
[17] Kim MJ, Bae SH, Ryu JC,et al. SESN2/sestrin2 suppresses sepsis by inducing mitophagy and inhibiting NLRP3 activation in macrophages[J]. Autophagy, 2016, 12(8)∶ 1272-1291.
[18] Wang YT, Dong N, Chai YF,et al. Regulatory effect of microRNA-449b on high mobility group box-1-mediated immune function of dendritic cells[J]. Infect Inflamm Rep,2015, 16(4)∶ 205-212. [王勇涛, 董宁, 柴艳芬, 等. microRNA-449b对高迁移率族蛋白B1介导树突状细胞功能的影响[J].感染、炎症、修复, 2015, 16(4)∶ 205-212.]
[19] Yang JH, Kim KM, Kim MG,et al. Role of sestrin2 in the regulation of proinflammatory signaling in macrophages[J]. Free Radic Biol Med, 2015, 78(2)∶ 156-167.
