水溶性磁性Fe3O4纳米粒子对小麦生长影响的研究
2018-03-22陈凌云杨胜韬
陈凌云,罗 阳,杨胜韬,左 芳
(西南民族大学化学与环境保护工程学院,四川 成都 610041)
由于纳米磁性颗粒-四氧化三铁(Fe3O4)具有超顺磁性的特征,在生物和医学可作为磁性载体材料使用,如生物分离技术[1]、含磁性的药物载体[2]、肿瘤治疗[3]和核磁共振成像技术(MRI)[4]等多个医用研究都有应用价值.纳米Fe3O4颗粒的合成方法普遍采用共沉淀法[5-6]和高温热解法[7].目前普遍采用油酸来做分散剂实现纳米粒子形貌的控制[8-10].然而,油酸做包裹剂又限制了Fe3O4纳米颗粒在生物医学行业中的应用.只有将油溶性的Fe3O4纳米颗粒进行改良才能更好的应用到生物医学中去.SiO2[7-8]和高分子包覆法[9-10]、配体氧化法[11]、配体交换法[6,12-17]都是对Fe3O4纳米颗粒改良的经典方法.其中在制备水溶性Fe3O4纳米颗粒时,配体交换法是比较常用方法,制得的改良纳米颗粒形貌完整均一、单分散性好.本实验研究的纳米粒子合成方法:第一步合成聚乙二醇(PEG)磷酸酯亲水性配体及油酸包覆的油溶性Fe3O4纳米颗粒;第二步在甲苯/四氢呋喃/水三元混合溶剂体系下实现了快速配体交换,最终实现油酸包覆的油溶性磁性Fe3O4纳米颗粒转变成聚乙二醇磷酸酯包覆的水溶性Fe3O4纳米颗粒.
人工合成纳米粒子后,该材料由于具有纳米材料的特殊性质,易流失到环境中,能与生物体细胞结合并渗入细胞内,潜在的生物安全性不容忽视[18-19].在近十几年的研究当中,Science、Nature和Environmental Science&Technology等著名杂志接连发表多篇纳米材料相关的生物生态安全性探究[20-22].在碳纳米材料(CNMs)[23]、金属纳米材料(MNMs)[24]金属氧化物纳米材料(MONMs)[25]等纳米材料对生物体内和体外毒性探究中,发现纳米材料会附着和进入生物体内[26],进而在体内积累和生物转移[27],并诱发过多ROS造成氧化损伤[28],还有进一步在分子和基因表达水平上都受到影响[29].磁性(Fe3O4)纳米粒子也很可能通过植物根部组织和叶表面组织吸收进入生物体内,这些进入的磁性(Fe3O4)纳米粒子很可能会储存在植物体内积累,进而发生生物转移至种子,倘若再进入食物链,最终很可能对食物链的最高端的人类造成影响[30].
本文探究聚乙二醇磷酸酯包覆的水溶性Fe3O4纳米粒子对小麦植物的生长影响.小麦植株是美国环境保护署指定的生态毒理性测试生物模型.通过对小麦植物水培育15天后,对其根茎叶形态、生物质含量、叶绿素含量和根部组织切片测量和观察,探究该材料的生物毒性.
1 实验部分
1.1 试剂原料
聚乙二醇单甲醚(mPEG、Mn=1 000),阿拉丁试剂(上海)有限公司;三氯氧磷(POCl3),分析纯(AR),成都金山化学试剂有限公司;无水乙醇、乙醚、四氢呋喃(THF),均为分析纯(AR),成都科龙试剂有限公司;油酸(OA,质量分数98%),分析纯(AR),天津市致远化学试剂厂;硝酸镱(Yb(NO3)3·5H2O),硝酸钇(Y(NO3)3·6H2O),硝酸铒(Er(NO3)3·5H2O),均为分析纯(AR),成都贝斯特试剂有限公司;氯化锰(MnCl2·4H2O),分析纯(AR),成都市科龙化工试剂厂;氢氧化钠(NaOH),分析纯(AR),天津市北方天医化学试剂厂;氟化钠(NaF),分析纯(AR),成都市科龙化工试剂厂;实验用水为二次蒸馏水;小麦种子(轮选987)购买于北京中农百禾科技有限公司;植物智能恒温光照培养箱购买于宁波赛福仪器有限公司.
采用改良的霍格兰营养液栽培植物.改良的霍格兰营养液配方是 Ca(NO3)2·4H2O(945 mg/L),KNO3·4H2O(506 mg/L),NH4NO3(80 mg/L),KH2PO4(136 mg/L),MgSO4(493 mg/L),补充微量元素FeSO4·7H2O(13.9 mg/L),EDTA·2Na(18.65 mg/L), KI(0.83 mg/L), H3BO3(6.2 mg/L),MnSO4(22.3 mg/L), ZnSO4·7H2O(8.6 mg/L), Na2MoO4·2H2O(0.25 mg/L), CuSO4·5H2O(0.025 mg/L),CoCl2·6H2O(0.025 mg/L).
1.2 合成方法
1.2.1 合成聚乙二醇磷酸酯
聚乙二醇磷酸酯的合成方法根据文献[18]进行合成,实验步骤:首先将15 g(18.5 mmol)聚乙二醇单甲醚于70℃的真空环境下进行干燥24 h后,再溶解到60 mL四氢呋喃(使用前经行干燥处理).然后,以三口烧瓶为反应容器,将18.5 mmol三氯氧磷溶于10 mL THF(使用前经行干燥处理),在冰浴环境下将聚乙二醇单甲醚THF溶液慢慢地滴入三氯氧磷的THF溶液中.接着,室温反应6 h.随后,冰浴条件下缓慢滴加5 mL冰水,再反应1 h.最后,反应溶液用氯仿萃取,再将氯仿溶液经行干燥(加入无水硫酸镁)和旋蒸除去溶剂,70℃下真空干燥24 h即可得到聚乙二醇磷酸酯.
1.2.2 配体交换实验反应
根据以前的工作[6]制备了油溶性的油酸包覆磁性纳米粒子.先将纳米粒子分散于浓度为10 mg/mL甲苯中,再经行配体交换反应.第一步,取0.2 g聚乙二醇磷酸酯溶于10 mL THF中,并与10 mL油酸包覆的Fe3O4纳米粒子甲苯溶液混合搅拌反应2 min.第二步,将10 mL的去离子水滴加到反应溶液体系中,继续反应10 min后,进行分液处理,取下层溶液减压浓缩并除去四氢呋喃.第四步,将制得的浓缩液加入10 mL乙醇,并进行磁分离和真空干燥,即可得到水溶性磁性Fe3O4纳米粒子粉末.
1.2.3 材料性能测试
使用TECNAI-F20透射电子显微镜对上转换纳米粒子的形貌进行分析.采用MALVERN ZETASIZER NANO ZS90动态光散射(DLS)对上转换纳米粒子进行粒径测试.
1.3 生物毒性测试
1.3.1 小麦植株培养
选取大小均一、体积饱满的小麦种子若干,放置在直径9 cm的玻璃培养皿中,加入5 mL的蒸馏水放置于植物智能培养箱(温度20℃、湿度60%、光强0 LX)中萌发3天.配制含水溶性磁性Fe3O4纳米粒子的植物培养液浓度分别为0 mg/mL、0.72 mg/mL、1.44 mg/mL,3.6 mg/mL.将已经发芽的小麦种子(根长3~5 cm,芽长1~3cm)放在含有不同材料浓度营养液的100 mL烧杯上,连续在植物智能培养箱(昼/夜,12 h/12 h,温度25℃ /20℃,光强18000/0 LX,湿度60%)中培养15天,每天补充适量的营养液.
1.3.2 小麦生长特性测试
水培15天后,对小麦植株的根茎叶形态、生物含量、叶绿素含量、根部组织切片进行测量.长度单位数据采用30 cm直尺测量,重量单位采用分析电子天平(C-10d型,赛多利斯实验仪器有限公司)测量,叶绿素采用叶绿素仪(SPAD-502;KonicaMinolta,日本)测量,组织切片寄送武汉谷歌生物公司做石蜡切片.
2 结果与讨论
2.1 材料表征结果
磁性Fe3O4纳米粒子的TEM照片如图1所示.图1.a为油溶性磁性Fe3O4纳米粒子的透射电镜图,图中可以看出油溶性磁性Fe3O4纳米粒子具有较好的分散性,从图1.c粒径分布图可以看出其粒径约为16.8 nm.图1.b为水溶性磁性Fe3O4纳米粒子的透射电镜图,从图中可以看出水溶性磁性Fe3O4纳米粒子形貌没有改变且具有较好的分散性,从图1.d粒径分布图可以看出其粒径约为23.4 nm.
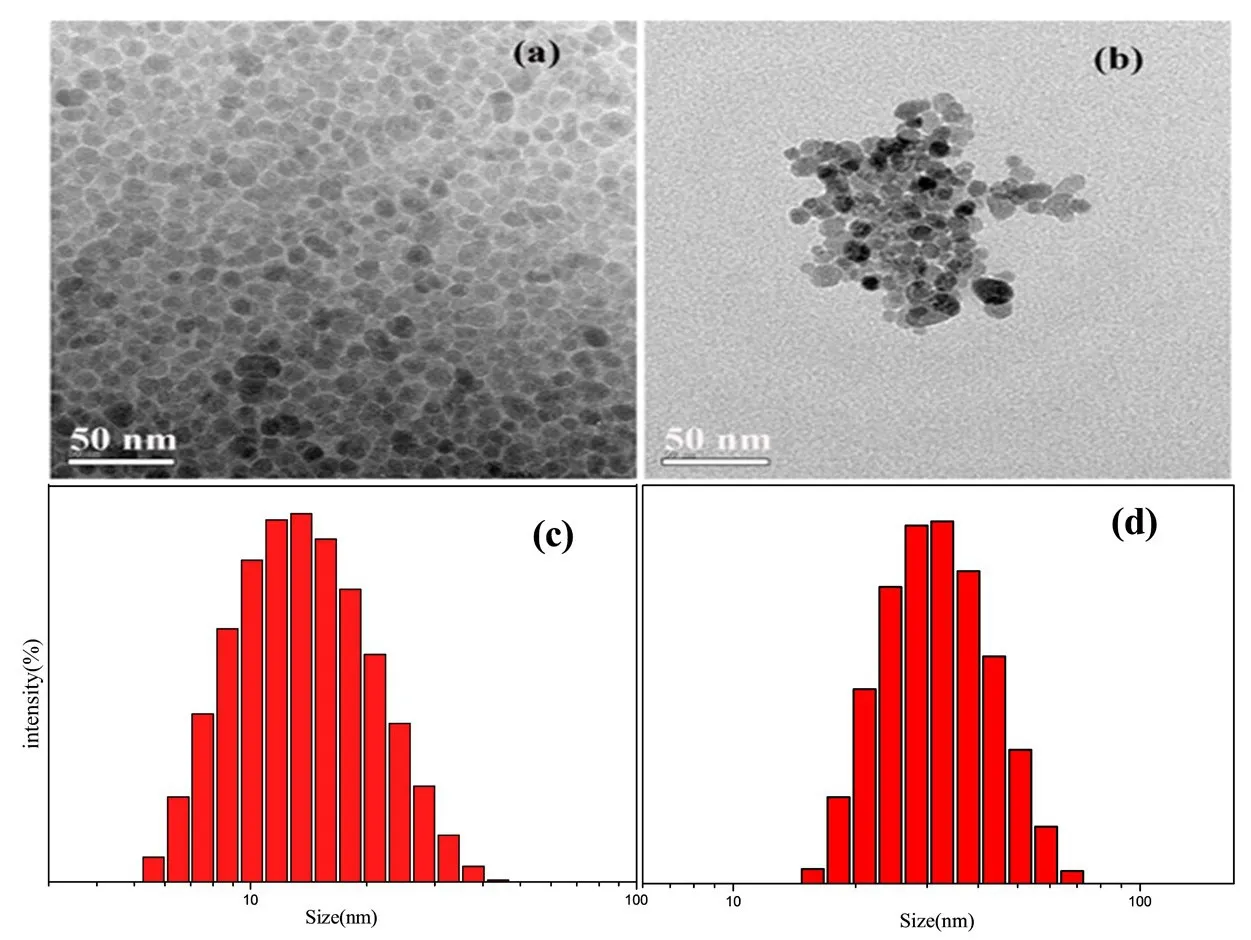
图1 磁性Fe3O4纳米粒子配体交换前后的透射电镜图和粒径分布图Fig.1 TEM images and diamater distribution chart of magnetic Fe3O4nanoparticles before and after ligand exchange
2.2 生物毒性测试结果
2.2.1 植物体外貌特征
有关纳米材料的生物效应已经有不少研究者做过探究,所得出结论也不尽相同.有的认为对生物体是有促进作用,有的认为是有抑制效应的,以及有得出无明显影响.一般认为纳米材料的生物效应与材料本身[31](如大小、表面修饰基团)、剂量[32]、分散剂[33]、培养方式[34]以及物种[35]等都有很大的关系.大多数纳米材料在做植物生物毒性探究时,都发现低促高抑的现象,这与一些物质所表现出来的两重性是相似的.一般材料的生物毒性可能都会遵循这个规律,在极其低的浓度下表现出无明显变化;在某低浓度下一定的促进效应,达到一定高浓度后就表现出抑制效应.如zhao等发现氧化石墨烯在浓度0-1 000 μg/L下,对拟南芥的生长无明显影响[36].Begum等在做水溶性石墨烯(0~80 mg/mL)对拟南芥细胞悬浮液的应激实验中,发现ROS升高细胞出现死亡[37].可以看出纳米材料的剂量不同,所表现出来的生物效应也是有很大差异的.因此,在探究材料的生物毒性时,浓度设计在低和高部分都要有分布,如偏低极有可能变现不出生物差异性造成误判.根据国际研究者普遍认为2~5 mg/mL的浓度为高浓度,本文设定了低中高浓度分别0.72 mg/mL、1.44 mg/mL、3.6 mg/mL,全面探究水溶性Fe3O4磁材料对小麦植株的生物效应.从图2可以看出:小麦植物在培养15天后,低浓度时,植株外貌特征生长无明显差异;随着浓度增加,抑制效应越来越显著.由此可以得出水溶性Fe3O4磁材料在高浓度下对小麦是有生物毒性的.
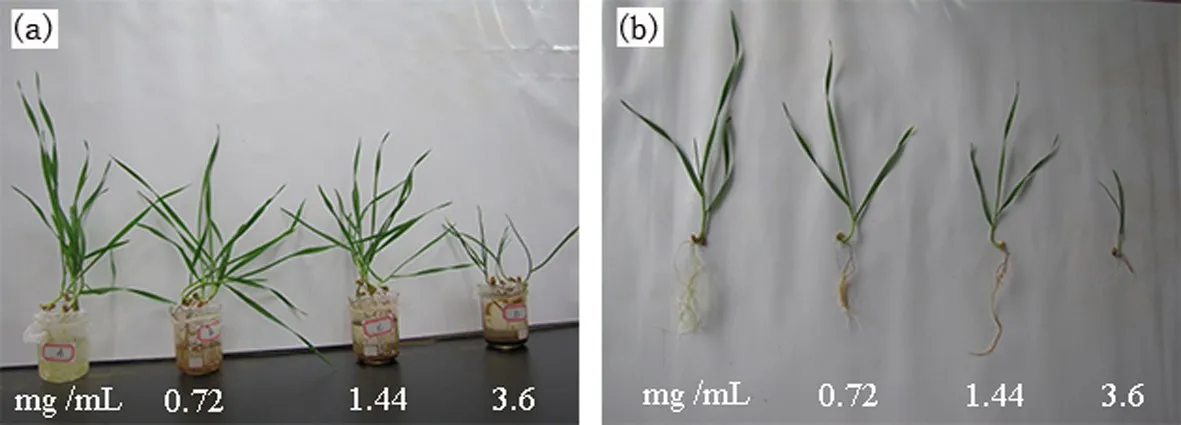
图2 小麦植株培育15天后的外貌特征图a-整体;b-单株Fig.2 The appearance map of wheat plants after 15 daysa-whole;b-single
2.2.2 植物植株根茎叶形态
植物的根茎叶形态是直接反映其生长状况的测量指标,大多数植物毒性测试也是测量这些指标.如Ma等在做CeO2、La2O3纳米材料生物毒性评估时,发现CeO2纳米材料对黄瓜的根茎叶形态无影响,而La2O3纳米材料明显抑制了黄瓜根茎的伸长[38].Kim等发现暴露在溶液中铁纳米粒子能触发拟南芥根细胞壁变松弛,使促进根伸长[39].从根数数据图(图3.a)中可以看出水溶性Fe3O4磁材料对小麦根组织根数的生长无明显影响(P>0.05).由此可以得出水溶性Fe3O4磁材料对小麦的根数生长特征的生物效应不是很明显;从根长的数据图(图3.b)中,可以看出低浓度(0.72 mg/mL,1.44 mg/mL)下的根长(11.02 cm,8.64 cm)与空白组(12.38 cm)无显著性差异(P>0.05).高浓度(3.6 mg/mL)的根长(3.1cm)与空白组(12.38 cm)相比明显受抑制(P<0.05).此数据可以得出低浓度的水溶性Fe3O4磁材料(1.44 mg/mL以下)对小麦的根长生长是无明显生物毒性.高浓度(3.6 mg/mL以上)水溶性Fe3O4磁材料对小麦这种生长特征是有明显的生物毒性;从叶数数据图(图3.c)中,可以看出低浓度(0.72 mg/mL)下的叶数(4)与空白组(4)无显著性差异(P>0.05).高浓度(1.44 mg/mL,3.6 mg/mL)的叶数(3,2)与空白组(4)相比明显受抑制(P<0.05).此数据可以得出低浓度的水溶性Fe3O4磁材料(0.72 mg/mL以下)对小麦叶数的生长是无明显生物毒性,而高浓度(1.44 mg/mL以上)水溶性Fe3O4磁材料有明显的生物毒性;从茎叶长的数据图(图3.d)中,可以看出低浓度(0.72 mg/mL ,1.44 mg/mL)下的茎叶长(17.96 cm,15.16 cm)与空白组(18.44 cm)无显著性差异(P>0.05).高浓度(3.6 mg/mL)的茎叶长(4.16 cm)与空白组(18.44 cm)相比明显受抑制(P<0.05).此数据可以得出水溶性Fe3O4磁材料(1.44 mg/mL以下)对小麦茎叶组织的茎叶长生长是无明显生物毒性,高浓度(3.6 mg/mL以上)水溶性Fe3O4磁材料对小麦这种生长特征是有明显的生物毒性;从苗高的数据图(图3.e)中,可以看出低浓度(0.72 mg/mL)下的苗高(28.98 cm)与空白组(30.82 cm)无显著性差异(P>0.05).高浓度(1.44 mg/mL,3.6 mg/mL)的苗高(23.8 cm,7.26 cm)与空白组(30.82 cm)相比明显受抑制(P<0.05).此数据可以得出低浓度的水溶性Fe3O4磁材料(1.01 mg/mL以下)对小麦苗高生长是无明显生物毒性.高浓度(1.44 mg/mL以上)水溶性Fe3O4磁材料对这一生长特征是有明显的生物毒性,且随着浓度增加毒性随之增大;从根冠比数据图(图3.f)中可以看出水溶性Fe3O4磁材料对小麦根冠比的生长无明显影响(P>0.05).由此可以得出水溶性Fe3O4磁材料对小麦的根冠比生长特征的生物效应不是很明显.高浓度(3.6 mg/mL)的根冠比出现比空白组大的反常现象,可能是前期萌发阶段小麦根的生长速率比茎叶组织部分要快,萌发3天的小麦放在高浓度下的材料培养根部组织受到损伤,出现凋零萎蔫,导致根组织营养吸收受阻,进而茎叶组织生长严重受阻,茎叶组织的长度急剧减少直接造成根冠比反而升高.
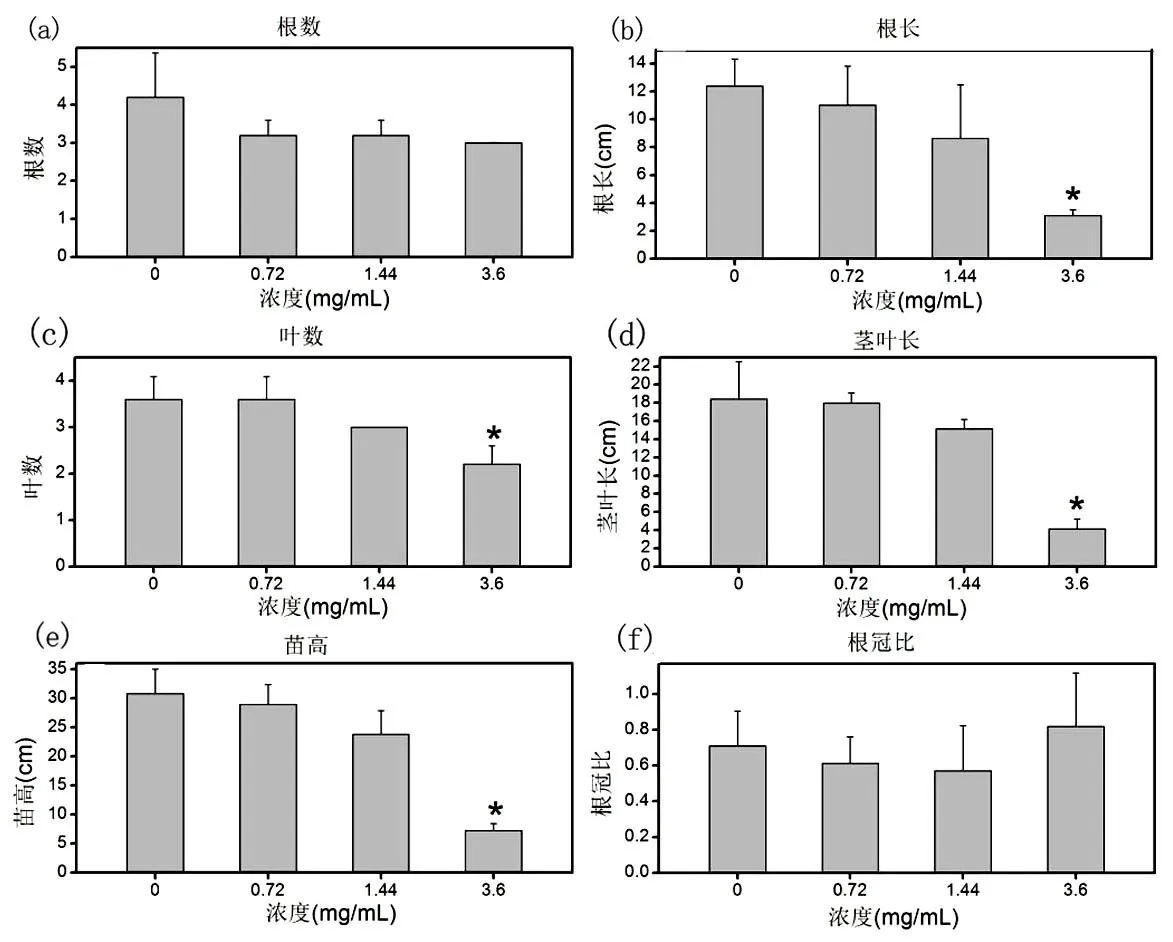
图3 小麦植物培育15天后根茎叶形态数据图a-根数;b-根长;c-叶数;d-茎叶长;e-苗高;f-根冠比Fig.3 The plant rhizome leaf morphology data of wheat after 15 daysa-root number;b-root length;c-leaf number;d-stem leaf length;e-seedling length;f-root/shoot length ratio
2.2.3 植物植株生物含量
植物的生物质含量是最直接展示其生长状况的测定参数,是植物净光合作用所固定下来的物质含量.生物质含量较高,自然反映出植物的生长状况就好.因此,这也是测定植物生物毒性的重要参数.如Larue等在定量评价多壁碳纳米管对小麦和油菜的生物毒性,植株的生物量作为一个重要指标[40].从鲜重的数据图(图4.a)中,可以看出低浓度(0.72 mg/mL,1.44 mg/mL)下的鲜重(0.4368 g,0.31192 g)与空白组(0.4961 g)无显著性差异(P>0.05).高浓度(3.6 mg/mL)的鲜重(0.1270 g)与空白组鲜重(0.4961 g)相比明显受抑制(P<0.05).此数据可以得出低浓度的水溶性Fe3O4磁材料(1.44 mg/mL以下)对小麦植株的鲜重是无明显生物毒性.高浓度(3.6 mg/mL以上)水溶性Fe3O4磁材料对这一生长特征是有明显的生物毒性;从干重的数据图(图4.b)中,可以看出低浓度(0.72 mg/mL,1.44 mg/mL)下的干重(0.0731 g,0.0549 g)与空白组(0.07382 g)无显著性差异(P>0.05).高浓度(3.6 mg/mL)的干重(0.0362 g)与空白组(0.0738 g)相比明显受抑制(P<0.05).此数据可以得出低浓度的水溶性Fe3O4磁材料(1.44 mg/mL以下)对小麦植物的干重是无明显生物毒性.高浓度(3.6 mg/mL以上)水溶性Fe3O4磁材料对这一生长特征是有明显的生物毒性;从干湿比数据图(图4.c)中可以看出水溶性Fe3O4磁材料对小麦根冠比的生长无明显影响(P>0.05).由此可以得出水溶性Fe3O4磁材料对小麦的根冠比生长特征的生物效应不是很明显.然而,高浓度(3.6 mg/mL)的干湿比出现比空白组大的反常现象,主要是由于该浓度下的植物组织已经发生枯萎,植物生物质的含水量本身就很低,干湿比自然就略有变大的趋势,进而导致干湿比有所增加的现象,其生长状况并没有改善.
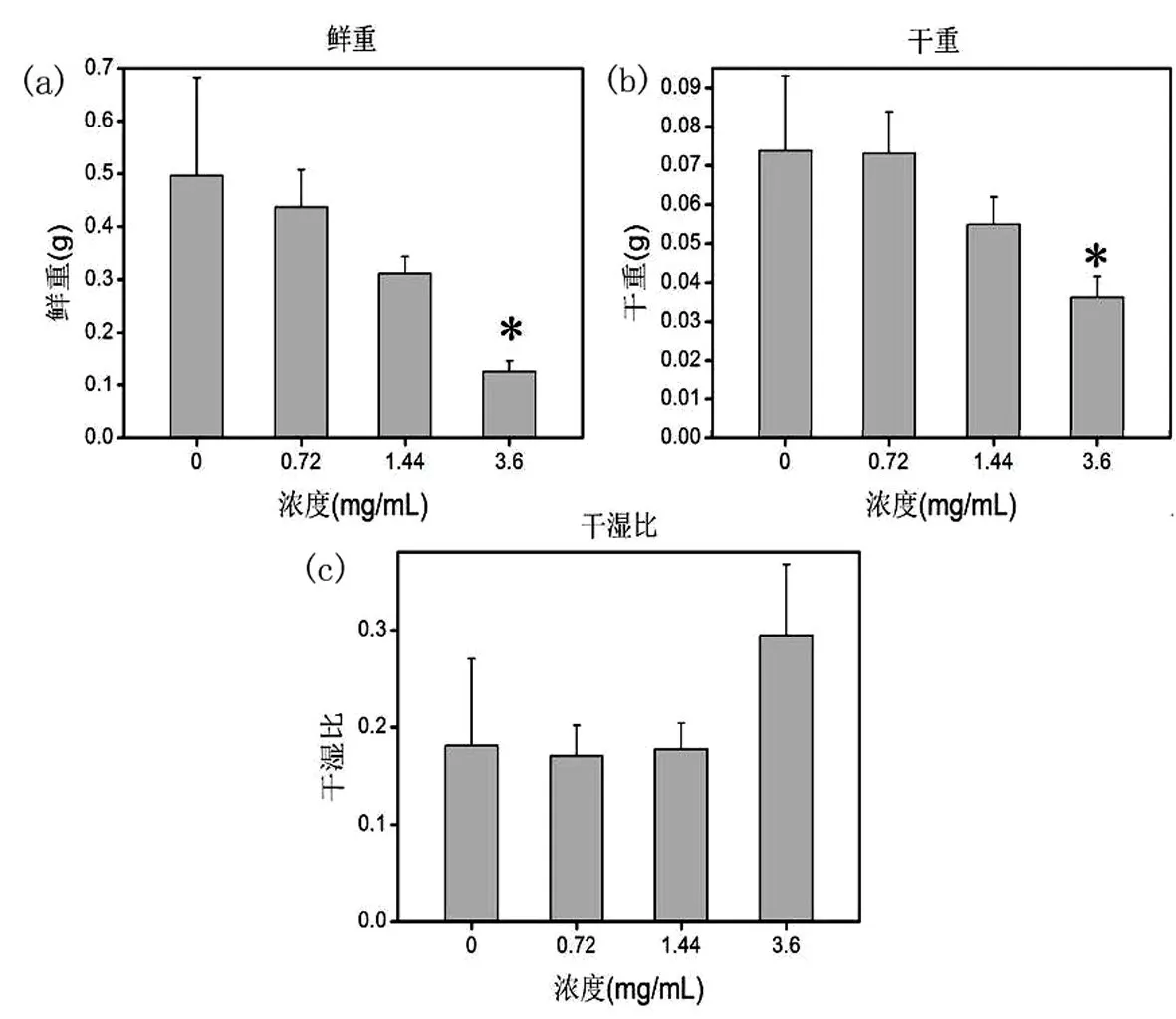
图4 小麦植物培育15天后生物质含量测定图a-鲜重;b-干重;c-干湿比Fig.4 The biomass content determination of wheat plants of wheat after 15 daysa-fresh weight;b-dry weight;c-dry/wet ratio
2.2.4 叶片组织叶绿素含量
叶绿素是一类与植物光合作用有关的最重要的色素,是植物生长状态评估的重要参数.如Ghafariyan等在探究磁性Fe3O4纳米材料对大豆植物的影响,发现能提高叶片叶绿素含量[41].从叶绿素的数据柱状图中,可以看出水溶性Fe3O4磁材料对小麦叶组织叶绿素的生长无明显影响(P>0.05).由此可以得出水溶性Fe3O4磁材料对小麦的叶绿素生长特征的生物效应不是很明显.但是,低浓度(0.72 mg/mL,1.44 mg/mL)实验组的叶绿素含量是有增加的趋势,出现这样的情况可能是由于一定浓度下的水溶性Fe3O4磁材料能水解一部分铁离子在培养液中,增加一定量的铁粒子浓度对小麦的叶片生长是有利的.如Wang等在研究磁铁矿Fe3O4纳米颗粒对多年生黑麦草也有类似的结果[44].
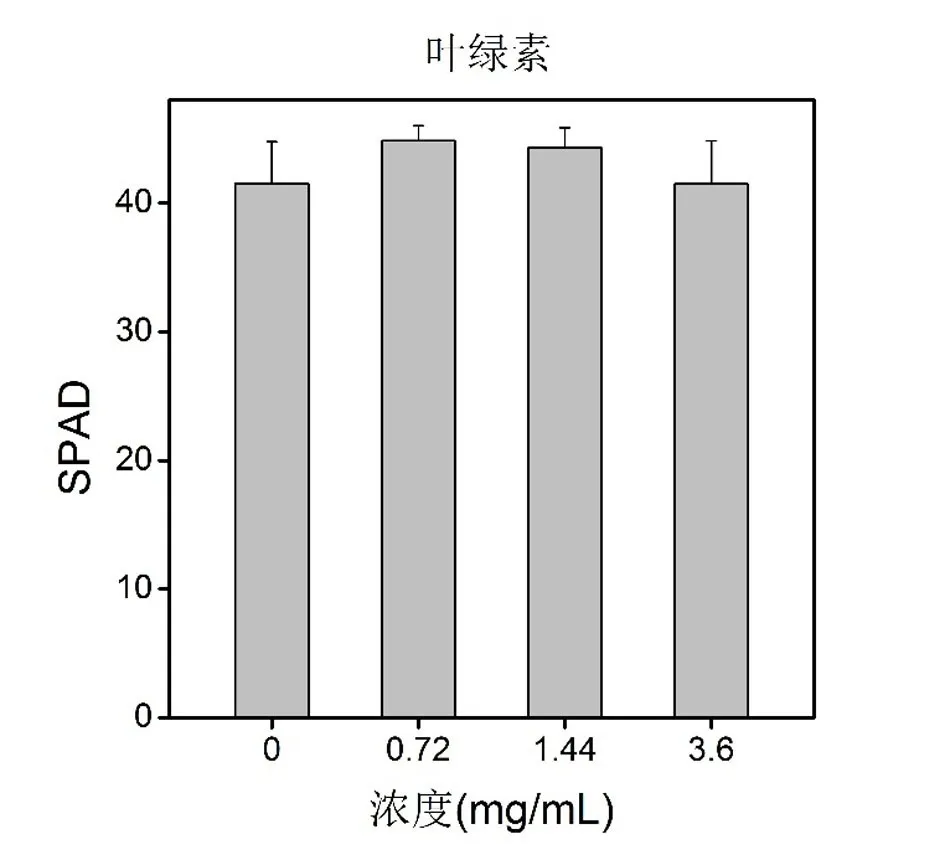
图5 小麦植物培育15天后叶片叶绿素含量图Fig.5 The leaf chlorophyll content of wheat after 15 days
2.2.4 根部组织切片
组织切片是直观观察生物细胞生长状态的一种重要手段,主要有做石蜡切片、透射电镜、扫描电镜等技术手段.通过这些表征技术能更好的观察组织细胞的大小形态,组织结构分析以及毒性机理等方面的研究.如Hu等在研究氧化石墨烯和植物之间的相互影响时,透射电镜和扫描电镜观察到藻细胞明显发生质壁分离分离和叶绿体结构遭到破坏[42].Kubo-Irie等在探究TiO2纳米粒子在食物链的传递过程,用石蜡切片和透色电镜观察到植物的维管组织有小团聚的TiO2纳米粒子[43].从图6我们可以观察到小麦的根组织石蜡切片在光学显微镜下,组织结构已经发生改变.如0.72 mg/mL组(图6.c和d)小麦根组织与空白组(图6.a和b)相比根部的皮层组织出现损伤和变形,细胞孔隙度明显增加,出现类似水稻根组织的通气组织,可能是产生过多ROS造成的.但整个根组织的形态大小基本没变,说明根组织结构并没有发生塌陷,植物根没有出现萎缩的现象.然而,1.44 mg/mL组(图6.e和f)根组织的表皮组织包裹一层类似磁性纳米材料物质;3.6 mg/mL组(图6.g和h)根组织形态大小严重变形和损伤,组织结构发生塌陷,导致根组织萎缩和死亡.由此得出,高浓度下的水溶性Fe3O4磁纳米材料已经严重影响小麦的根组织形态和新陈代谢,表现出较强的生物毒性.
在对该材料的生物毒性测试的实验中,从植物体外貌特征、根茎叶形态、生物质含量、叶绿素含量、组织切片五个方面的分析,我们得出水溶性Fe3O4磁纳米材料是具有生物毒性的,而且在高浓度的条件下,表现得很显著.出现这种情况,可能是改性后的水溶性Fe3O4磁纳米材料在溶液中分散性更加好了,容易与根组织细胞接触并吸附在表面,进而进入细胞体内对植物组织细胞造成损伤.如Wang等在研究磁铁矿Fe3O4纳米颗粒对多年生黑麦草和南瓜植物的生理效应,发现磁铁矿Fe3O4纳米粒子(包裹0.2%表面活性剂聚乙烯吡咯烷酮(PVP))能促进黑麦草和南瓜植物的根伸长,他们推测是由于磁铁矿纳米颗粒增加了溶解铁离子浓度[44].我除了此原因还有就是其浓度(0~500 mg/L)不够高和包裹的PVP有关.再如Ghafariyan等发现Fe3O4纳米粒子(悬浮液)在浓度(0~2 mg/mL)下对大豆的相对根伸长率有抑制作用,且表面性中型的Fe3O4纳米粒子(悬浮液)都比带正电荷和负电荷的抑制效果更强[41].这充分说明对同一种纳米材料进行表面修饰其生物效应都能发生改变,这应当对目前各种纳米材料进行修饰的研究者引起高度重视.
3 结论
本文合成聚乙二醇磷酸酯和油酸包覆的磁性Fe3O4纳米粒子,再采用配体交换法制备出了水溶性磁性Fe3O4纳米粒子,并研究了不同浓度的水溶性磁性Fe3O4纳米粒子对小麦生长的影响.结果表明,随着浓度的增加,水溶性磁性Fe3O4纳米粒子对小麦生长的抑制越明显.在低浓度下,小麦植物的根茎叶形态、生物质量以及叶绿素与空白组都无显著性差异;在高浓度下,小麦植物的各项生理指标都表现出下降和抑制.通过做根部组织切片,发现低浓度下的小麦根组织的皮层细胞已经出现异常,高浓度下的小麦根组织表皮细胞附着有纳米粒子物质,皮层细胞出现大量损伤和变形.水溶性磁性Fe3O4纳米粒子材料是具有一定生物毒性的,需对其环境生态风险进行系统评价,严格控制其环境排放.

图6 小麦植物培育15天后不同材料浓度下的根组织横切片(左200倍,右400倍)a/b-空白组;c/d-0.72 mg/mL;e/f-1.44 mg/mL;g/h-3.6 mg/mLFig.6 The root tissue slice under different concentration of Fe3O4after 15 days,the left 200X and the right 400Xa/b-control;c/d-0.72 mg/mL;e/f-1.44 mg/mL;g/h-3.6 mg/mL(A/B)
[1]LI Y,LIU Q,HONG Z,et al.Magnetic separation-assistant fluorescence resonance energy transfer inhibition for highly sensitive probing of nucleolin[J].Analytical Chemistry,2015,87(24):12183-12189.
[2]MHLANGA N,RAY S S,LEMMER Y,et al.Polylactide-based magnetic spheres as efficient carriers for anticancer drug delivery[J].Acs Applied Materials & Interfaces,2015,7(40):22692-22701.
[3]YIN P T,SHAH S,PASQUALE N J,et al.Stem cell-based gene therapy activated using magnetic hyperthermia to enhance the treatment of cancer[J].Biomaterials,2016,81:46-57.
[4]LIU Y,TIMOTHY C H,BENJAMIN W M,et al.Water dispersible magnetic carbon nanotubes as T2-weighted MRI contrast agents[J].Biomaterials,2014,35(1):378-386.
[5]陈玉磊,王伟,戴亚堂,等.聚乙烯亚胺功能化Fe3O4纳米粒子的制备[J].精细化工,2015,32(10):1098-1101.
[6]AN P,ZUO F,WU Y,et al.Fast synthesis of dopamine-coated Fe3O4nanoparticles through ligand-exchange method[J].Chinese Chemistry Letters,2012,23:1099-1102.
[7]TAN X,LU L,WANG L,et al.Facile synthesis of bimodal mesoporous Fe3O4@SiO2composite for efficient removal of methylene blue[J].European Journal of Inorganic Chemistry,2015,18:2928-2933.
[8]LI J,JIANG H,YU Z,et al.Multifunctional uniform core-shell Fe3O4@mSiO2mesoporous nanoparticles for bimodal imaging and photothermal therapy[J].Chemistry An Asian Journal,2013,8(2):385-91.
[9]KIM H,KIM E,JEONG S W,et al.Magnetic nanoparticle-conjugated polymeric micelles for combined hyperthermia and chemotherapy[J].Nanoscale,2015,7(39):16470-16480.
[10]YANG C,GUO W,CUI L,et al.pH-responsive magnetic core-shell nanocomposites for drug delivery[J].Langmuir,2014,30(32):9819-9827.
[11]LIU G,CAI M,WANG X,et al.Magnetite-loaded thermosensitive nanogels for bioinspired lubrication and multimodal friction control[J].Acs Macro Letters,2016,5(1):144-148.
[12]DAVIS K,QI B,WITMER M,et al.Quantitative measurement of ligand exchange on iron oxides via radiolabele oleic acid[J].Langmuir,2014,30(36),10918-10925.
[13]VO D Q,KIM E,KIM S.Surfacemodfication of hydrophobic nanocrystals using short-chain carboxylic acids[J].Journal of Colloid and Interface Science,2009,337:75-80.
[14]PALMA S,MARCIELLO M,CARVALHO A,et al.Effects of phase transfer ligands on monodisperse iron oxide magneticnanoparticle[J].Journal of Colloid and Interface Science,2015,437:147-155.
[15]BAE K H,KIM Y B,LEE Y,et al.Bioinspired synthesis and characterization of gadolinium-labeled magnetite nanoparticles for dual contrast T1-and T2-weighted magnetic resonance imaging[J].Bioconjugate Chemistry,2010,21:505-512.
[16]WANG L,ZHANG H,ZHOU Z,et al.Gd(III)complex conjugated ultra-small iron oxide as an enhanced T1-weighted MR imaging contrast agent[J].Journal of Materials Chemistry B,2015,3(7):1433-1438.
[17]XIE J,XU C,KOHLER N,et al.Controlled PEGylation of monodisperse Fe3O4nanoparticles for reduced non-specific uptake by macrophage cells[J].Advanced Materials,2007,19:3163-3166.
[18]SYBERG K,HANSEN S F.Environmental risk assessment of chemicals andnanomaterials—The best foundation for regulatory decisionmaking?[J].Science of the Total Environment,2016,541:784-794.
[19]KUNHIKRISHNAN A,SHON H K,BOLAN N S,et al.Sources,distribution,environmental fate, and ecological effects of nanomaterials in wastewater streams[J].Critical Reviews in Environmental Science&Technology,2015,45:227-318.
[20]NEL A,XIA T,MADLER L,et al.Toxic potential of materials at the nanolevel[J].Science,2006,311:622.
[21]COLVIN V L.The potential environmental impact of engineerednanomaterials[J].Nature Biotechnology,2004,22:760.
[22]MIRALLES P,CHURCH T L,HARRIS A T.Toxicity,uptake,and translocation of engineered nanomaterials in vascular plants[J].Environmental Science & Technology,2012,46:9224-9239.
[23]WANG C L,ZHANG H,RUAN L F,et al.Bioaccumulation of13C-fullerenol nanomaterials in wheat[J].Environmental Science Nano,2016,3:799-805.
[24]JUDY J D,UNRINE J M,RAO W,et al.Bioavailability of gold nanomaterials to plants:importance of particle size and surface coating[J].Environmental Science & Technology,2012,46:8467-8474.
[25]EBBS S D,BRADFIELD S J,KUMAR P,et al.Accumulation of zinc,copper,or cerium in carrot(daucus carota)exposed to metal oxide nanoparticles and metal ions[J].Environmental Science Nano,2016,3:114-126.
[26]HUSEN A,SIDDIQI K S.Carbon and fullerenenanomaterials in plant system[J].Journal of Nanobiotechnology,2014,12:1-10.
[27]YANG S T,GUO W,LIN Y,et al.Biodistribution of pristine singlewalled carbon nanotubes in vivo[J].Journal of Physical Chemistry C,2007,111:117761-17764.
[28]CHANG Y L,YANG S T,LIU J H,et al.In vitro toxicity evaluation of graphene oxide on A549 cells[J].Toxicology Letters,2011,200:201-210.
[29]AKEN B V.Gene expression changes in plants and microorganisms exposed tonanomaterials[J].Current Opinion in Biotechnology,2015,33:206-219.
[30]MAJUMDAR S,TRUJILLO-REYES J,HERNANDEZ-VIEZCAS J A,et al.Cerium biomagnification in a terrestrial food chain:influence of particle size and growth stage[J].Environmental Science&Technology,2015,50:810-828.
[31]MAJUMDAR S,TRUJILLO-REYES J,HERNANDEZ-VIEZCAS J A,et al.Charge,size,and cellular selectivity for multiwall carbon nanotubes by maize and soybean[J].Environmental Science& Technology,2015,49:7380-7390.
[32]LIU J H,YANG S T,WANG H F,et al.Effect of size and dose on the biodistribution of graphene oxide in mice[J].Nanomedicine,2012,7:1801-1812.
[33]WANG Z Y,LI J,ZHAO J,et al.Toxicity and internalization of CuO nanoparticles to prokaryotic alga microcystis aeruginosa as affected by dissolved organic matter[J].Environmental Science & Technology,2011,45:6032-6040.
[34]LEE W M,KWAK J,AN Y J.Effect of silver nanoparticles in crop plantsphaseolus radiatus and sorghum bicolor:media effect on phytotoxicity[J].Chemosphere,2012,86:491-499.
[35]BEGUM P,IKHTIARI R,FUGETSU B.Graphene phytotoxicity in the seedling stage of cabbage,tomato,red spinach,and lettuce[J].Carbon,2011,49:3907-3919.
[36]ZHAO S Q,WANG QQ,ZHAO Y L,et al.Toxicity and translocation of graphene oxide in arabidopsis thaliana[J].Environmental Toxicology&Pharmacology,2015,39:145-156.
[37]BEGUM P,FUGETSU B.Induction of cell death by graphene in arabidopsis thaliana(columbia ecotype)T87 cell suspensions[J].Journal of Hazardous Materials,2013,260:1032-1041.
[38]MA Y H,ZHANG P,ZHANG Z Y,et al.Origin of the different phytotoxicity and biotransformation of cerium and lanthanum oxide nanoparticles in cucumbe[J].Nanotoxicology,2015,9:262-270.
[39]KIM J H,LEE Y J,KIM E J,et al.Exposure of iron nanoparticles to arabidopsis thaliana enhances root elongation by triggering cell wall loosening[J].Environmental Science & Technology,2014,48:3477-3485.
[40]LARUE C,PINAULT M,CZARNY B,et al.Quantitative evaluation of multi-walled carbon nanotube uptake in wheat and rapeseed[J].Journal of Hazardous Materials,2012,227-228:155-163.
[41]GHAFARIYAN M H,MALAKOUTI M J,DADPOUR M R,et al.Effects of magnetite nanoparticles on soybean chlorophyll[J].Environmental Science & Technology,2013,47:10645-10652.
[42]HU X G,LU K C,MU L,et al.Interactions between graphene oxide and plant cells:regulation of cell morphology,uptake,organelle damage,oxidative effects and metabolic disorders[J].Carbon,2011,80:665-676.
[43]KUBO-IRIE M,YOKOYAMA M,SHINKAI Y,et al.The transfer of titanium dioxide nanoparticles from the host plant to butter fl y larvae through a food chain[J].Scientific Reports,2016,6:23819.
[44]WANG HH,KOU X M,PEI Z G,et al.Physiological effects of magnetite(Fe3O4)nanoparticles on perennial ryegrass(lolium perenne L.)and pumpkin(cucurbita mixta)plants[J].Nanotoxicology,2011,5:30-42.
