家兔源致病性维罗纳气单胞菌的分离鉴定及药敏试验
2018-03-22任永军
周 军,任永军,汤 承
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.四川省畜牧科学研究院动物遗传育种四川省重点实验室,四川 成都 610066)
维罗纳气单胞菌(Aeromonas veronii),属弧菌科气单胞菌属[1].其广泛分布于有水环境中[2],是畜禽肉品、水产品和蔬菜的重要污染源.该菌能感染人,引起腹泻[3]、菌血症[4]、脓毒症[5]、呼吸道感染[6]等,给人类健康造成威胁.报道显示,维罗纳气单胞菌可引起多种鱼类致病[7-15],给水产养殖业带来了巨大的损失;此外,2012年李伟杰等[16]从病死的狐狸病变肝脏组织中分离到该菌,并证明该菌有致病性.维罗纳气单胞菌致病菌株多为温和生物型[17-18].其作为一种较为新型的人-兽-鱼共患病原菌,备受关注,但未见引起家兔致病的报道.
2017年3月,四川某兔场家兔出现咳嗽、打喷嚏和流鼻液等呼吸道症状,该兔场基础母兔存栏量为2600只,发病率约为20%,从发病至样本采集的半个月时间里,家兔没有出现死亡.病兔剖检主要见肺脏有出血点和纤维性渗出物.为调查其病因,本试验无菌采集病兔肺脏进行细菌分离和鉴定,并对分离菌进行药敏试验,旨在为兔呼吸道疾病的防控提供依据.
1 材料与方法
1.1 临床样本、实验动物及质控菌株
随机取5只病兔和5只临床健康兔,送四川省高等学校重点实验室待检.实验动物为昆明系小鼠(20~22 g,雌性)购自成都达硕实验动物有限公司;药敏试验质控菌株为大肠杆菌ATCC25922,由本实验室保存.
1.2 培养基及试剂
胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)和全血琼脂平板均购自青岛高科园海博生物技术有限公司;细菌16S rDNA通用引物由生工生物工程(上海)股份有限公司合成;核酸提取、Taq酶等均购自大连TaKaRa公司;马血清购自郑州佰安生物工程有限公司;药敏纸片购自杭州微生物试剂有限公司.
1.3 病兔肺脏组织的细菌分离
对送检的10只家兔均用乙醚麻醉后放血处死,无菌采集10只家兔的肺脏划线接种于血琼脂平板上,37℃培养12~24 h;挑取形态一致的单菌落转接于含5%马血清TSA进行纯培养.观察分离菌在血琼脂平板上和TSA上的菌落特征,并进行革兰氏染色镜检,观察镜检形态.
1.4 分离菌的16S rDNA序列PCR扩增及测序鉴定
采用文献[19]报道的细菌16s rDNA的通用引物27F/1492R进行PCR扩增,PCR反应体系:PCR-MIX 12.5 μL,上、下游引物各 1 μL,ddH2O 8.5 μL,DNA模板 2 μL,共 25 μL.PCR 反应条件:95 ℃ 预变性5 min;95 ℃变性35 s,55 ℃退火60 s,72 ℃延伸60 s,共完成40个循环;最后72℃,延伸8 min后结束PCR扩增.将PCR扩增产物凝胶电泳检测,并送上海生工测序.
1.5 分离菌的16S rDNA序列进化分析
在NCBI上用BLAST将测序获得的维罗纳气单胞菌序列同GenBank数据库中收录的维罗纳气单胞菌序列进行同源性比对,并从GenBank中下载了17条不同国家或地区、不同宿主、不同时间的维罗纳气单胞菌序列,运用Mega6.0软件构建系统发育树.
1.6 分离菌对小鼠的致病性试验
将分离的4株维罗纳气单胞菌接种于TSB中,37℃、150 r/min空气浴振摇培养12 h,将4株菌培养物分别腹腔注射5只小鼠,注射剂量为0.2 mL/只,空白对照腹腔注射TSB,观察各分离菌对小鼠的致病性.
1.7 药敏试验
按照世界卫生组织(WHO)推荐的K-B纸片法对4株维罗纳气单胞菌进行药敏试验.用接种环挑取纯化的单菌落接种于TSB培养基中,37℃、150 r/min空气浴振摇培养12 h,将培养后的菌液稀释至终浓度为1.5×108CFU/mL,取1mL菌液均匀涂布于TSA平板上,待菌液吸收后贴上药敏纸片,37℃恒温培养12 h.按照NCCLS 2009年标准,以耐药、中敏、敏感判定药敏试验结果.
2 结果
2.1 细菌分离情况
从5只病兔肺脏中分离到4株细菌,在TSA平板和血琼脂平板上生长旺盛,均呈边缘整齐、光滑、中间隆起的灰白色菌落;在血琼脂平板上产生β溶血(见图1);革兰染色均为G-短杆菌,两端钝圆,且多呈单个排列(见图2).而外表健康家兔的肺脏中未分离到细菌.

图1 分离菌株菌落特征Fig.1 Thecolony characteristics of isolates

图2 分离菌株革兰氏染色镜检Fig.2 Gram stains ofisolates
2.2 分离菌16S rDNA PCR扩增结果及同源性比对结果
分离菌16S rDNA PCR扩增产物经1%琼脂糖凝胶电泳检测,可见1500 bp左右的特异性条带(见图3),与预期目的片段大小相符.PCR产物测序结果与Gen-Bank数据库比对,与维罗纳气单胞菌同源性为99.1%~100%.

图3 分离菌株16S rDNA基因PCR扩增电泳图M:DL2000标准分子质量;1~4:4个分离菌株Fig.3 16SrDNA PCR amplification results of isolatesM:DL2000 DNA Maker;1 ~ 4:PCR amplification products of four bacterial isolates
2.3 分离菌系统进化分析
系统进化分析显示(见图4),维罗纳气单胞菌聚为2 个大支,4 株分离株(编号为 1-1、2-1、3-1、5-1)与GenBank中登录的KC633849.1等15株中国分离株聚为一支.

图4 维罗纳气单胞菌16s rDNA基因片段的邻近法进化树Fig.4 Neighbor-joining consensus tree for partial 16SrDNA gene fragment of Aeromonas veronii
2.4 分离菌对昆明小鼠的致病性
4株家兔源维罗纳气单胞菌分别腹腔注射小鼠后,均在注射菌后7~8 h左右发病,小鼠出现精神不振,扎堆等现象.注射菌后12~24 h病情加重,小鼠表现出弓背、运动迟缓、食欲不振、精神沉郁、呼吸轻微急促等症状.注射菌后24~48 h 4株维罗纳气单胞菌对小鼠的致死率分别为1/5、2/5、2/5、3/5,剖解见肺脏出血.48 h后没有死亡的小鼠精神、食欲等均好转,出现耐过现象,对照组小鼠没有发病和死亡,说明4株分离菌对试验昆明小鼠均有一定的致病性.
2.5 药敏试验结果
对4株维罗纳气单胞菌运用临床常用的21种抗菌类药物进行药物敏感性试验,结果见表1,4株分离菌均对头孢噻肟、头孢他啶、头孢呋辛、头孢唑啉、左氧氟沙星、环丙沙星、诺氟沙星、氧氟沙星、四环素、多西环素、氟苯尼考、哌拉西林敏感,部分分离株对氨苄西林、阿莫西林、链霉素、妥布霉素、阿米卡星、新霉素、多粘菌素B耐药.
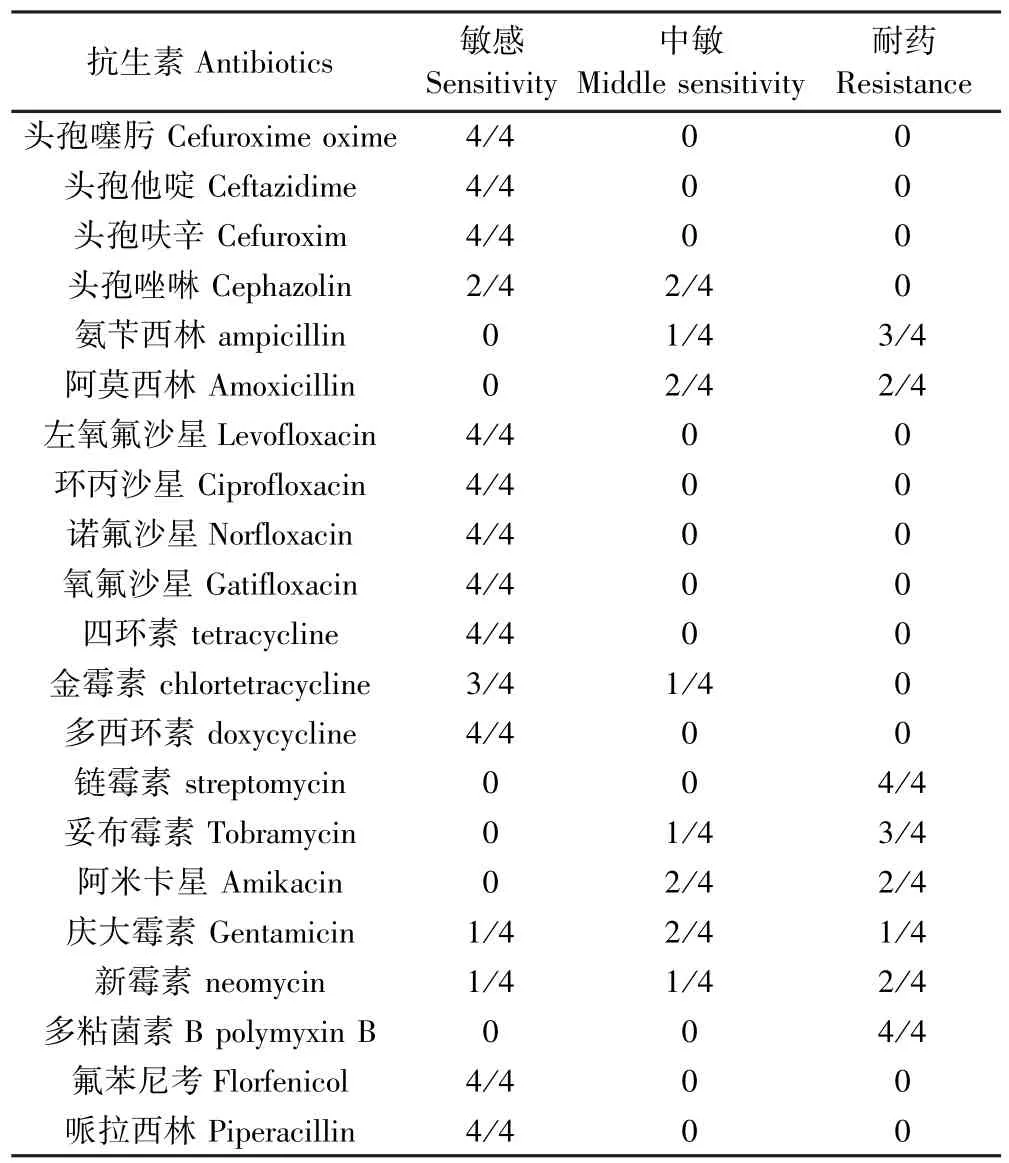
表1 4株维罗纳气单胞菌的药物敏感性结果Table 1 Drug sensitivity results of fourAeromonas veronii isolates
3 讨论
本试验首次从家兔肺脏分离得到维罗纳气单胞菌,并证明其对昆明小鼠有致病性.维罗纳气单胞菌作为一种较为新型的人-兽-鱼共患病呼吸道病原菌,具有一定的公共卫生学意义,应加强其防范.目前我国的家兔养殖方式正向着集约化和规模化转变,饲养方式的变化,导致一些条件性致病菌的感染发病增加.家兔呼吸道疾病临床症状多表现为流黏液性或脓性鼻涕,打喷嚏,呼吸困难等.其病因复杂,常见的感染因素有致病性大肠杆菌、多杀性巴氏杆菌 、金黄色葡萄球菌和支气管败血波氏杆菌等[20].本试验从患病家兔肺脏分离到4株维罗纳气单胞菌,虽然维罗纳气单胞菌不是家兔呼吸道常见病原菌,但研究发现其对试验动物昆明小鼠具有一定的致病力.结合临床症状和细菌分离结果,引起该家兔养殖场本次发生呼吸道疾病的病原菌为维罗纳气单胞菌.
抗生素是治疗细菌性疾病的主要措施,从目前国内外对维罗纳气单胞菌研究报道可知,不同地区、不同动物来源的维罗纳气单胞菌的耐药性不尽相同[7-15].本研究分离的4株维罗纳气单胞菌均对头孢噻肟、头孢他啶、头孢呋辛、头孢唑啉、左氧氟沙星、环丙沙星、诺氟沙星、加替沙星、四环素、多西环素、氟苯尼考、哌拉西林等12种药物敏感,部分分离株对氨苄西林、阿莫西林、链霉素、妥布霉素、阿米卡星、新霉素、多粘菌素B等7种药物耐药.该兔场通过选用敏感药物进行治疗,其呼吸道疾病得到了控制.
[1]冷东泽.维氏气单胞菌分离鉴定及防治研究[D].吉林:吉林农业大学,2016.
[2]边宇.致病性维氏气单胞菌多重PCR检测方法的建立及初步应用[D].吉林:吉林农业大学,2013.
[3]李刚山,范泉水,朱姝媛,等.一株与EHECO_(157):H_7诊断血清交叉凝集的维罗纳气单胞菌温和生物变种的分离鉴定[J].解放军预防医学杂志,2005,23(03):219-220.
[4]ABBOTT S L,SERVE H,JANDA J M.Case of Aeromonas veronii(DNA group 10)bacteremia[J].Journal of Clinical Microbiology,1994,32(12):3091-3092.
[5]FRAISSE T,LECHICHE C,SOTTO A,et al.Aeromonas spp.infections:retrospective study in Nimes University Hospital,1997-2004.[J].Pathologie-biologie,2008,56(2):70.
[6]李莉,杜钟珍,孙听,等.维罗纳气单胞菌致重症肺炎一例并文献复习[J].中华结核和呼吸杂志,2008,31(10):736-739.
[7]陈亨利.鲤源维氏气单胞菌(JLL-1)OmpAI、LamB基因的原核表达及其免疫原性研究[D].吉林:吉林农业大学,2016.
[8]葛铮.不同淡水鱼类维氏气单胞菌的分离鉴定及耐药性分析[D].吉林:吉林农业大学,2015.
[9]赵敏.四川地区斑点叉尾鮰源维氏气单胞菌的耐药性以及耐药基因检测分析[D].雅安:四川农业大学,2013.
[10]胡秀彩,边延峰,赵腊梅,等.鱼源维氏气单胞菌的分离鉴定[J].动物医学进展,2013(12):232-235.
[11]杨金平,沐建刚,刘岳,等.罗非鱼维罗纳气单胞菌的分离鉴定[J].动物医学进展,2015,36(5):40-43.
[12]曹恒源,乔晔,陈小娟,等.圆口铜鱼维氏气单孢菌的分离鉴定及药敏试验[J].水生态学杂志,2016,37(04):95-100.
[13]王家祯,耿昕颖,朱世馨,等.黄河鲤鱼源维氏气单胞菌的分离·鉴定及药敏试验[J].安徽农业科学,2015(19):104-106.
[14]韦阳道,杨军,文衍红,等.罗非鱼竖鳞病病原维氏气单胞菌的分离鉴定与致病性研究[J].中国畜牧兽医,2016,43(11):3047-3052.
[15]王海娟,王利,苟小兰,等.鱼源维氏气单胞菌的耐药性研究[J].中国畜牧兽医,2013,40(8):159-164.
[16]李伟杰,赵耘,刘燕,等.狐狸源致病性维氏气单胞菌的分离鉴定及耐药性分析[J].中国预防兽医学报,2012,34(4):289-292.
[17]朱芝秀,蒋新华,邓舜洲,等.甲鱼源致病性维氏气单胞菌的分离鉴定及抑菌试验(英文)[J].农业科学与技术(英文版),2016,17(4):804-809.
[18]CHIM H,SONG C.Aeromonas infection in critically ill burn patients[J].Burns Journal of the International Society for Burn Injuries,2007,33(6):756-759.
[19]NTUSHELO K.Identifying bacteria and studying bacterial diversity using the 16S ribosomal RNA gene-based sequencing techniques:A review[J].African Journal of Microbiology Research,2013,7(49):5533-5540.
[20]汪洋,赵德明.一起兔支气管败血波氏杆菌病的诊治[J].中国畜牧兽医,2008,35(8):93-94.
