优化实时并行采集技术心脏电影序列在心律失常者心脏MRI中的初步应用
2018-03-22马晓海谢国喜张晓咏王占宏赵轶轲范占明
陈 辉,马晓海*,谢国喜,赵 蕾,张晓咏,王占宏,赵轶轲,范占明
(1.首都医科大学附属北京安贞医院医学影像科,北京 100029;2.中国科学院深圳先进技术研究院,广东 深圳 518055;3.广州医科大学基础学院,广东 广州 511416;4.西门子医疗东北亚地区科研合作团队,广东 深圳 518055)
目前,心脏磁共振(cardiac MR, CMR)电影成像主要基于心电门控和节段采集技术,心律齐是高质量成像的基础[1]。心律失常患者心律不稳定,可产生运动伪影,导致检查失败或影响对心脏结构及功能的准确评价[2]。实时并行采集技术(temporal parallel acquisition technique, TPAT)采集速度快,对心律的依赖性相对较小,是常用的快速成像技术[3-4],但其空间分辨率较低。本研究优化TPAT实时电影成像序列的部分参数,并与传统CMR电影成像序列[平衡稳态自由进动(balanced steady-state free-precession, bSSFP)]对比,探讨其在心律失常患者CMR检查中的应用价值。
1 资料与方法
1.1 一般资料 收集2016年10月—2017年3月于我院接受CMR检查的81例患者,男58例,女23例,年龄14~81岁,平均(53.0±13.5)岁。根据MR检查中心律状况,将其分为心律失常组(n=33)或心律正常组(n=48)。前者心脏RR间期不等长,存在室性早搏、心房颤动、二联率等心律失常病变;后者心脏节律稳定、RR间期等长。
1.2 仪器与方法 采用 Siemens Verio 3.0T MR扫描仪,32通道表面相控阵心脏线圈,蓝牙心电门控技术。扫描前对患者行屏气训练。依次行bSSFP序列和优化TPAT实时电影成像序列扫描,FOV 340 mm×289 mm,均采集左心室短轴及四腔、三腔、两腔心长轴位电影图像,主要参数见表1。
1.3 图像分析
1.3.1 心肌厚度测量 按照美国心脏病协会(American Heart Association, AHA)发布的17节段分型法[5]对左心室进行分段,选择bSSFP和优化TPAT序列图像的左心室心底、乳头肌及心尖水平短轴层面,于舒张末期测量除心尖段以外左心室16节段的心肌厚度。
1.3.2 心功能分析 采用Siemens Syngo Argus后处理软件,选取心脏舒张末期和收缩末期短轴位电影图像,勾画心内、外膜边界,软件自动计算心功能参数,包括左心室射血分数(left ventricular ejection fraction, LVEF)、左心室舒张末期容积(left ventricular end diastolic volume, LVEDV)、左心室收缩末期容积(left ventricular end systolic volume, LVESV)、每搏输出量(stroke volume, SV)、心输出量(cardiac output, CO)和心肌质量(MASS),并将各参数除以体表面积,获得标准化参数[6]。
1.3.3 心肌应变分析 以CVi42后处理软件(Circle Cardiovascular Imaging, Calgary, Canada)加载优化TPAT实时电影成像序列和bSSFP序列图像,选取左心室舒张末期图像,勾画心内、外膜边界,获得心肌应变参数,记录心肌径向、圆周及长轴应变的峰值及平均值[7]。
1.3.4 图像质量评价 由2名高年资影像科医师独立以盲法评价图像质量,有分歧时经协商达成一致。图像质量评分标准[8]:1分,图像质量优秀,无伪影;2分,图像质量良好,轻微伪影;3分,图像质量中等,中度伪影;4分,图像质量差,明显伪影,无法评价。
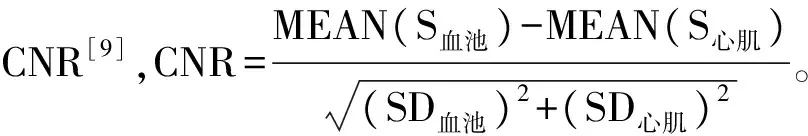
1.4 统计学分析 采用SPSS 19.0统计分析软件。正态分布计量资料以±s表示,以配对t检验比较两个序列间心肌厚度、心功能参数、心肌应变参数及CNR的差异;以配对秩和检验比较图像质量评分。计数资料用频数或百分率表示。P<0.05为差异有统计学意义。
2 结果
心律失常组中,房性心律失常17例,室性心律失常16例;心室率波动程度为3~90次/分,平均 (31.55±22.72)次/分,心率变异率为(10.55±7.73)%。
心律正常组中,bSSFP序列与优化TPAT实时电影成像序列所测量左心室各节段心肌厚度差异均无统计学意义(P均>0.05);心律失常组中,除基底段后间隔壁及后侧壁、心尖段前壁及侧壁以外,其余节段差异均有统计学意义(P均<0.05)。
两组中,两个序列所测量LVEF、LVEDV、LVESV、SV、CO和MASS差异均无统计学意义(P均>0.05,表2)。
心律失常组中,bSSFP序列与优化TPAT实时电影成像序列所测左心室心肌径向及圆周应变的峰值和平均值差异均有统计学意义(P均<0.05);心律正常组中心肌径向、圆周、长轴应变及心律失常组中长轴应变的峰值及平均值差异均无统计学意义(P均>0.05,表3)。
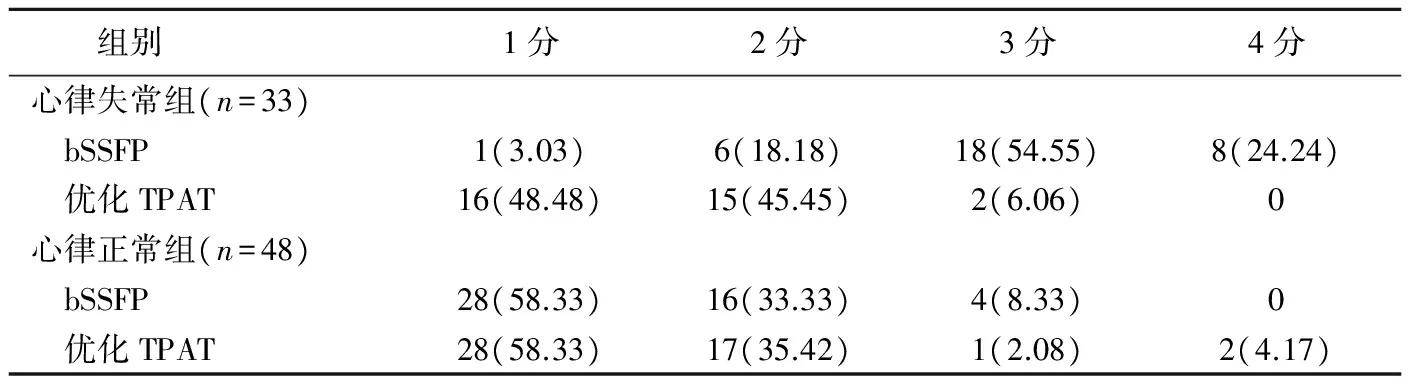
心律失常组中,优化TPAT实时电影成像序列的图像质量优于bSSFP图像(Z=5.939,P<0.001);心律正常组中,bSSFP序列图像质量与优化TPAT实时成像序列差异无统计学意义(Z=0.050,P=0.960),见表4。两组中CNR值差异均无统计学意义(P均>0.05,表3,图1、2)。
3 讨论
bSSFP序列是临床常用的CMR电影序列,对于心律正常者,可利用心电及呼吸门控技术获得清晰的图像,但心律不齐者图像质量则较差。TPAT可缩短CMR扫描时间、改善图像质量,提高时间及空间分辨率[10]。TPAT技术无需采集全部K空间的自动校准信号(auto-calibration signal, ACS)线,可利用相邻时间帧的K空间数据获得完整的ACS线,重建出高时间及空间分辨率的图像[3]。基于TPAT的单次屏气电影成像在评价左心形态及功能方面与bSSFP序列一致性较好,但空间分辨率低于bSSFP序列[11]。本研究优化了TPAT序列参数,观察其在心律失常患者中的应用价值。

表1 bSSFP和优化TPAT实时电影成像序列参数
表2 两组bSSFP与优化TPAT实时电影成像序列心功能参数比较(±s)
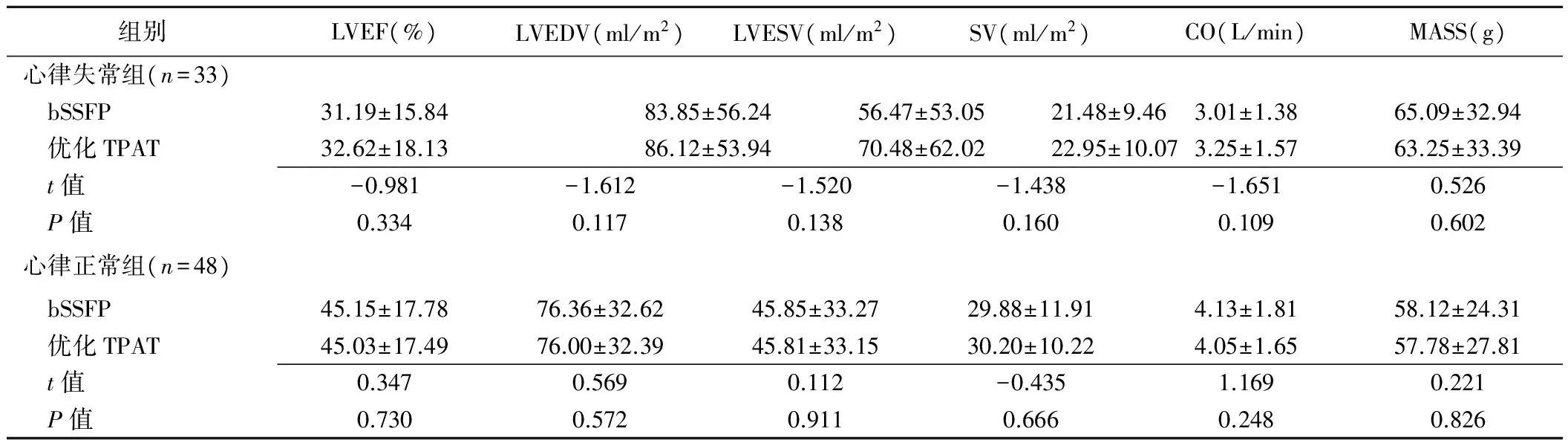
表2 两组bSSFP与优化TPAT实时电影成像序列心功能参数比较(±s)
组别LVEF(%)LVEDV(ml/m2)LVESV(ml/m2)SV(ml/m2)CO(L/min)MASS(g)心律失常组(n=33) bSSFP31.19±15.8483.85±56.2456.47±53.0521.48±9.463.01±1.3865.09±32.94 优化TPAT32.62±18.1386.12±53.9470.48±62.0222.95±10.073.25±1.5763.25±33.39 t值-0.981-1.612-1.520-1.438-1.6510.526 P值0.3340.1170.1380.1600.1090.602心律正常组(n=48) bSSFP45.15±17.7876.36±32.6245.85±33.2729.88±11.914.13±1.8158.12±24.31 优化TPAT45.03±17.4976.00±32.3945.81±33.1530.20±10.224.05±1.6557.78±27.81 t值0.3470.5690.112-0.4351.1690.221 P值0.7300.5720.9110.6660.2480.826
表3 两组bSSFP与优化TPAT实时电影成像序列心肌应变指标及CNR比较(±s)
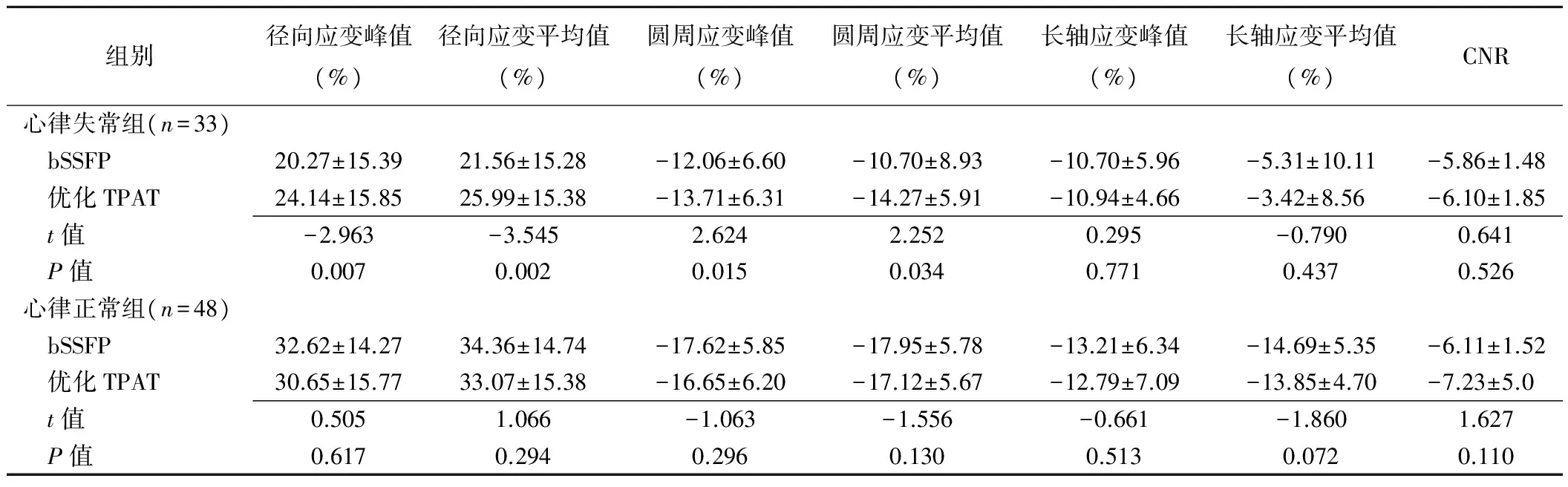
表3 两组bSSFP与优化TPAT实时电影成像序列心肌应变指标及CNR比较(±s)
组别径向应变峰值(%)径向应变平均值(%)圆周应变峰值(%)圆周应变平均值(%)长轴应变峰值(%)长轴应变平均值(%)CNR心律失常组(n=33) bSSFP20.27±15.3921.56±15.28-12.06±6.60-10.70±8.93-10.70±5.96-5.31±10.11-5.86±1.48 优化TPAT24.14±15.8525.99±15.38-13.71±6.31-14.27±5.91-10.94±4.66-3.42±8.56-6.10±1.85 t值-2.963-3.5452.6242.2520.295-0.7900.641 P值0.0070.0020.0150.0340.7710.4370.526心律正常组(n=48) bSSFP32.62±14.2734.36±14.74-17.62±5.85-17.95±5.78-13.21±6.34-14.69±5.35-6.11±1.52 优化TPAT30.65±15.7733.07±15.38-16.65±6.20-17.12±5.67-12.79±7.09-13.85±4.70-7.23±5.0 t值0.5051.066-1.063-1.556-0.661-1.8601.627 P值0.6170.2940.2960.1300.5130.0720.110
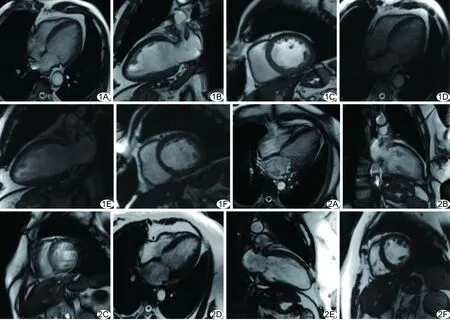
图1 患者男,67岁,心律正常组 A~C.分别为心脏四腔、两腔及短轴bSSFP图像,图像质量评分均为1分; D~F.分别为相应层面优化TPAT实时电影成像序列图像,图像质量评分均为1分 图2 患者男,46岁,心律失常组 A~C.分别为心脏四腔、两腔及短轴bSSFP图像,图像质量评分均为4分; D~F.分别为相应层面优化TPAT实时电影成像序列图像,图像质量评分均为1分
组别1分2分3分4分心律失常组(n=33) bSSFP1(3.03)6(18.18)18(54.55)8(24.24) 优化TPAT16(48.48)15(45.45)2(6.06)0心律正常组(n=48) bSSFP28(58.33)16(33.33)4(8.33)0 优化TPAT28(58.33)17(35.42)1(2.08)2(4.17)
本研究心律正常组中,优化TPAT实时电影成像序列与bSSFP序列所测室壁厚度、心功能及左心室应变参数差异均无统计学意义提示优化TPAT序列与bSSFP序列评价心脏结构及功能的一致性较好。心律失常组中,两个序列所测12个心肌节段的室壁厚度差异均有统计学意义,提示心律不齐对两个序列的测量值均有影响;两个序列测量心功能参数差异均无统计学意义,提示优化TPAT实时电影成像序列在心律失常患者心功能的评价方面与常规序列一致;两个序列测量左心室径向及圆周应变的峰值和平均值差异均有统计学意义,提示心律不齐对心脏短轴运动的影响较大,影响对心脏形态及结构的评价;心脏长轴应变的峰值和平均值差异无统计学意义,可能是由于心律不齐对心脏长轴运动影响相对较小。Bak等[12]对心律失常患者行单次屏气的TPAT电影成像及多次屏气bSSFP序列成像,发现两个序列间心功能参数LVEDV、LVESV及SV差异均有统计学意义,而心肌节段性室壁运动差异无统计学意义;本研究结果与之存在一定差异,分析原因可能与所采用扫描参数不同有关。Bak等[12]研究中所用单次屏气TPAT序列的时间分辨率为80.40 ms,低于本研究,同一心动周期内所采集图像帧数较少。
优化TPAT序列可进行自由呼吸扫描,但为与bSSFP序列保持一致,本研究采用单层屏气扫描。本研究心律正常组中,两个序列图像评分及CNR差异均无统计学意义,与Bak等[12]的研究结果一致;心律失常组中,优化TPAT序列图像质量优于bSSFP序列图像。优化TPAT序列时间分辨率高,扫描时间短,对心律的依赖性较小,可获得质量较好的图像。
本研究的不足:①样本量相对较小,未对不同心律失常患者的心脏形态及功能参数进行分层研究;②扫描时采用设备自带心电监护仪,精确程度低于12导联心电图;③发生室性二联律时,MR设备会误认心电触发R波,影响测量结果的准确性。
综上所述,优化TPAT实时电影成像序列无需心电和呼吸门控,可大幅缩短扫描时间。在心律正常者中,对心脏结构及功能的评价与传统CMR电影序列有较好的一致性;在心律失常患者中,其图像质量优于传统CMR电影bSSFP序列。对心律失常患者,推荐使用优化TPAT实时电影成像序列。
[1] 裴国元,姜建,陈玉成.心脏磁共振成像在室性心律失常诊治中的应用.中华心血管病杂志,2014,42(11):981-984.
[2] Contijoch F,Iyer SK, Pilla JJ, et al. Self-gated MRI of multiple beat morphologies in the presence of arrhythmias. Magn Reson Med, 2017,78(2):678-688.
[3] Breuer FA, Kellman P, Griswold MA, et al. Dynamic autocalibrated parallel imaging using temporal GRAPPA (TGRAPPA). Magn Reson Med, 2005,53(4):981-985.
[4] Nassenstein K, Eberle H, Maderwald S, et al. Single breath-hold magnetic resonance cine imaging for fast assessment of global and regional left ventricular function in clinical routine. Euro Radiol, 2010,20(10):2341-2347.
[5] Andre F, Lehrke S, Katus HA, et al. Reference values for the left ventricular wall thickness in cardiac MRI in a modified AHA 17-segment model. J Cardiovasc Magn Reson, 2012,14(Suppl 1):P223.
[6] Olivotto I, Maron BJ, Appelbaum E, et al. Spectrum and clinical significance of systolic function and myocardial fibrosis assessed by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. Am J Cardiol, 2010,106(2):261-267.
[7] Schuster A, Stahnke VC, Unterberg-Buchwald C, et al. Cardiovascular magnetic resonance feature-tracking assessment of myocardial mechanics: Intervendor agreement and considerations regarding reproducibility. Clin Radiol, 2015,70(9):989-998.
[8] Kaasalainen T, Kivistö S, Holmström M, et al. Cardiac MRI in patients with cardiac pacemakers: Practical methods for reducing susceptibility artifacts and optimizing image quality. Acta Radiol, 2015,57(2):178-187.
[9] Ratering D, Baltes C, Dörries C, et al. Accelerated cardiovascular magnetic resonance of the mouse heart using self-gated parallel imaging strategies does not compromise accuracy of structural and functional measures. J Cardiovasc Magn Reson, 2010,12:43.
[10] Niendorf T, Sodickson DK. Parallel imaging in cardiovascular MRI: Methods and applications. NMR Biomed, 2006,19(3):325-341.
[11] 王占宏,马晓海,赵蕾,等.心脏磁共振运动伪影校正相位敏感反转恢复序列在心律失常患者中的应用.中国医学影像技术,2016,32(3):441-444.
[12] Bak SH, Kim SM, Park SJ, et al. Assessment of left ventricular function with single breath-hold magnetic resonance cine imaging in patients with arrhythmia. Investig Magn Reson Imaging, 2017,21(1):20-27.
