葫芦素I对肝癌细胞生长的抑制作用及其与STAT3通路相关抗凋亡因子的关系
2018-03-22王成志彭元亮史夏青周晓庆杨满意赵劲风廖明媚
王成志,彭元亮,史夏青,周晓庆,杨满意,赵劲风,廖明媚
(中南大学湘雅医院 1. 卫生部纳米生物技术重点实验室 3. 神经内科,湖南 长沙 410008;2. 中南大学生命科学学院,湖南 长沙 410078)
肝癌是世界上第六大癌症,肿瘤致死率排名第二[1]。晚期肝癌的治疗仍是一个世界性难题,化疗虽可延长晚期肝癌患者的生存期,但毒副作用较大,分子靶向治疗具有无限前景,找到靶向治疗的肝癌药物迫在眉睫。
葫芦素I(cucurbitacin I)又名JSI-124,是从葫芦科植物中提取出来的三萜甾醇类物质[2],最近的研究表明葫芦素I具有潜在的抗癌效果,能引起胶质母细胞瘤[3]、乳腺癌[4]、骨肉瘤[5]及肝癌[6]等肿瘤细胞发生凋亡,而葫芦素I引起肿瘤细胞凋亡的分子机制复杂。在乳腺癌[4]和骨肉瘤[5]中,葫芦素I抑制信号转导子与转录因子3(signal transducer and activator of transcription 3,STAT3)的激活,抑制细胞侵袭和转移。在肝癌中,葫芦素I激活P53信号[6],上调促凋亡蛋白Fas及Bax的表达引起细胞凋亡。葫芦素I还能通过抑制血管内皮生长因子受体2(VEGFR2)、成纤维细胞生长因子受体1(FGFR1)和p-STAT3抑制细胞增殖和血管生成[7-8]。葫芦素I还能激活NF-κB信号通路[3],引起IL-6、IL-8和SOCS3的表达升高。然而其对肝癌的作用和机制目前尚不完全明确,本研究拟探讨葫芦素I对肝癌的作用及其潜在的分子机制。
1 材料与方法
1.1 材料
人肝癌细胞HepG2、QGY-7703、SMMC-7721均来自本实验室冻存。葫芦素I购自Sigma公司,STAT3、磷酸化STAT3(p-STAT3)、髓样细胞白血病1(myeloid cell leukemia 1,Mcl-1)、survivin、GAPDH一抗和二抗购自Cell Signaling Technology公司。CCK-8试剂盒购买自同仁化学公司,TRIzol购买自Invitrogen公司,逆转录试剂盒购买自东洋纺公司,SYBR Green染料购买自Biotool公司,细胞周期检测试剂盒购买自美国BD公司,Hochest 33342购买自碧云天公司。
1.2 方法
1.2.1 细胞培养 肝癌细胞(HepG2、QGY-7703、SMMC-7721)培养于10%胎牛血清,1%青霉素和链霉素,37 ℃,5%CO2,DMEM培养基中。
1.2.2 CCK-8法检测细胞活力将肝癌细胞(HepG2、QGY-7703、SMMC-7721)接种于96孔板,每孔8 000个细胞,每组5个复孔,待细胞贴壁后,加入含有不同浓度的葫芦素的培养基,继续培养24、48 h,每孔加入10 μL CCK-8溶液,继续孵育2 h,检测450 nm处吸光值。
1.2.3 细胞平板克隆形成实验 将HepG2细胞接种于6孔板中,每孔100~200个细胞,每组2个复孔。培养过夜后更换含有不同浓度的葫芦素I的培养基继续培养2周,待形成肉眼可见克隆时终止培养,PBS清洗3次,室温干燥,甲醇固定20 min,弃甲醇后加入吉姆萨工作液染色30 min,流水洗净,干燥后肉眼观察计数细胞克隆数。
1.2.4 流式细胞术检测细胞周期 收集处理好的细 胞, 加 入 800 µL PBS+0.5%BSA洗 涤 1次,离心去上清,加入10 µL破膜剂处理1 min,加入100 µL PI染液,室温下静置20 min,加入400 µL PBS+0.5%BSA重悬细胞,流式细胞仪检测分析细胞周期。
1.2.5 Hochest 33342染色检测细胞凋亡 收集处理好的细胞,加入100 µL 0.01 mg/mL的Hoechst 33342染液,避光染色10 min,PBS洗2次,重悬细胞后滴在干净的载玻片上,并在载玻片一端滴入少许封片剂,取干净的盖玻片从一端缓慢盖下,避免气泡产生,制好后荧光显微镜下观察并拍照。
1.2.6 Western blot 收集处理后的细胞,提取细胞总蛋白,10%的SDS-PAGE凝胶电泳,250 mA转膜至PVDF膜,5%BSA封闭1 h,一抗4 ℃孵育过夜,TBST洗膜3次,二抗孵育1 h,TBST洗膜3次,ECL化学发光显影。
1.2.7 实时定量PCR 收集处理的细胞,TRIzol法提取细胞总RNA,根据试剂盒说明逆转录成cDNA。实时PCR采用SYBR Green染料法,根据说明书体系进行扩增,使用β-actin作为内参基因。QuantStudio™实时PCR软件分析基因相对表达情况。引物序列(5'→3')STAT3(上游:GGA GAA ACA GGA TGG CCC AA,下游:ATC CAA GGG GCC AGA AAC TG);Mcl-1(上游:CAC TTC CGC TTC CTT CCA GT, 下 游:GGT GGC CAA AAG TCG CCC);Survivin( 上 游:AGG ACC ACC GCA TCT CTA CA, 下 游:TTT CCT TTG CAT GGG GTC GT);β-actin(上游:CAT GTA CGT TGC TAT CCA GGC,下游:CTC CTT AAT GTC ACG CAC GAT)。
1.3 统计学处理
2 结 果
2.1 葫芦素I对肝癌细胞增殖活性的影响
用不同浓度的(0.5、1、5、10 μmol/L)葫芦素I处理肝癌细胞(HepG2、QGY-7703、SMMC-7721)24、48 h,CCK-8法分析葫芦素I对肝癌细胞的细胞活力的影响,结果显示,各浓度的葫芦素I均能抑制肝癌细胞的增殖,并具有时间和浓度依赖性(均P<0.05)。3种细胞48 h的IC50值分别是0.19、4.16、1.13 μmol/L(图1)。
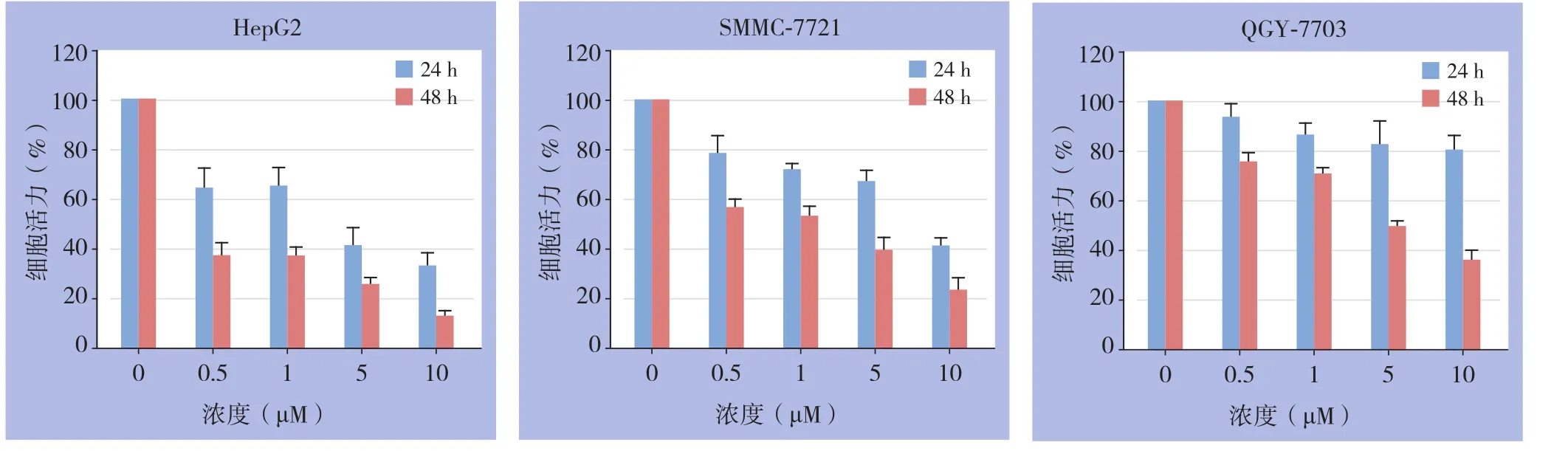
图1 葫芦素I处理后肝癌细胞增殖活力变化Figure 1 Changes in proliferative viabilities of different types of HCC cells after cucurbitacin I treatment
2.2 葫芦素I对肝癌细胞HepG2克隆形成的影响
细胞平板克隆形成实验分析葫芦素I对肝癌细胞HepG2的克隆形成能力的影响,结果显示,1 μmol/L的葫芦素I处理几乎完全抑制了HepG2细胞的克隆形成(图2)。

图2 葫芦素I处理HepG2后细胞克隆形成情况Figure 2 Colony-forming ability of HepG2 after cucurbitacin I treatment
2.3 葫芦素I对HepG2细胞的细胞周期的影响
流式细胞术检测葫芦素I处理HepG2细胞24 h后细胞周期变化,结果显示,1 μmol/L的葫芦素I引起HepG2细胞周期改变,使细胞周期阻滞在G2期(图3)。

图3 葫芦素I处理后HepG2细胞的细胞周期变化Figure 3 Changes in cell cycle of HepG2 cells after cucurbitacin I treatment
2.4 葫芦素I对HepG2细胞凋亡的影响
葫芦素I处理HepG2细胞24 h后,Hochest 33342染色分析细胞凋亡情况。结果显示,1 μmol/L葫芦素I处理后染色质皱缩、细胞核固缩、核裂解,出现凋亡小体等典型的细胞凋亡形态变化(图4)。

图4 葫芦素I处理后HepG2细胞形态变化(×400)Figure 4 Morphological change of HepG2 cells after cucurbitacin I treatment (×400)
2.5 葫芦素I处理HepG2细胞后蛋白表达变化
用Western blot分析葫芦素I处理HepG2细胞24 h后蛋白表达变化,结果显示,5、10 μmol/L的葫芦素I处理后,抗凋亡蛋白Mcl-1、survivin的表达均明显下调;同时,5、10 μmol/L的葫芦素I处理后,STAT3及其磷酸化分子p-STAT3的表达均明显下调(图5)。
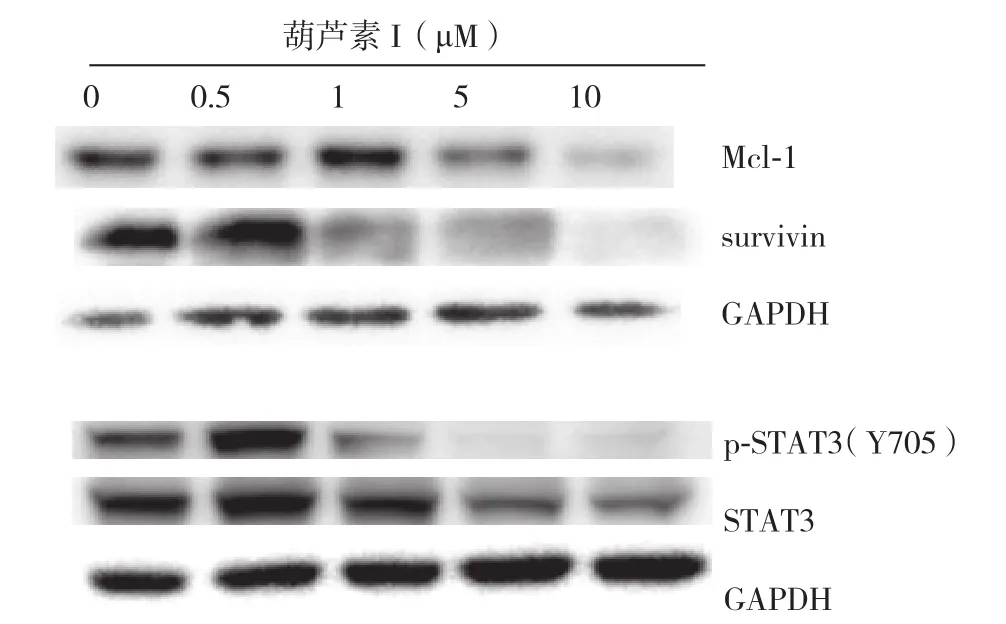
图5 葫芦素I处理后HepG2细胞抗凋亡因子及其相关信号分子蛋白的表达Figure 5 The protein expressions of anti-apoptoti factors and the related signaling molecules in HepG2 cells after cucurbitacin I treatment
2.6 葫芦素I处理HepG2细胞后mRNA表达相对变化
用实时定量PCR分析葫芦素I处理HepG2细胞前后mRNA的相对变化,结果(图6)显示,与对照组比较,1 μmol/L葫芦素I处理组STAT3、Mcl-1、survivin的mRNA表达均明显下调(P=0.000、0.005、0.000)。

图6 葫芦素I处理后HepG2细胞抗凋亡因子及其相关信号分子mRNA的表达Figure 6 The mRNA expressions of anti-apoptoti factors and the related signaling molecules in HepG2 cells after cucurbitacin I treatment
3 讨 论
Mcl-1是Bcl-2家族中的主要抗凋亡蛋白[9],在肝癌中高表达,与肝癌的生存和耐药相关,抑制Mcl-1可增加肝癌对化疗药物的敏感性[10]。针对Mcl-1开发的抑制剂S63845具有广谱的抗癌效果,且具有较好的安全性[11]。生存蛋白survivin在肝癌中高表达,促进肝癌细胞增殖和生存,降低肝癌细胞对化疗药物的敏感性[12-14]。因此Mcl-1和survivin可能是治疗肝癌的潜在靶点。本研究发现,葫芦素I不仅抑制Mcl-1和survivin的蛋白表达,还下调其mRNA的表达水平,这与在骨肉瘤细胞[5]研究结果一致。
STAT3是与肿瘤相关的一个主要转录因子,在肝癌中持续活化,活化状态的STAT3(p-STAT3 Y705)能进入细胞核调控下游基因表达[15-16],促进细胞增殖与存活。有大量研究[17-20]表明,抗凋亡Mcl-1和Survivin是STAT3信号通路的下游基因,抑制STAT3通路能显著抑制其下游基因Mcl-1和Survivin的表达。已经发现葫芦素I能抑制Mcl-1和survivin的表达,其是否通过STAT3通路尚不明确,我们的研究结果显示葫芦素I抑制了STAT3的激活,还下调Mcl-1和survivin的mRNA的表达水平,说明葫芦素I是通过STAT3信号通路抑制Mcl-1和survivin的表达。本研究还发现葫芦素I还从转录水平抑制STAT3的表达,与其在塞扎里综合征中的结果一致[21],STAT3 mRNA表达下调也与microRNA的调控相关[22]。非磷酸化的STAT3也能进入细胞核与染色质结合,维持染色质的稳定,调控基因的表达[23-24],葫芦素I抑制STAT3的表达还可能破坏染色质的稳定性,造成DNA损伤,其细胞内的具体机制还有待进一步的研究。
肿瘤的发展还与细胞周期密切相关,有研究发现葫芦素I能下调cyclin B1和cdc2的表达[25],葫芦素D也能引起细胞周期阻滞在G2/M期[26]。本研究发现,葫芦素I能使HepG2细胞周期阻滞在G2期。
本研究发现,葫芦素I能抑制肝癌细胞(HepG2、QGY-7703、SMMC-7721)的增殖,且具有时间和浓度依赖性。葫芦素I抑制HepG2细胞的克隆形成,阻滞周期进展。葫芦素I通过STAT3信号通路抑制Mcl-1和survivin的表达,引起HepG2细胞凋亡。尽管在细胞水平葫芦素I对肝癌细胞凋亡表现出较好效果,但由于生物体的复杂性,在体内是否有同样显著效果还有待进一步研究。
葫芦素I能抑制肝癌细胞增殖,引起细胞周期阻滞,诱导凋亡发生,其初步的分子机制是葫芦素抑制STAT3的激活,从而抑制其下游抗凋亡蛋白Mcl-1、survivin的表达。葫芦素I可能作为一种治疗肝癌的靶向药物。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[2] Chen JC, Chiu MH, Nie RL, et al. cucurbitacins and cucurbitane glycosides: structures and biological activities[J]. Nat Prod Rep,2005, 22(3):386–399.
[3] McFarland BC, Gray GK, Nozell SE, et al. Activation of the NF-κB pathway by the STAT3 inhibitor JSI-124 in human glioblastoma cells[J]. Mol Cancer Res, 2013, 11(5):494–505. doi: 10.1158/1541–7786.MCR-12–0528.
[4] Qi J, Xia G, Huang C R, et al. JSI-124 (cucurbitacin I) inhibits tumor angiogenesis of human breast cancer through reduction of STAT3 phosphorylation[J]. Am J Chin Med, 2015, 43(2):337–347.doi: 10.1142/S0192415X15500226.
[5] Oi T, Asanuma K, Matsumine A, et al. STAT3 inhibitor, cucurbitacin I, is a novel therapeutic agent for osteosarcoma[J]. Int J Oncol,2016, 49(6):2275–2284. doi: 10.3892/ijo.2016.3757.
[6] 吴思思, 朱国念, 倪银芸, 等. 葫芦素Ⅰ(JSI-124)通过p53信号通路诱导HepG2细胞凋亡[J]. 细胞与分子免疫学杂志, 2017,33(1):33–38.Wu SS, Zhu GN, Ni YY, et al. cucurbitacin Ⅰ (JSI-124)-induced apoptosis of HepG2 cells via p53 signaling pathway[J]. Chinese Journal of Cellular and Molecular Immunology, 2017, 33(1):33–38.
[7] Yuan G, Yan S, Xue H, et al. JSI-124 suppresses invasion and angiogenesis of glioblastoma cells in vitro[J]. PLoS One, 2015,10(3):e118894. doi: 10.1371/journal.pone.0118894.
[8] Kim HJ, Kim J. Antiangiogenic effects of cucurbitacin-I[J]. Arch Pharm Res, 2015, 38(2):290–298. doi: 10.1007/s12272–014–0386–5.
[9] Zhao J, Xin M, Wang T, et al. Nicotine enhances the antiapoptotic function of Mcl-1 through phosphorylation[J]. Mol Cancer Res,2009, 7(12):1954–1961. doi: 10.1158/1541–7786.MCR-09–0304.
[10] Liao M, Zhao J, Wang T, et al. Role of bile salt in regulating Mcl-1 phosphorylation and chemoresistance in hepatocellular carcinoma cells[J]. Mol Cancer, 2011, 10:44. doi: 10.1186/1476–4598–10–44.[11] Kotschy AS, Szlavik ZN, Murray J, et al. The MCL1 inhibitor S63845 is tolerable and effective in diverse cancer models[J].Nature, 2016, 538(7626):477–482. doi: 10.1038/nature19830.
[12] Su C. Survivin in survival of hepatocellular carcinoma[J]. Cancer Lett, 2016, 379(2):184–190. doi: 10.1016/j.canlet.2015.06.016.
[13] 李志红, 王志明, 穆拉德, 等. 三氧化二砷与阿霉素对人肝癌细胞株HepG2中survivin表达的影响[J]. 中国普通外科杂志, 2005,14(6):441–447.Li ZH, Wang ZM, MU LD, et al. Effects of arsenic trioxode and adriamycin on survivin expression in hepatocellular carcinoma cell line HepG2[J]. Chinese Journal of General Surgery, 2005,14(6):441–447.
[14] 龙厚勇, 刘君, 郑启昌. Survivin在肝细胞性肝癌中的表达及其临床意义[J]. 中国普通外科杂志, 2007, 16(3):281–283.Long HY, Liu J, Zheng QC. Expression and clinical signi fi cance of survivin in hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2007, 16(3):281–283.
[15] Carpenter RL, Lo HW. STAT3 Target Genes Relevant to Human Cancers[J]. Cancers (Basel), 2014, 6(2):897–925. doi: 10.3390/cancers6020897.
[16] 廖明媚, 王成志, 杨满意, 等. JAK2-STAT3信号通路在肝细胞癌中的研究进展[J]. 中国普通外科杂志, 2017, 26(1):102–108.doi:10.3978/j.issn.1005–6947.2017.01.017.Liao MM, Wang CZ, Yang MY, et al. Research progress of JAK2-STAT3 signing pathway in hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2017, 26(1):102–108. doi:10.3978/j.issn.1005–6947.2017.01.017.
[17] Wang J, Zhang G, Dai C, et al. Cryptotanshinone potentiates the antitumor effects of doxorubicin on gastric cancer cells via inhibition of STAT3 activity[J]. J Int Med Res, 2017, 45(1):220–230. doi: 10.1177/0300060516685513.
[18] Radhakrishnan H, Ilm K, Walther W, et al. MACC1 regulates Fas mediated apoptosis through STAT1/3 – Mcl-1 signaling in solid cancers[J]. Cancer Letters, 2017, 403:231–245. doi: 10.1016/j.canlet.2017.06.020.
[19] Lee DH, Sung KS, Bartlett DL, et al. HSP90 inhibitor NVPAUY922 enhances TRAIL-induced apoptosis by suppressing the JAK2-STAT3-Mcl-1 signal transduction pathway in colorectal cancer cells[J]. Cell Signal, 2015, 27(2):293–305. doi: 10.1016/j.cellsig.2014.11.013.
[20] Li S, Priceman S J, Xin H, et al. Icaritin inhibits JAK/STAT3 signaling and growth of renal cell carcinoma[J]. PLoS One, 2013,8(12):e81657. doi: 10.1371/journal.pone.0081657.
[21] van Kester MS, Out-Luiting JJ, von dem Borne PA, et al.cucurbitacin I inhibits STAT3 and induces apoptosis in Sézary cells[J]. J Invest Dermatol, 2008, 128(7):1691–1695. doi: 10.1038/sj.jid.5701246.
[22] Koukos G, Polytarchou C, Kaplan JL, et al. MicroRNA-124 regulates STAT3 expression and is down-regulated in colon tissues of pediatric patients with ulcerative colitis[J]. Gastroenterology,2013, 145(4):842–852. doi: 10.1053/j.gastro.2013.07.001.
[23] Timofeeva OA, Chasovskikh S, Lonskaya I, et al. Mechanisms of unphosphorylated STAT3 transcription factor binding to DNA.[J]. J Biol Chem, 2012, 287(17):14192–14200. doi: 10.1074/jbc.M111.323899.
[24] Peña G, Cai B, Liu J, et al. Unphosphorylated STAT3 modulates alpha 7 nicotinic receptor signaling and cytokine production in sepsis [J]. Eur J Immunol, 2010, 40(9):2580–2589. doi: 10.1002/eji.201040540.
[25] Su Y, Li G, Zhang X, et al. JSI-124 inhibits glioblastoma multiforme cell proliferation through G(2)/M cell cycle arrest and apoptosis augment[J]. Cancer Biol Ther, 2008, 7(8):1243–1249.
[26] Ku JM, Kim SR, Hong SH, et al. cucurbitacin D induces cell cycle arrest and apoptosis by inhibiting STAT3 and NF-κB signaling in doxorubicin-resistant human breast carcinoma (MCF7/ADR)cells[J]. Mol Cell Biochem, 2015, 409(1/2):33–43. doi: 10.1007/s11010–015–2509–9.
