腹腔镜下肝切除术手术难度评分系统的建立与应用
2018-03-22郭杨廖锐罗放
郭杨,廖锐,罗放
(重庆医科大学附属第一医院 肝胆外科,重庆 400016)
自1991年Reich等[1]成功实施了第一例腹腔镜肝切除术(LLR),经过20余年的探索与发展,近年来腹腔镜下肝切除术治疗肝脏病变已经得到越来越多的临床医师认可,并逐步开展,其手术适应证也不断扩大[2]。腹腔镜下肝切除术在术中出血、术后住院时间、术后心肺并发症发生率方面均优于开腹肝切除术,但在手术时间、30 d内再手术、胆汁漏、病灶局部复发等方面无明显差异[3]。对于肝癌而言,LLR与开腹肝切除术(open liver resection,OLR)在1、3、5年无瘤生存率及生存率上无明显差别[4]。可见LLR有着与OLR相同的疗效,同时在减轻患者痛苦与负担方面具有优势,其有康复快、创伤小及美观等优点,但存在操作难度大、止血、缝合较困难等问题。这就对临床手术医师手术技巧提出了更高的要求,故术前对手术难度进行充分评估,可以帮助外科医生更好的开展LLR。目前国内尚无LLR手术难度评分的文章,国外也仅有少数几篇文章进行了报道,但均未形成统一的标准,临床上也鲜有应用。本文综合考虑病灶位置、病灶大小、病灶与血管关系等因素,建立了腹腔镜下肝切除术手术难度评分系统,结果报告如下。
1 资料与方法
1.1 一般资料
收集2014年1月—2017年5月重庆医科大学附属第一医院肝胆外科收治的83例行腹腔镜下肝切除术患者临床资料,其中男52例,女31例;年龄15~84岁,平均年龄(54.92±13.84)岁;BMI(22.64±3.10);良性病变例22例(26.5%),包括肝血管瘤18例,肝脏局灶性增生4例;恶性病变61例(73.5%),包括原发性肝癌49例,胆管细胞癌3例,转移性腺癌9例。病例选择标准:⑴ 全身情况良好,能耐受肝切除术,ECOG评分(活动状态评分表)≤2;⑵ 术前通过CT诊断为肝占位;⑶ 肝功能 Child-Pugh分级为A级或B级,无严重肝硬化、门静脉高压症、门静脉癌栓及活动性肝炎者;⑷ 术中探查病灶无破裂,无血性腹腔积液;⑸ 术前未行射频消融(radiofrequency a b l a t i o n,R F A)、肝动脉介入化疗栓塞术(transcatheter arterial chemoembolization,TACE)等治疗。排除标准:⑴ 存在开腹肝切除术禁忌证;⑵ 术中探查上腹部严重粘连;⑶ 腹腔镜手术器械无法置人或无法建立CO2气腹者;⑷ 非手术因素中转开腹者;⑸ 术中探查发现病灶难以切除,而未将病灶完整切除者。
1.2 手术方法
所有手术均由同一组医生完成,主刀医师拥有60例以上LLR手术经验[5]。采用气管插管全麻,患者取仰卧位,头高足低位。打孔位置及站位根据病灶位置的不同而不同。总原则是有利于手术操作,手术具体操作参照中华医学会外科分会肝胆学组制定的《腹腔镜肝切除术专家共识和手术操作指南》[6]。对于入肝血流的阻断,可由主刀医师的习惯及手术情况决定[7]。对于非解剖性肝切除术,由于切除的范围不同,手术方法及操作存在较大差异,但所有手术均需将病灶完整切除。
1.3 病例分组与测量方法
1.3.1 手术难度分组 目前一些提及LLR手术难度的研究一般将手术时间、术中出血量、是否中转开腹及主刀医师的主观印象作为评价LLR手术难度的主要指标[8-10]。研究[11]已经指出,LLR手术中转开腹的主要原因为术中难以控制的出血及腹腔镜下难以暴露肿瘤。手术医师的主观评价受较多因素影响,难以量化。故本研究将中转开腹或者手术时间>360 min的病例定义为困难组,其余为简单组。
1.3.2 病灶的位置分组及测量 根据病灶是否靠近下腔静脉进行分组,所有患者利用CT测得下腔静脉与病灶的最近距离。将病灶与下腔静脉的距离>3 cm者定义为与下腔静脉距离较远组,将病灶与下腔静脉的距离≤3 cm者定义为与下腔静脉距离较近组。病变的直径以及病灶与下腔静脉的距离通过术前CT测得。测量由2位研究者独立在我院计算机PACS系统上进行,测量精度0.01 cm。病变的直径取最大横径,病变与下腔静脉的距离取最近的水平距离。若有多个病灶,取距离最近病灶(图1)。对83例病例的病灶与下腔静脉的最近距离进行测量,测的平均距离(3.92±1.38)cm,最近距离1.37 cm,最远距离7.24 cm。

图1 不同位置病灶距下腔静脉距离Figure 1 Distances of lesions at different locations from the inferior vena cava
1.4 统计学处理
采用SPSS 23.0统计软件进行统计学处理。收集LLR术手术困难的潜在相关因素,包括年龄、性别、BMI、上腹部手术史、病灶位置、病灶大小、病变的良恶性、胆红素、血小板数目、肝功能分级、是否合并HBV感染、是否存在肝硬化。用χ2检验或fisher精确检验筛选手术困难的危险因素。再对上述危险因素进行Logistic回归分析,对危险因素进一步筛选,并根据回归系数对危险因素进行赋值,计算每个病例的得分,通过ROC曲线验证评分系统评价手术难度的效能。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 手术结果
25例患者行中转开腹肝切除术(30.1%),其中1 1例因术中难以控制出血而中转开腹,14例因腹腔镜下难以将肿瘤完全切除而中转开腹。手术时间230(70~815)min,术中出血300(10~5 000)mL,术中输血23例(27.7%),所有恶性病例患者术后切缘均为阴性,2例患者术后发生胆汁漏,经保守治疗后痊愈出院。术后住院时间10(4~57)d,无再次手术病例。无围手术期死亡病例。
2.2 手术难度影响因素的单因素分析
单因素分析显示,6个因素有统计学差异,分别为年龄、性别、病灶的直径、病灶的性质、病灶与下腔静脉的距离、病灶是否位于肝左外叶(表1)。
2.3 手术难度影响因素的多因素分析
对于单因素分析有统计学差异的6个变量,年龄可能影响患者身体机能而影响手术难度;与下腔静脉的距离及是否位于左外叶直接决定病灶的位置,对手术难度可能存在影响;病灶的大小直接决定切除的范围而影响手术难度;病灶的良恶性可能因为肿瘤的局部浸润、粘连而影响手术难度。而对于性别,目前的一些研究[8,12-13]均不支持手术难度与性别有关,故本文将年龄、与下腔静脉的距离、是否位于左外叶、病灶的大小、病灶的良恶性进行多因素分析。结果显示病灶直径≥8 cm(OR=7.034,P=0.043);病灶与下腔静脉的距离≤3 cm(OR=12.881,P=0.001);病灶不位于左外叶(OR=26.774,P=0.001)为手术困难的独立危险因素(表2)。
2.4 手术难度评分系统的建立
对于多因素分析有意义的3个变量在进行Logistic回归(表2)。根据二元Logistic回归特点,根据回归系数,对手术困难的因素进行评分,病灶直径(≥8 cm 2.0分,<8 cm 0分);病灶与下腔静脉的距离(≤3 cm 2.6分,>3 cm 0分);病灶位置(左外叶0分,非左外叶3.3分)。
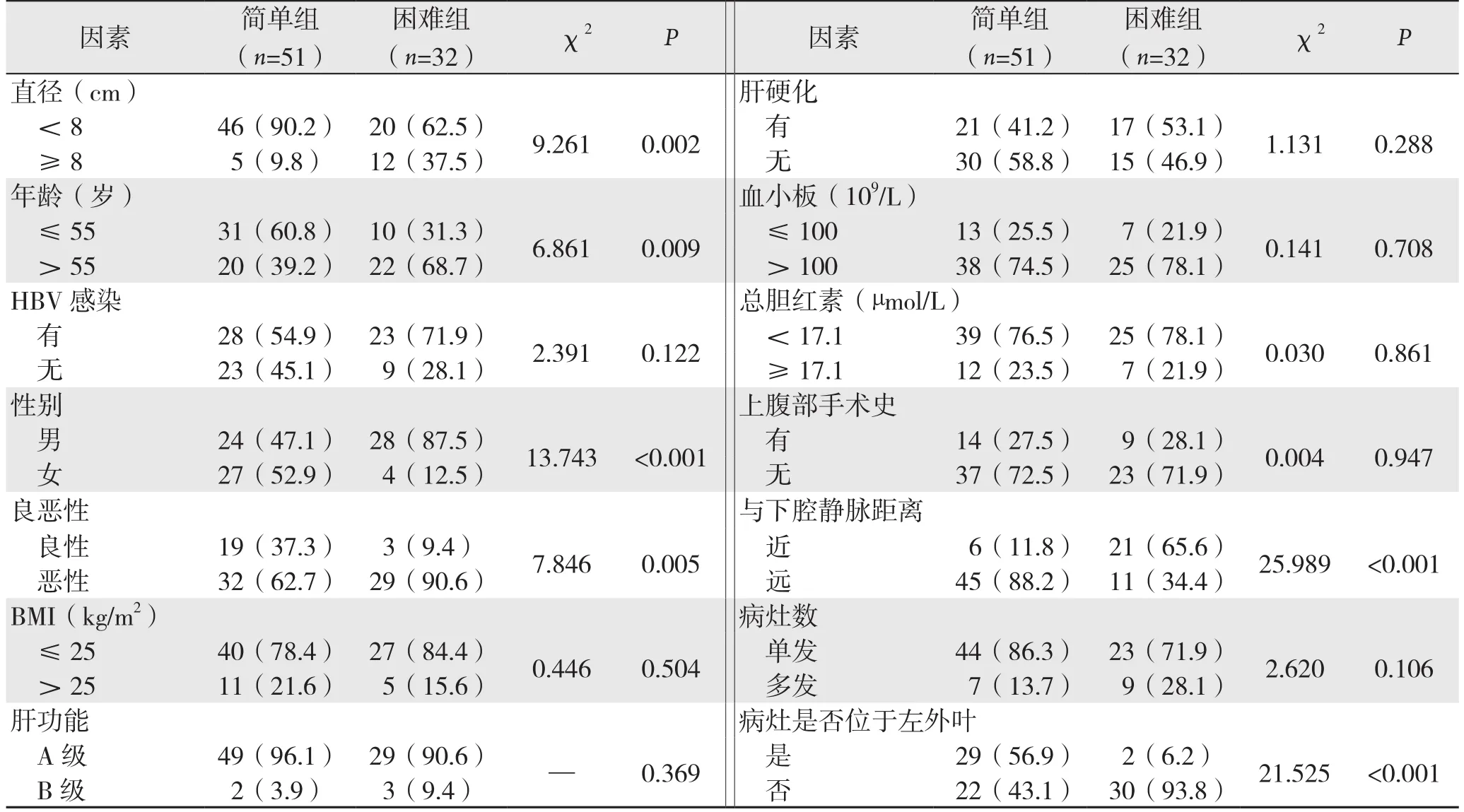
表1 影响LLR难度的单因素分析[n(%)]Table 1 Univariate analysis of in fl uential factors for LLR difficulty [n (%)]

表2 影响LLR手术难度多因素Logistic分析Table 2 Multivariate Logistic analysis of in fl uential factors for LLR difficulty
2.5 手术难度评分系统的效能
根据以上评分系统,对83例LLR进行评分,画出相应的ROC曲线,评价该评分系统的效能。曲线下面积为0.897(SE=0.036,P=0.000,95%CI=0.826~0.968)(图2)。评分取4时灵敏度为0.719,特异度为0.922。根据ROC曲线,本研究将<4分的定为容易组,≥4分定为困难组。
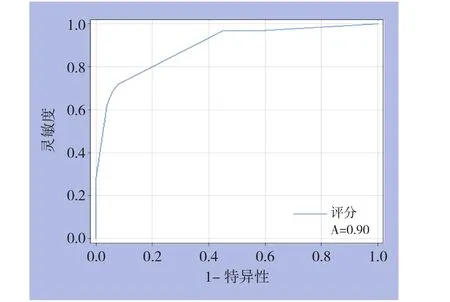
图2 LLR难易程度评分系统ROC曲线Figure 2 ROC curve of the scoring system for estimating LLR surgical difficulty
3 讨 论
腹腔镜下肝切除术由于其操作空间狭小、术中止血困难,现仍存在较大难度,并且有较高的中转开腹率。故手术前对难度做出预测显得至关重要。现阶段的手术难度分级系统[14-16],主要研究开腹肝切除术,对于LLR不一定适用,而Difficulty Scoring System(DSS)[8]在临床中使用的并不广泛。现存的肝切除术难度评分系统并不能很好的评价LLR手术难度,需要一个新的难度评价体系[17]。本研究提出了一个新的LLR手术难度的分级思路,综合考虑了患者病史及术前影像学资料,将病灶的位置及大小作为预测手术难度的主要指标。根据该评分系统,术前可以对所有拟行肝切除术的病例进行评分,若评分较高,手术医师应该根据自身情况选择合适的手术方式。
本研究通过logistic回归分析确定影响腹腔镜下肝切除术难度的独立因素有病灶直径>8 cm、病灶与下腔静脉的距离≤3 cm、病灶不位于左外叶。由于肝脏的特殊解剖结构,其血供丰富,同时腹腔镜手术需在狭小的操作空间下进行,一旦操作不慎就会造成难以控制的出血,而不得已中转开腹。本研究发现术前测量病灶距下腔静脉的距离对于预测手术难度有特别的意义,一旦病灶距下腔静脉较近,腹腔镜操作时,其位置均较深,同时与肝静脉、肝动脉及门静脉距离可能较近。当病灶较大且位置较深时,手术中不但需要进行较大范围的切除,还有可能损伤临近的血管,造成不必要的出血,大大增加了手术难度。故病灶直径>8 cm或者病灶下腔静脉的距离≤3 cm时,手术难度将较大。对于位于左外叶的病灶而言,其大多可以行左外叶切除术。目前LLLR(腹腔镜下肝左外叶切除术)已经成为治疗肝左外叶病灶的金标准[18],且取得了较好的疗效[19]。LLLR被普遍认为手术难度较低[20],与本研究结果一致。
如今预测肝切除术手术难度的方式主要有:Major/Minor分级、DSS、Complexity Classification。其中Major/Minor分级是根据肝切除的范围分级,DSS是根据病灶的位置、病灶大小、肝切除范围、肝功能以及病灶与血管的关系进行分级,Complexity Classification是根据不同的切除方式进行分级。以上分级系统都将肝脏切除范围视为一个重要指标。但临床中肝切除的范围较为复杂,并非所有的病灶都能局限在同一肝段或肝叶内,我们在定义肝切除范围时存在一定困难,而术前的影像学资料也不能完全确定手术的切除范围。病灶的位置和大小才是决定肝切除范围的决定性因素,对于如今讨论较热的解剖性肝切除术与非解剖性肝切除术而言,解剖性肝切除术的近期疗效并不一定优于非解剖性肝切除术[21-23],对于患者预后的影响仍存在争议[24-25],故并非所有手术都需行解剖性肝切除。本研究在探讨肝切除术的难度时,未将肝切除的范围及是否行解剖性肝切除术纳入。而将病灶的位置转化为可以量化的指标,通过病灶与下腔静脉的距离及病灶大小,间接反映手术难度,在临床工作中简单易行。
本研究为回顾性研究,有些病例手术记录相对简单,导致在收集数据时一些术中详情缺失。建立可靠的手术难度的数学模型应有500例以上的病例,而本文为单中心回顾性研究,且样本量较少,模型建立后实际应用效能可能受到影响,还需多中心、大样本的研究结果不断完善难度评分系统,使其更具说服力。随着腹腔镜手术的成熟和手术器械的改进,评分系统中的危险因素及其赋值可能改变,届时应根据最近的LLR病例修改评分系统以指导不断发展的临床实践。
通过本研究建立的LLR手术难度的评分系统,可有效的指导不同手术经验的临床医师选择合适的手术方式,不仅可以向临床医师提供参考,还可以减轻病患手术风险及经济负担。对于腹腔镜肝切除术经验较少的医师,建议选择评分较低的病例进行手术,这样可以避免经验不足的医师进行腹腔镜难以完成的手术,减少由于经验不足、病例选择不当而导致的不良后果。对于有经验的医师而言,若术前难度评分较高,选择腹腔镜手术时应慎重。综上LLR难度评分系统在临床工作中简单、实用,可以在术前有效的评价手术难度,对临床工作提供参考。
[1] Reich H, McGlynn F, DeCaprio J, et al. Laparoscopic excision of benign liver lesions[J]. Obstet Gynecol, 1991, 78(5 Pt 2):956–958.
[2] 郑树国, 田驹. 腹腔镜肝切除术适应证再探讨[J]. 中国普外基础与临床杂志, 2013, 20(4):352–355.Zheng SG, Tian J. Further Discussion of Indications for Laparoscopic Hepatectomy[J]. Chinese Journal of Bases and Clinics In General Surgery, 2013, 20(4):352–355.
[3] Komorowski AL, Mituś JW, Wysocki WM, et al. Laparoscopic and open liver resection - a literature review with meta-analysis[J]. Arch Med Sci, 2017, 13(3):525–532. doi: 10.5114/aoms.2015.55545.
[4] 佟庆, 丁伟, 晏冬, 等. 腹腔镜与开腹肝切除术治疗肝癌疗效的Meta分析[J]. 中国普通外科杂志, 2015, 24(1):27–33. doi:10.3978/j.issn.1005–6947.2015.01.006.Tong Q, Ding W, Yan D, et al. Meta-analysis of efficacy of laparoscopic versus open liver resection for liver cancer[J]. Chinese Journal of General Surgery, 2015, 24(1):27–33. doi:10.3978/j.issn.1005–6947.2015.01.006.
[5] Vigano L, Laurent A, Tayar C, et al. The learning curve in laparoscopic liver resection: improved feasibility and reproducibility[J]. Ann Surg, 2009, 250(5):772–782. doi: 10.1097/SLA.0b013e3181bd93b2.
[6] 中华医学会外科学分会肝脏外科学组. 腹腔镜肝切除术专家共识和手术操作指南(2013版)[J]. 中华外科杂志, 2013, 51(4):289–292. doi:10.3760/cma.j.issn.0529–5815.2013.04.001.Liver Surgery Group of Surgery Society of Chinese Medical Association. Expert consensus on and operation instructions for laparoscopic liver resection (2013 edition)[J]. Chinese Journal of Surgery, 2013, 51(4):289–292. doi:10.3760/cma.j.issn.0529–5815.2013.04.001.
[7] 晏益核, 卢榜裕, 蔡小勇, 等. 腹腔镜肝切除术中两种选择性入肝血流阻断方法的比较[J]. 中国普通外科杂志, 2012, 21(7):859–863.Yan YH, Lu BY, Cai XY, et al. Comparison of two methods of selective hepatic vascular exclusion for laparoscopic hepatectomy[J]. Chinese Journal of General Surgery, 2012,21(7):859–863.
[8] Ban D, Tanabe M, Ito H, et al. A novel difficulty scoring system for laparoscopic liver resection[J]. J Hepatobiliary Pancreat Sci, 2014,21(10):745–753. doi: 10.1002/jhbp.166.
[9] Kawaguchi Y, Fuks D, Kokudo N, et al. Difficulty of Laparoscopic Liver Resection: Proposal for a New Classification[J]. Ann Surg,2018,267(1):13–17. doi: 10.1097/SLA.0000000000002176.
[10] Periyasamy M, Cho JY, Ahn S, et al. Prediction of surgical outcomes of laparoscopic liver resections for hepatocellular carcinoma by defining surgical difficulty[J]. Surg Endosc, 2017,31(12):5209–5218. doi: 10.1007/s00464–017–5589–7.
[11] 陈章彬, 许丁伟, 许宁, 等. 腹腔镜下肝切除术中转开腹的相关因素初步分析[J]. 腹腔镜外科杂志, 2016, 21(12):894–898.doi:10.13499/j.cnki.fqjwkzz.2016.12.894.Chen ZB, Xu DW, Xu N, et al. The preliminary analysis of relative factors for laparo scopic hepatectomy converted to open surgery[J]. Journal of Laparoscopic Surgery, 2016, 21(12):894–898.doi:10.13499/j.cnki.fqjwkzz.2016.12.894.
[12] Hasegawa Y, Wakabayashi G, Nitta H, et al. A novel model for prediction of pure laparoscopic liver resection surgical difficulty[J].Surg Endosc, 2017, 31(12):5356–5363. doi: 10.1007/s00464–017–5616–8.
[13] Im C, Cho JY, Han HS, et al. Validation of difficulty scoring system for laparoscopic liver resection in patients who underwent laparoscopic left lateral sectionectomy[J]. Surg Endosc, 2017,31(1):430–436. doi: 10.1007/s00464–016–4994–7.
[14] Couinaud C. Contribution of anatomical research to liver surgery[J].Fr Med, 1956, 19(5):5–12.
[15] Lee MK 4th, Gao F, Strasberg SM. Completion of a Liver Surgery Complexity Score and Classification Based on an International Survey of Experts[J]. J Am Coll Surg, 2016, 223(2):332–342. doi:10.1016/j.jamcollsurg.2016.03.039.
[16] Lee MK 4th, Gao F, Strasberg SM. Perceived complexity of various liver resections: results of a survey of experts with development of a complexity score and classi fi cation[J]. J Am Coll Surg, 2015,220(1):64–69. doi: 10.1016/j.jamcollsurg.2014.09.017.
[17] Halls MC, Cherqui D, Taylor MA, et al. Are the current difficulty scores for laparoscopic liver surgery telling the whole story? An international survey and recommendations for the future [J]. HPB(Oxford), 2017, pii: S1365–182X(17)30926–7. doi: 10.1016/j.hpb.2017.08.028. [Epub ahead of print]
[18] 刘荣, 赵国栋. 肝左外叶切除“金标准“术式:腹腔镜肝左外叶切除术[J]. 中华腔镜外科杂志: 电子版, 2010, 3(6):474–478.doi:10.3877/cma.j.issn.1674–6899.2010.06.002.Liu R, Zhao GD. A “gold standard“ procedure of left lateral segment liver resection:laparoscopic left lateral segment liver resection[J].Chinese Journal of Laparoscopic Surgery: Electronic Edition, 2010,3(6):474–478. doi:10.3877/cma.j.issn.1674–6899.2010.06.002.
[19] 陈求赞. 腹腔镜和开腹肝左外叶切除术62例对比分析[J]. 中华普外科手术学杂志: 电子版, 2016, 10(2):174–176. doi:10.3877/cma.j.issn.1674–3946.2016.02.029.Chen QZ. Open and laparoscopic hepatic left lateral lobectomy for 62 patients[J]. Chinese Journal of Operative Procedures of General Surgery: Electronic Version, 2016, 10(2):174–176. doi:10.3877/cma.j.issn.1674–3946.2016.02.029.
[20] Tanaka S, Kubo S, Kanazawa A, et al. Validation of a Difficulty Scoring System for Laparoscopic Liver Resection: A Multicenter Analysis by the Endoscopic Liver Surgery Study Group in Japan[J]. J Am Coll Surg, 2017, 225(2):249–258. doi: 10.1016/j.jamcollsurg.2017.03.016.
[21] Zhao H, Chen C, Gu S, et al. Anatomical versus non-anatomical resection for solitary hepatocellular carcinoma without macroscopic vascular invasion: A propensity score matching analysis [J].J Gastroenterol Hepatol, 2017, 32(4):870–878. doi: 10.1111/jgh.13603.
[22] Marubashi S, Gotoh K, Akita H, et al. Analysis of Recurrence Patterns After Anatomical or Non-anatomical Resection for Hepatocellular Carcinoma[J]. Ann Surg Oncol, 2015, 22(7):2243–2252. doi: 10.1245/s10434–014–4214–4.
[23] Shindoh J, Makuuchi M, Matsuyama Y, et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-speci fi c survival of patients with hepatocellular carcinoma[J]. J Hepatol, 2016, 64(3):594–600. doi:10.1016/j.jhep.2015.10.015.
[24] Cucchetti A, Cescon M, Ercolani G, et al. A comprehensive metaregression analysis on outcome of anatomic resection versus nonanatomic resection for hepatocellular carcinoma[J]. Ann Surg Oncol, 2012, 19(12):3697–3705. doi: 10.1245/s10434–012–2450-z.[25] Li SQ, Huang T, Shen SL, et al. Anatomical versus non-anatomical liver resection for hepatocellular carcinoma exceeding Milan criteria[J]. Br J Surg, 2017, 104(1):118–127. doi: 10.1002/bjs.10311.
