铁线莲‘Blekitny Aniol’组织培养及再生体系建立
2018-03-21张彦妮东北林业大学园林学院黑龙江哈尔滨150040
黄 鑫,张彦妮(东北林业大学园林学院,黑龙江 哈尔滨 150040)
铁线莲属(Clematis)隶属于毛茛科(Ranunculaceae),多为木质藤本,少数为草本、灌木或亚灌木,是国际上著名的观赏花卉,除南极洲以外,全世界各地均有分布[1]。铁线莲茎韧如铁线,花开如莲,花型新颖,花色从单一到复合、渐变几乎囊括了所有常见的色彩,花量大,花期长[2]。覆盖率和生长速度上表现较好,可以做立体装饰,也可以应用于地被、盆花、切花中自成一景,被誉为“藤本植物皇后”。在欧美国家,铁线莲的栽培育种历史悠久,园艺品种已经在3 000种以上,多应用在植物园、公园、庭院的廊架绿亭、墙面、地表以构成独立的景观。每年5月英国切尔西园艺展都会展出铁线莲方面顶尖的园林作品,铁线莲也常作为国宴摆花[3]。在国内,铁线莲尚属新兴品种,大规模的新优品种多源于欧洲,中国科学院植物研究所北京植物园和上海植物园已经批量引种并开展研究,这也反映了铁线莲逐步扩大的市场需求和广阔的应用前景。
近年来,关于铁线莲的研究主要集中于药理分析和区域性种质资源调查方面,而对于新品种培育和栽培繁殖方面的研究相对较少[4]。铁线莲属是中医临床常用的清热解毒或祛风除湿类药物,其中提取出的皂苷及木脂素类成分,具有一定的抑制肿瘤活性作用[5]。由于铁线莲栽培品种结实少、多为不可育种子,发芽率低,故生产中通常采用扦插和压条繁殖,但繁殖系数也较低,生长缓慢,难以满足市场要求[6]。而利用植物组织培养技术,不仅可以提高繁殖速度,还可保持植物优良的观赏特性[7]。为了将优良品种更好地推广到园林应用上,国内外学者开展了相应的研究:张启香等[8]以栽培品种(C.florida‘MultiBlue’)的幼叶、茎尖、嫩茎为外植体,其中通过茎尖诱导出的愈伤组织可以形成胚性愈伤组织,培育周期为10个月;袁迎燕等[9]以毛蕊铁线莲(C.lasiandra)为材料,通过带芽茎段获得再生植株;Mitrofanova等[10]对不同外植体获得的铁线莲植株的分子遗传异质性进行了研究。目前对于铁线莲组织培养方面的研究仍处在探索阶段,对于不同品种的铁线莲,再生途径差异较大,还需要不断探索和完善[10]。
本研究以铁线莲品种Blekitny Aniol(由波兰引进的晚花大花型栽培品种)为研究对象,以叶片、茎段和带芽茎段为外植体,通过愈伤组织或不定芽分化途径,旨在成功建立该品种的组织培养再生体系,为其推广应用提供理论和实践参考,也为其他铁线莲属植物引种和开发利用奠定一定基础。
1 材料与方法
1.1 材料
试验材料取自栽植于东北林业大学园林学院花卉研究所的盆栽铁线莲品种Blekitny Aniol,选取其当年生枝条上的叶片、茎段和带芽茎段作为供试材料。
1.2 试验方法
1.2.1外植体处理及消毒 于3、4月份在天气晴朗的状态下剪取当年生长健壮的嫩茎10 cm左右,茎和叶分开,自来水冲去表面尘垢,在加洗洁精溶液浸泡10 min后用流水漂洗15 min,放入无菌瓶内,在超净工作台上用75%酒精清洗10 s后用无菌水冲洗3遍,然后在1%的NaClO溶液中分别浸泡3、5、7 min,再次用无菌水冲洗3~5遍,在灭菌的滤纸上吸干表面水分。将叶片切成约1 cm×1 cm,茎段和带芽茎段切成1 cm左右,接种于各类培养基上。每处理20个外植体,重复3次。14 d后分别统计不同消毒时间的污染率、褐化率和存活率,筛选出外植体最佳的消毒时间。
1.2.2带芽茎段腋芽的诱导 将消毒后的带芽茎段接种在MS基本培养基上,分别添加不同浓度的6-BA(0.5、1.0、2.0 mg·L-1)、NAA(0.01、0.05、0.10 mg·L-1),进行二因素三水平的正交试验。每处理接种20个外植体,3次重复。30 d后统计腋芽萌发率、平均腋芽数和生长状况。
1.2.3叶片、茎段愈伤组织的诱导 将处理后的叶片和茎段接种于愈伤组织诱导培养基上进行培养,以MS为基本培养基,分别添加不同浓度的6-BA(0.5、1.0、2.0 mg·L-1)、NAA(0.01、0.05、0.10 mg·L-1)组合成二因素三水平正交试验。每处理接种20个外植体,3次重复。30 d后分别统计愈伤组织诱导率并记录生长情况。
1.2.4愈伤组织不定芽的分化 将诱导出生长状态良好的愈伤组织分别转接到不同组合的分化培养基上,进行不定芽的分化,以1/2MS为基本培养基,添加不同浓度的6-BA(1、2、3 mg·L-1)、NAA(0.01、0.05、0.10 mg·L-1)组成二因素三水平试验。每种处理20个外植体,3次重复。30 d后分别统计不定芽分化率及平均不定芽数。
1.2.5芽的增殖培养 将由愈伤组织分化而来的不定芽和由带芽茎段直接诱导产生的腋芽接种到增殖培养基上进行丛生芽的诱导,选择上面不定芽分化率高的培养基作为增殖培养基,每种处理20个外植体,3次重复。30 d后记录增殖芽数,计算增殖倍数。
1.2.6组培苗的生根诱导 将生长良好、高1~2 cm的不定芽(具有1~2对新生叶片)转接到生根培养基上,以1/2MS和MS为基本培养基,添加不同浓度的NAA(0.05、0.1、0.5 mg·L-1)。每个处理10瓶,每瓶1株,重复3次,定期观察并记录生根情况。40 d后统计生根率、平均生根数、平均根长。以上所有培养基均附加2.5%蔗糖、0.75%琼脂,pH 5.8~6.0。培养室培养温度为(25±2) ℃,光照强度为2 000 lx,光周期为16 h·d-1。
1.3 统计分析方法
污染率=(污染的外植体个数/接种的外植体个数)×100%;
褐化率=(褐化的外植体个数/接种的外植体个数)×100%;
存活率=(存活的外植体个数/接种的外植体个数)×100%;
第一种思路:大多数的学者认为中国共产党生态文明思想是经历了以毛泽东、邓小平、江泽民、胡锦涛为核心的党的四代中央领导集体不断探索、继承、丰富、发展和创新的过程逐渐形成的。
腋芽萌发率=(腋芽萌发的外植体个数/存活的外植体个数) ×100%;
愈伤诱导率=(诱导出愈伤组织的外植体数/接种的外植体数)×100%;
愈伤分化率=(已分化的愈伤组织数/接种的愈伤组织数)×100%;
不定芽增殖倍数=增殖后的有效芽数/接种时的腋芽数;
生根率=(生根的幼苗数/接种幼苗总数)×100%。
数据处理采用Microsoft Excel 2003和SPSS 19.0软件进行方差分析及显著性分析。
2 结果与分析
2.1 不同外植体消毒时间的筛选
试验结果表明,不同消毒时间对不同外植体的污染率、褐化率及存活率影响存在差异(表1)。当茎段和带芽茎段在消毒时间为7 min时,其污染率较低,分别为16.67%和14.44%,存活率较高,分别为78.89%和84.45%,与其他两组消毒时间相比差异显著(P<0.05);叶片消毒5 min时,与消毒7 min相比,污染率和成活率差异不显著(P>0.05),但褐化率显著降低,与消毒3 min相比,其污染率显著降低,存活率有所提高。因此,茎段和带芽茎段最佳消毒时间为7 min,叶片最佳的消毒时间为5 min。

表1 次氯酸钠处理时间对铁线莲‘Blekitny Aniol’不同外植体的消毒效果的影响Table 1 Effect of different durations of sterilization on sterilization efficiency of different explants of ‘Blekitny Aniol’
表中数值是平均值±标准误。同列不同小写字母表示差异显著(P<0.05)。下表同。
Values are expressed as the mean±SE. Different lowercase letters within the same column indicate significant differences at the 0.05 level, similarly for the following tables.
2.2 不同激素浓度对带芽茎段腋芽萌发的影响
带芽茎段接种到初代培养基上,7 d后腋芽开始有不同程度的萌发(表2)。方差分析表明,不同浓度6-BA对带芽茎段腋芽诱导影响差异显著(P<0.05),NAA对其影响不显著(P>0.05)。随着6-BA浓度上升,诱导率随之上升,7、8、9号培养基平均腋芽数均较高,但植株长势不佳,新叶枯黄。在4号和5号培养基中,无菌苗生长健壮,叶片舒展(图1A),其中5号培养基萌发率最高。因此,最适宜带芽茎段腋芽萌发的初代培养基为MS+1 mg·L-16-BA+0.05 mg·L-1NAA。
2.3 愈伤组织诱导
2.3.1不同激素浓度对茎段愈伤组织诱导的影响 将茎段接种到不同培养基中,10 d后茎段两端膨大,呈哑铃状,开始形成愈伤组织。7号和8号培养基愈伤组织长势较好(图1B),诱导率较高,分别为78.3%和70.0%(表3)。说明高浓度的6-BA与低浓度的NAA组合使用有利于茎段诱导愈伤组织,随着NAA浓度上升,愈伤组织变得致密。根据植物生长调节剂浓度宜低不宜高的原则[11],诱导茎段愈伤组织的最适培养基为7号:MS+2 mg·L-16-BA+0.01 mg·L-1NAA。
2.3.2不同浓度激素对叶片愈伤组织的影响 叶片在培养基上培养5 d后,边缘卷曲加厚,切口处开始膨大,10~15 d时,大多数处理都产生了愈伤组织,少部分叶片出现褐化现象。高浓度的NAA(0.1 mg·L-1)和中浓度的6-BA(1 mg·L-1)组合使用时,诱导率最高为81.7%(表4)。该培养基(6号)与其他培养基之间存在显著差异(P<0.05),愈伤组织生长状况最佳(图1C)。因此,叶片诱导愈伤最适宜的培养基为6号:MS+1 mg·L-16-BA+0.1 mg·L-1NAA。
2.4 不同浓度激素对愈伤组织分化的影响
将由茎段和叶片诱导得到的长势良好的愈伤组织分别接种到分化培养基上,以1/2MS为基本培养基。大部分愈伤组织没有分化(表5),但出现了增殖现象(图1D),愈伤组织变得致密,内部出现空腔。多次继代后,只有在6号和9号培养基上分化出了不定芽,不定芽长势较好,叶片绿色(图1E、F),其中6号培养基的分化率较高。综上所述,诱导愈伤组织分化的最佳培养基为6号:1/2MS+3 mg·L-16-BA+0.05 mg·L-1NAA。
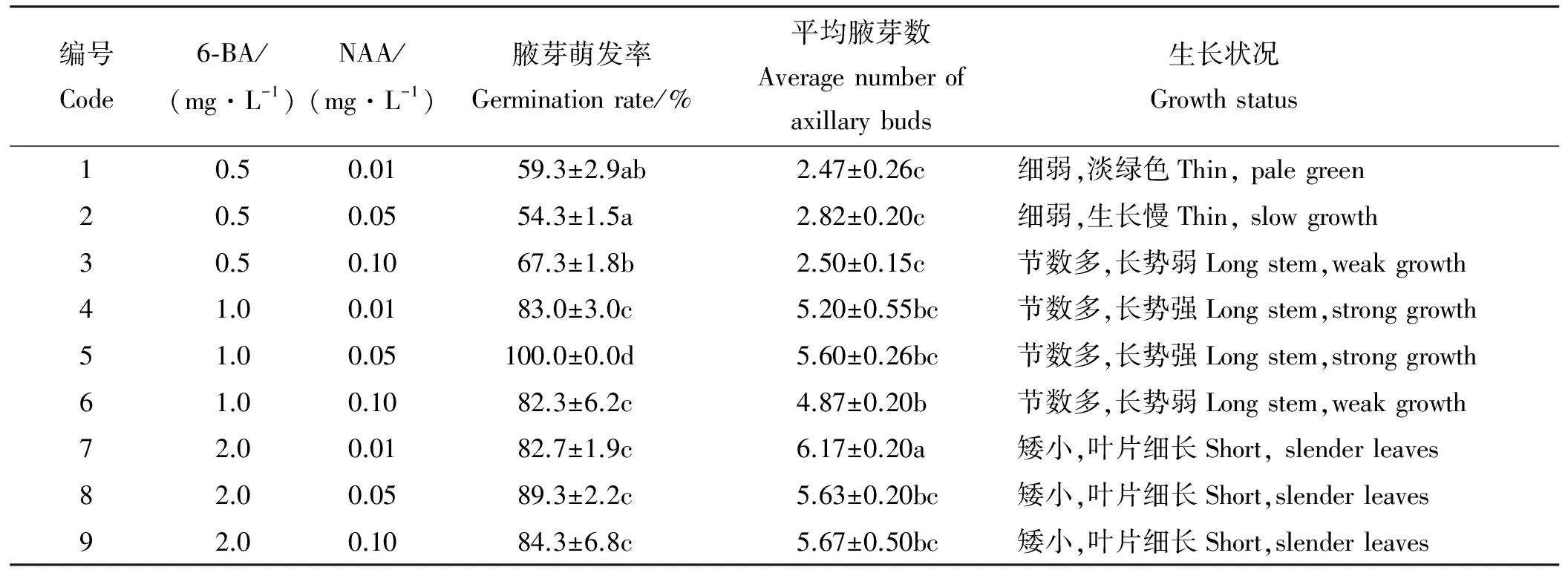
表2 不同激素配比对铁线莲‘Blekitny Aniol’带芽茎段诱导腋芽的影响Table 2 Effect of various hormone concentrations on callus induction from cotyledon node of ‘Blekitny Aniol’

表3 不同浓度激素对铁线莲‘Blekitny Aniol’茎段诱导愈伤组织的影响Table 3 Effect of various hormone concentrations on callus induction from stem of ‘Blekitny Aniol’

图1 铁线莲‘BlekitnyAniol’组织培养过程中不同时期的生长状态Fig. 1 Growth status of ‘Blekitny Aniolat’ different stages of tissue culture

表4 不同浓度激素对铁线莲‘Blekitny Aniol’叶片诱导愈伤的影响Table 4 Effect of various hormone concentrations on callus induction from leaf blade of ‘Blekitny Aniol’
2.5 芽的增殖培养
将愈伤组织分化而来的不定芽和带芽茎段直接诱导产生的腋芽接种到增殖培养基上,以1/2MS为基本培养基。15 d后开始有丛生芽萌发,20 d后丛生芽生长旺盛。可以看出, NAA浓度上升,有助于芽的增殖(表6)。2号培养基更适宜芽的增殖,增殖倍数达4.94,生长状态良好(图1G)。因此,最适宜芽增殖的培养基为1/2MS+3 mg·L-16-BA+0.1 mg·L-1NAA。

表5 不同浓度激素对铁线莲‘Blekitny Aniol’愈伤组织分化的影响Table 5 Effect of various hormone concentrations on callus differentiation of ‘Blekitny Aniol’

表6 不同浓度激素对铁线莲‘Blekitny Aniol’芽增殖的影响Table 6 Effect of various hormone concentrations on bud proliferation of ‘Blekitny Aniol’
2.6 不同培养基和植物生长调节剂组合对不定芽生根的影响
将高1~2 cm的不定芽转入生根培养基中,分别以MS和1/2MS为基本培养基,22 d后开始有新根产生。培养基类型和激素浓度对各项指标都有显著影响(P<0.05),1/2MS培养基明显优于MS培养基(表7)。以MS为基本培养基的3种处理中,当NAA浓度为0.05 mg·L-1时,3项指标分别达到最高;以1/2MS为基本培养基的3种处理中,低浓度的NAA有利于提高生根率和平均根长,根系生长健壮(图1H),但是对平均生根数有抑制作用。综合数据分析,最适宜的生根培养基组合为1/2MS+0.05 mg·L-1NAA。

表7 不同培养基和植物生长调节剂组合对铁线莲‘Blekitny Aniol’不定芽生根的影响Table 7 Effect of different culture media and combinations of plant growth regulators on rooting of adventitious buds of ‘Blekitny Aniol’
3 讨论与结论
铁线莲植株表面绒毛多,易附着病原菌,增加了消毒难度[12]。升汞是目前铁线莲组织培养中应用较广泛的消毒剂,但是通过预试验,升汞对外植体损伤较大,同时产生有毒废液,用后必须回收处理,因此选用次氯酸钠进行灭菌,效果较好,并且环保无污染。叶片消毒时间为5 min,茎段和带芽茎段消毒时间为7 min,需要分开处理。叶片长时间消毒,褐化率上升,但是对茎段和带芽茎段的影响不大,说明不同外植体对消毒剂的反应强度不同,本研究也发现叶片的薄厚、茎段的粗细会影响消毒效果,叶片较厚、茎段较粗的外植体污染率较低(数据未给出)。
植物激素的配比在组织培养中起着至关重要的调节作用,在一定浓度范围内,生长素和细胞分裂素的比值控制着植物形态建成的发展方向[13]。生长素和细胞分裂素的比值低时有助于芽的生长,比值高则有助于根的发生[14]。二者常用来诱导细胞脱分化,在本研究中,对于铁线莲的带芽茎段直接诱导腋芽,在培养基MS+1 mg·L-16-BA+0.05 mg·L-1NAA上腋芽萌发率最高为100%,而且苗节数多,叶色浓绿。因此是带芽茎段诱导腋芽最佳培养基,这和臧文静等[15]在杂交狼尾草(Pennisetumamericanum×P.purpureum)上的研究结果一致。在对铁线莲叶片和茎段进行愈伤组织诱导时发现,不同部位的外植体在不同培养条件下产生的愈伤组织生长状态存在显著差异(P<0.05),这可能跟外植体本身所包含的内源激素种类、浓度有关,也可能是不同外植体出愈能力有所区别[16]。对于茎段,较高浓度的6-BA结合较低浓度的NAA有助于愈伤组织的诱导,愈伤组织表面呈现颗粒状,颜色为黄绿色,质地疏松,当两种激素浓度均较高时,愈伤组织逐渐褐化,以茎段为外植体诱导愈伤组织最适宜培养基为MS+2 mg·L-16-BA+0.01 mg·L-1NAA。对于叶片,过高或者过低浓度的6-BA都不利于愈伤组织的诱导,叶片容易出现褐化现象,当6-BA浓度为1 mg·L-1时,配合着较高浓度的NAA可以产生疏松的愈伤组织,通过叶片诱导愈伤组织最适宜的培养基为MS+1 mg·L-16-BA+0.1 mg·L-1NAA。茎段和叶片诱导愈伤出现褐化的原因可能是由于组织细胞内次生代谢物质的积累对外植体产生了毒害作用,也可能与细胞内酚类物质化合物的含量活性有关[17-18]。通过缩短继代周期和添加0.1 g·L-1的活性炭,可以不同程度地降低褐化率,其中缩短继代周期防止褐化的效果相对较好。
在铁线莲愈伤组织分化过程中,较高浓度的6-BA有助于愈伤组织的分化,而较高浓度的NAA对愈伤组织的分化有一定的抑制作用,这也符合根芽形成的激素控制理论,这与董玉玲等[19]对木本油料作物美藤果(Plukenetiavolubilis)诱导不定芽的研究结论相似。高浓度的6-BA促进愈伤组织分化,但是随着浓度的增加,褐化率也有上升的趋势,可能是由于外源6-BA的积累并促进愈伤组织内部的激素合成,从而提高了内部激素的总体水平,激素间的比值发生变化[20-22]。降低NAA的浓度和缩短继代时间都可以不同程度的缓解褐化,继代时间缩短为15 d效果较显著(P<0.05)。分化培养基为1/2MS+3 mg·L-16-BA+0.05 mg·L-1NAA时,分化率最高为25%,出芽数为2.6。6个月后分化出不定芽,愈伤组织多呈现小块松散状,其余大部分愈伤组织形态呈绿色致密颗粒,部分表面有白点,内部出现空腔和导管等结构,丧失了分化能力,少部分逐渐褐化死亡。这与其他研究人员对铁线莲愈伤分化研究的结论相似,如Mandergara和Sieber[23]以C.interifolia×C.viticella的茎段为外植体通过18个月的培养获得了体细胞胚,随后在为期两年的观察中,体细胞胚有少部分分化出不定芽。目前,国内对于铁线莲通过愈伤途径分化不定芽的研究成果相对较少,张启香等[24]以栽培品种MultiBlue的茎尖为外植体进行培养获得了由愈伤组织分化的再生植株。在芽的增殖方面,本研究在1/2MS+3 mg·L-16-BA+0.1 mg·L-1NAA培养基上,增殖倍数高达4.94,芽明显变细长,植株生长健壮。
在生根培养中,基因型是影响植株再生的主要因素之一,里昂城铁线莲的生根率为93.33%,钝齿铁线莲的生根率为69.4%[25-26],本研究中Blekitny Aniol的生根率为70.2%。生根率不同主要与品种不同有关。在培养基类型比较时发现,1/2MS培养基中组培苗的各项根系指标均显著高于MS培养基(P<0.05),这与铁线莲Crystal Fountain和Gipsy Queen的研究结果相一致[7,27],但与薄叶铁线莲(C.gouriana)和全缘铁线莲(C.interifolia)×意大利铁线莲(C.viticella)的研究结果[28]有所不同,前者通过 MS作为唯一选用的培养基类型,得到完整植株,后者通过液体培养56 d也开始生根,可能是由于培养基中不同浓度的盐类成分对研究对象影响有差异[23-24],其中降低氮元素和提高磷元素对植株生根可能产生促进作用[29]。本研究表明,较低浓度的NAA有利于根的发生,但是会延长生根时间,当NAA浓度为0.5 mg·L-1时,接种22 d后开始生根,随之产生的愈伤组织较大,不利于后期移栽;当NAA为0.05 mg·L-1时,30 d后开始生根,虽然生根时间较晚,但是愈伤组织最小,生根率最高。因此,本研究认为培养基1/2MS+0.05 mg·L-1NAA最适合组培苗的生根培养。
References:
[1] Isnard S,Speck T,Rowe N P.Mechanical architecture and development in Clematis:Implications for canalised evolution of growth forms.New Phytologist,2003,158(3):543-559.
[2] 张鸽香,武珊珊.我国铁线莲属植物的研究现状及其园林应用方式.安徽农业科学,2010,38(22):12076-12078.
Zhang G X,Wu S S.Research status and garden application patterns ofClematisL. plants in China.Journal of Anhui AgriculturalScience,2010,38(22):12076-12078.(in Chinese)
[3] 王梅,徐正茹,张建旗,曹效东,刘乐乐,许宏刚,李文哲.遮阴对10种野生观赏植物生长及生理特性的影响.草业科学,2017,34(5):1008-1016.
Wang M,Xu Z R,Zhang J Q,Cao X D,Liu L L,Xu H G,Li W Z.Effect of shades on growth and physiological characteristics of 10 species of wild ornamental plants in Lanzhou.Pratacultural Science,2017,34(5):1008-1016.(in Chinese)
[4] 张燕,黎斌,李思锋.铁线莲属植物分类学及园艺学研究进展.中国野生植物资源,2010,29(5):6-10.
Zhang Y,Li B,Li S F.Advance of taxonomic and horticultural study ofClematis.Chinese Wild Plant Resources,2010,29(5):6-10.(in Chinese)
[5] Li R,Guo L X,Li Y,Chang W Q,Liu J Q,Liu L F,Xin G Z.Dose-response characteristics ofClematistriterpenoidsaponins and clematichinenoside AR in rheumatoid arthritis rats by liquid chromatography/mass spectrometry-based serum and urine metabolomics.Journal of Pharmaceutical and Biomedical Analysis,2017,136:81-91.
[6] 刘晶晶,高亦珂.北京地区野生铁线莲属植物种质资源调查研究.黑龙江农业科学,2013(4):65-69.
Liu J J,Gao Y K.Investigation on wild germplasm resources ofClematisin Beijing area.Heilongjiang Agricultural Sciences,2013(4):65-69.(in Chinese)
[7] 朱宏芬,施永泰,倪建刚,黄坚.盆栽铁线莲Crystal Fountain组织培养技术.浙江农业科学,2015,56(9):1440-1442.
Zhu H F,Shi Y T,Ni J G,Huang J.Tissue culture technology of Crystal Fountain.Journal of Zhejiang Agticultural Sciences,2015,56(9):1440-1442.(in Chinese)
[8] 张启香,方炎明,吕梅,陈娜.铁线莲‘Multi-Blue’不定芽及体细胞胚发生的初步研究.园艺学报,2007,34(2):465-468.
Zhang Q X,Fang Y M,Lyu M,Chen N.A preliminary study on induction of adventitious buds and embryogenesis inClematis‘Multi-Blue’.Acta Horticulturae Sinica,2007,34(2):465-468.(in Chinese)
[9] 袁迎燕,石大兴,王米力,任雅君,徐霞,汪静,郝玉立.毛蕊铁线莲的组织培养与植株再生.植物生理学通讯,2009,45(9):895.
Yuan Y Y,Shi D X,Wang M L,Ren Y J,Xu X,Wang J,Hao Y L.Tissue culture and plantlet regeneration ofClematislasiandraMaxim.Plant Physiology Communications,2009,45(9):895.(in Chinese)
[10] Mitrofanova I V,Galaev A V,Sivolap I M.Investigation of moleculargenetic heterogeneity ofClematisplants (ClematisL.) obtained by organogenesis and somatic embryogenesis in vitro.Tsitologiiai Genetika,2002,37(6):12-16.
[11] Wang X F,Wang C M,Zhang J L,Duan L J,Wang S M.Development of a plant regeneration system via tissue culture inPuccinelliatenuiflora.Acta Prataculturae Sinica,2014,23(6):355-360.
[12] 雷颖,任一杰,沈晓燕.松潘乌头嫩茎高效再生体系的建立.园艺学报,2015,42(7):1393-1399.
Lei Y,Ren Y J,Shen X Y.The establishment of the efficient regeneration system of the tender stems ofAconitumsungpanense.Acta Prataculturae Sinica,2015,42(7):1393-1399.(in Chinese)
[13] 李俊强,林利华,张帆,万雪琴,刘敏,赵景龙.早开堇菜组织培养及植株再生体系的建立.草业学报,2015,24(11):163-173.
Li J Q,Lin L H,Zhang F,Wang X Q,Liu M,Zhao J L.Tissue culture in vitro and plant regeneration ofViolaprionantha.Acta Pratsculturae Sinica,2015,24(11):163-173.(in Chinese)
[14] Dhiman M,Sharma V,Moitra S.Somatic embryogenesis and plant regeneration inEphedrafoliates(Boiss.):A non coniferous gymnosperm.Plant Tissue Culture and Biotechnology,2010,20(2):133-143.
[15] 臧文静,陈莹,李青,苟孝琴,武炳超,杨盛婷,张锐,张新全,黄琳凯.杂交狼尾草不同外植体愈伤组织诱导.草业科学,2015,32(9):1451-1456.
Zang W J,Chen Y,Li Q,Gou X Q,Wu B C,Yang S T,Zhang R,Zhang X Q,Huang L K.Tissue culture differentiation and callus induction of different explant fromPennisetumamericanum×P.purureum.Pratacultural Science,2015,32(9):1451-1456.(in Chinese)
[16] 许来俊,王成章,严学兵,张森浩,李佳.苜蓿植株再生体系研究进展.草业科学,2012,29(8):1294-1301.
Xu L J,Wang C Z,Yan X B,Zhang S H,Li J.Adances on research of regeneration system of alfalfa.Pratacultural Science,2012,29(8):1294-1301.(in Chinese)
[17] Parzymies M,Dabski M.The effect of cytokinin types and their concentration on invitromultiplication ofClematisviticella(L.) andClematisintegrifolia‘Petit Faucon’.Acta Scientiarum Polonorum,Hortorum Cultus,2012,11(1):81-91.
[18] 吕宗友,苏衍菁,赵国琦,邬彩霞.不同防褐化措施对苏丹草愈伤诱导以及抗褐化的效果研究.草业学报,2011,20(3):174-181.
Lyu Z Y,Su Y J,Zhao G Q,Wu C X.Effect of anti-browning agents on the induction of sudangrass callus.Acta Pratsculturae Sinica,2011,20(3):174-181.(in Chinese)
[19] 董玉玲,陈茂盛,王秀兰,牛龙见,付乾堂,徐增富.木本油料作物美藤果组织培养植株再生体系的建立.分子植物育种,2016,14(2):462-470.
Dong Y L,Chen M S,Wang X L,Niu L J,Fu Q T,Xu Z F.Esrablishment of in vitro regenerration system of woody oil cropPlukenetiavolubilis.Molecular Plant Breeding,2016,14(2):462-470.(in Chinese)
[20] 李伟丽,黄丽芳,夏新界.芡欧鼠尾草的组织培养和快速繁殖.草业科学,2016,33(3):393-399.
Li W L,Huang L F,Xia X J.Tissue culture and rapid propagation ofSalviahispanica.Pratacultural Science,2016,33(3):393-399.(in Chinese)
[21] Kikuchi A,Sanuki N,Higashi K,Koshiba T,Kamada H.Abscisic acid and stress treatment are essential for the acquisition of embryogenic competence by carrot somatic cells.Planta,2006,223(4):637-645.
[22] 李代丽.白刺愈伤组织培养中外源激素对内源激素影响的研究.北京:北京林业大学硕士学位论文,2007.
Li D L.The study of exogenous hormone effect on endogenous hormone in the callus tissue culture ofNitrariatangutorumBobr.Master Thesis.Beijing:Beijing Forestry University,2007.(in Chinese)
[23] Mandegaran Z,Sieber V K.Somatic embryogenesis inClematisintegrifolia×C.viticella.Plant Cell,Tissue and Organ Culture,2000,62(2):163-165.
[24] 张启香,胡恒康,方炎明.铁线莲品种‘Multi-Blue’不定根的诱导培养及其发生过程的解剖学观察.植物资源与环境学报,2010,19(1):80-85.
Zhang Q X,Hu H K,Fang Y M.Induction culture and anatomical observation of organogenesis of adventitious root of Clematis ’Multi-Blue’,2010,19(1):80-85.
[25] 魏淑云,陈建华,张荻,申晓辉.‘里昂城’铁线莲组培体系的建立.上海交通大学学报(农业科学版),2017,35(1):23-33.
Wei S Y,Chen J H,Zhang D,Shen X H.Establishment of regemeration system ofClematis‘Ville de Lyon’.Journal of Shanghai Jiaotong Universty (Agricultual Science),2017,35(1):23-33.(in Chinese)
[26] 吴红,李成忠,张成霞.钝齿铁线莲根尖组培再生体系的研究.云南农业大学学报(自然科学),2017,32(1):120-124.
Wu H,Li C Z,Zhang C X.Establishment of micropropagation system from root tip segment ofClematisapiifolia.Journal of Yunnan Agricultural University (Natural Science),2017,32(1):120-124.(in Chinese)
[27] 吴荣,林萍,樊国盛,王锦,陈泽英.铁线莲‘Gipsy Queen’组织培养与快速繁殖(简报).亚热带植物科学,2011,40(2):68-69.
Wu R,Lin P,Fan G S,Wang J,Chen Z Y.Tissue culture and rapid propagation ofClematis‘Gipsy Queen’.Subtropical Plant Science,2011,40(2):68-69.(in Chinese)
[28] Naika H R,Krishna V.Plant regeneration from callus culture ofClematisgourianaRoxb. a rare medicinal plant.Turkish Journal of Biology,2008,32(2):99-103.
[29] López-Bucio J,Cruz-Ramírez A,Herrera-Estrella L.The role of nutrient availability in regulating root architecture.Current Opinion in Plant Biology,2003,6(3):280-287.
