骆驼刺叶片形态和叶绿素荧光特性对不同潜水埋深的响应
2018-03-21曾凡江高欢欢李梅梅罗瀚林李世民中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室新疆乌鲁木齐830011新疆策勒荒漠草地生态系统国家野外科学观测研究站新疆策勒848300中国科学院干旱区地理与生物资源重点实验室新疆乌鲁木齐830011中国科学院大学北京100049
王 波,曾凡江,张 波,高欢欢,张 玲,李梅梅,罗瀚林,李世民(1.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,新疆 乌鲁木齐 830011; 2.新疆策勒荒漠草地生态系统国家野外科学观测研究站,新疆 策勒 848300;3.中国科学院干旱区地理与生物资源重点实验室,新疆 乌鲁木齐 830011; 4.中国科学院大学,北京 100049)
在荒漠区,由于降水稀少,植被主要依靠地下水维持自身的生长发育[1-2]。地下水埋深影响着土壤水分和盐分,而土壤水分和盐分则是影响植被生长和恢复的重要环境因子,因而植被的组成、分布及演替与地下水埋深之间关系密切[3-4]。相关研究表明,地下水埋深对植物种群多样性及演替有着显著影响[5];另有研究表明,羊草(Leymuschinensis)的净光合速率和蒸腾速率随潜水埋深增加而升高[6]。塔克拉玛干沙漠南缘的策勒绿洲-荒漠过渡带是遏制荒漠化的天然屏障,过渡带中的天然植被更是在防风固沙、维护绿洲生态安全方面发挥着重要作用,然而由于该地区降水稀少,仅依靠地表水远远无法满足植物的生存用水,在这一独特的生存环境中,地下水的生态调控作用则显得尤为重要[7]。
骆驼刺(Alhagisparsifolia)是一种多年生豆科木质化草本植物,主要生长于荒漠、半荒漠区。在塔克拉玛干沙漠南缘的绿洲-荒漠过渡带广泛分布,是该地的优势植物种之一,也是该地最重要的景观植被之一[8-9]。骆驼刺因其耐干旱、耐盐碱的特点,在过渡带内发挥着防风固沙的重要作用,是维护绿洲生态安全的主要植物之一,具有重要的生态价值[10]。此外,骆驼刺含有丰富的蛋白质,被当地居民用作牲畜的饲草,在当地畜牧业的发展中发挥着重要的作用,具有重要的经济价值[8,10-11]。研究发现,骆驼刺的根系直达地下水,且其主要的水分和养分均来自于地下水[12-13]。然而,随着策勒绿洲人口的不断增加,工农业活动日益频繁,地下水的开采及利用量直线上升,地下潜水埋深不断下降,导致骆驼刺的生境明显旱化、沙化,加之当地民众的过度放牧和采伐,骆驼刺遭到大面积的破坏,出现显著的衰退现象,亟待加强保护。但针对骆驼刺与水分的关系已有研究,主要集中在灌溉对骆驼刺生物量分配、光合生理、形态可塑性的影响以及人工控制下骆驼刺幼苗光合生理、根系分布对潜水埋深的响应[14-15],对自然生骆驼刺与潜水埋深之间关系的研究则涉及较少。
因此,本研究选取自然环境中不同潜水埋深(2.5、4.5、11.0 m)骆驼刺植被,研究不同潜水埋深对骆驼刺叶片形态、叶绿素含量及叶绿素荧光的影响,以期揭示自然生骆驼刺叶片形态及叶绿素荧光特性与潜水埋深之间的关系,为绿洲-过渡带中自然生骆驼刺的保护及生态恢复提供理论参考。
1 材料和方法
1.1 研究区概况
研究区位于塔克拉玛干沙漠南缘的新疆策勒荒漠草地生态系统国家野外科学观测研究站西侧的绿洲-荒漠过渡带上,地处37°00′33″-37°01′18″ N,80°42′13″-80°42′29″ E。该区属典型内陆暖温带荒漠气候,年平均气温11.9 ℃,最高气温达41.9 ℃,最低气温-23.9 ℃。年均降水量仅为35.1 mm,但年均蒸发量却可以达到2 595.3 mm,干燥度20.8。5月和7月降水次数相对较多,但降水量很少。常年多风,年均风速1.9 m·s-1。光热资源丰富,平均日照时数2 697.5 h,年太阳总辐射能604.2 kJ·cm-2,但光能利用率较低,仅为0.3%。植被稀疏,以疏叶骆驼刺、花花柴(Kareliniacaspia)、多枝柽柳(Tamarixramosissima)等灌木和小灌木为主,植物盖度仅为5%~20%。
1.2 材料和方法
试验材料是策勒绿洲-荒漠过渡带中自然生长的不同潜水埋深(2.5、4.5、11.0 m)骆驼刺,每个潜水埋深条件下随机选取3株长势基本一致、健康无病虫害的成熟骆驼刺植株。2016年9月中旬选择晴朗无云的天气,在选取的每株骆驼刺上选择向阳面完全展开的成熟叶片进行叶绿素荧光的测定,每株测定3个重复。从上述叶片中采样并装入自封袋,然后立即放入恒温箱保存,带回实验室,用蒸馏水冲洗干净,用滤纸吸去水分,用于叶绿素含量和叶形态指标测定。
叶片形态指标的测定:随机选取50枚叶片,用于形态指标的测定。首先用扫描仪(1 600 lx,上海中晶科技有限公司)对叶片进行扫描,之后在Image-Pro Plus 6.0软件中计算50枚叶片的总面积,用总面积除以50作为单叶面积。将测过叶面积的叶片以10枚一组用精度为0.01 mm的游标卡尺进行叶片厚度测量,待50枚叶片的总厚度测出后,除以50求得单叶厚度。将测量后的叶片放入烘箱在80 ℃下烘干至恒重,用1/10 000的天平称其干重。根据公式计算比叶面积和叶组织密度[16]:叶体积=叶面积×叶片厚度,比叶面积=叶面积/干重,叶组织密度=干重/叶体积。每个潜水埋深设6个重复。
叶绿素含量的测定:随机选取带回叶片其中的一部分用剪刀去除叶片中脉后剪碎混合均匀,称取0.2 g,加入石英砂和碳酸钙粉及95%乙醇研磨过滤,测定吸光度,吸光度波长分别为665、649 nm,之后计算叶绿素a、叶绿素b及叶绿素(a+b)含量[17]。每个潜水埋深设5个重复。
叶绿素荧光动力学参数的测定:根据Strasser等[18]的方法,利用PEA连续激发式荧光仪(Hansatech Ltd.,King’s Lynn,Northfolk,UC)测定叶绿素荧光诱导曲线及其参数。测定时间设在北京时间13:00,首先使叶片暗适应20 min,之后用3 000 μmol·(m2·s)-1饱和红闪光照射记录荧光信号,测得相关指标。
1.3 数据分析
采用SPSS 22.0统计软件分析不同潜水埋深条件下骆驼刺叶片形态特征、光合色素、荧光动力学参数之间的差异,首先对各参数进行方差齐次性检验,然后进行单因素方差分析(One-way ANOVA)。采用Turkey进行多重比较(P<0.05为差异显著,P<0.01为差异极显著),并用Pearson相关分析法分析叶片形态性状间相关关系,参数以平均值±标准差(mean±SD)表示。数据的计算和绘图分别采用Microsoft Excel 2007和Origin 8.5完成。
2 结果与分析
2.1 不同潜水埋深下骆驼刺叶片形态特征的变化
随潜水埋深的增加,骆驼刺叶片面积随之增大,4.5 m潜水埋深下的叶片面积较2.5 m潜水埋深增加22%,11.0 m潜水埋深下的叶片面积较4.5 m潜水埋深增加14%,较2.5 m潜水埋深增加39%,且各潜水埋深间的差异显著(P<0.05)(图1);而叶片厚度则随潜水埋深的增加呈先减小后增加的变化趋势,4.5 m潜水埋深下的叶片厚度较2.5 m潜水埋深减小18%(P<0.05),11.0 m潜水埋深下的叶片厚度较4.5 m潜水埋深增加15%(P<0.05),较2.5 m潜水埋深减小5%(P>0.05);比叶面积的变化趋势则与叶片厚度的变化趋势相反,随潜水埋深的增加,比叶面积先增大后减小,4.5 m潜水埋深下的比叶面积较2.5 m潜水埋深增加15%(P<0.05),11.0 m潜水埋深下的比叶面积较4.5 m潜水埋深减小12% (P<0.05),较2.5 m潜水埋深减小1%(P>0.05);随潜水埋深的增加,叶组织密度虽然也先增大后减小,但各潜水埋深间无显著差异(P>0.05)。
叶片厚度与比叶面积和组织密度均呈极显著的负相关关系(P<0.01),而叶面积与叶片厚度、比叶面积和组织密度之间则无显著的相关关系(P>0.05),比叶面积与组织密度之间也无显著的相关关系(P>0.05)(表1)。

图1 不同潜水埋深下骆驼刺叶片形态特征Fig. 1 Characteristics of leaf morphology in A. sparsifolia shrubs growing in soils where the groundwater table is found at varying depths
不同字母表示不同潜水埋深间差异显著(P<0.05)。下同。
Different lowercase letters indicate significant difference among different groundwater depths at the 0.05 level; similarly for the following figures.

表1 骆驼刺叶片形态性状之间的相关关系Table 1 Correlations among leaf morphology parameters of A. sparsifolia shrubs growing in soils with varying depths to the groundwater table
**P<0.01.
2.2 不同潜水埋深下骆驼刺叶片叶绿素含量的变化
不同潜水埋深条件下,骆驼刺叶片的叶绿素含量也不一样(图2)。在4.5 m潜水埋深下,叶绿素b的含量较2.5 m潜水埋深增加14%(P<0.05),叶绿素a、叶绿素(a+b)的含量较2.5 m潜水埋深分别增加10%、11%,但无显著差异(P>0.05),叶绿素a/b较2.5 m潜水埋深减小4%(P>0.05);当潜水埋深增加到11.0 m时,叶绿素a、叶绿素b和叶绿素(a+b)的含量较4.5 m潜水埋深分别增加17%、32%和21%,均差异显著(P<0.05),较2.5 m潜水埋深分别增加29%、51%和35%,也均差异显著(P<0.05),叶绿素a/b较4.5 m潜水埋深减小10%(P>0.05),较2.5 m潜水埋深减小14%(P<0.05)。
2.3 不同潜水埋深下骆驼刺PSⅡ原初光化学效率和Fo等参数的变化
3种不同潜水埋深条件下骆驼刺的初始荧光Fo无显著差异(P>0.05),最大荧光Fm、PSⅡ潜在活性Fv/Fo及PSⅡ最大光化学效率Fv/Fm在2.5和4.5 m潜水埋深条件下也无显著差异(P>0.05)(表2)。但在11.0 m潜水埋深条件下,最大荧光Fm和PSⅡ潜在活性Fv/Fo较4.5 m潜水埋深分别升高17%和34%,差异显著(P<0.05),较2.5 m潜水埋深分别升高14%和24%,差异显著(P<0.05),PSⅡ最大光化学效率Fv/Fm较4.5 m潜水埋深升高9% (P<0.05),较2.5 m潜水埋深升高7%,无显著差异(P>0.05)。
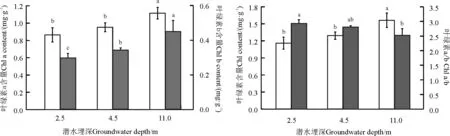
图2 不同潜水埋深条件下骆驼刺叶片叶绿素含量Fig. 2 Chlorophyll content of A. sparsifolia shrubs growing in soils where the groundwater table is found at varying depths

表2 不同潜水埋深条件下骆驼刺PSⅡ原初光化学效率和初始荧光等参数的变化Table 2 Changes in chlorophyll fluorescence parameters in A. sparsifolia shrubs growing in soils with varying depths to the groundwater table
同列中不同字母表示不同潜水埋深间差异显著(P<0.05)。
Different lowercase letters within the same column indicate significant difference among different groundwater depths at the 0.05 level.
3 讨论
3.1 不同潜水埋深下骆驼刺叶片形态特征的变化
叶片作为植物与环境接触面积最大的器官,其功能性状与植物生物量、生长策略和资源的获取、利用密切相关,可以反映植物适应环境变化的生存对策[19-20]。已有研究表明,植物叶面积能够反映植物在适应生存环境变化时的生存对策,在受到干旱胁迫时叶面积减小,水分充足时则较大[21];叶片厚度能够反映植物叶片中生物量的累积状况,在水分条件较好的区域,叶片较薄,随环境水分含量的降低,叶片逐渐增厚[22-23];比叶面积可以反映植物生存环境的状况,在水分条件较好、资源丰富的环境中,比叶面积较高,在降水量少、蒸发量大、土地贫瘠的环境中,比叶面积较小[24-25]。
本研究中所用的骆驼刺为自然生长在策勒绿洲-荒漠过渡带中的成熟植株,根系已经下扎到水分充足的土壤层,即使地下水位较深,骆驼刺也不会受到干旱胁迫[26]。而且随着潜水埋深的增加,骆驼刺的根系下扎深度更大,促进了根系的生长发育,从而导致骆驼刺对碳水化合物的消耗量及合成量也随潜水埋深的增加而增加。本研究中,骆驼刺的叶片面积随着潜水埋深的增加而增大,证明潜水埋深的增加可能并未对骆驼刺造成干旱胁迫,而且叶片面积的增大可以加大叶片与阳光的接触面积,进而提高叶片对光能的捕获能力,以满足地下水埋深较深时骆驼刺的生理需求[14],这与彭守兰等[10]研究结果不太一致,可能是其试验所用材料为骆驼刺幼苗,幼苗生长前期根系并未接触到地下水,而且试验中地下水埋深设置较本研究浅,骆驼刺的生长发育更易受土壤含水量的影响;此外,本研究中,叶片厚度随潜水埋深先减小后增加,叶片厚度的增加则可以使叶片的光合速率升高,进一步证明11 m潜水埋深下骆驼刺的光合作用强于4.5 m潜水埋深下骆驼刺的光合作用,而2.5 m潜水埋深下骆驼刺的叶片厚度大于4.5 m潜水埋深下的叶片厚度,可能是由于采样前的一段时间雨水较多,加之2.5 m地下水位又较浅,导致在蒸发作用下地表积累了过多的盐分,盐分胁迫影响了骆驼刺的生长发育,使2.5 m潜水埋深下骆驼刺的叶片变厚[27];本研究中,比叶面积随潜水埋深的增加呈先增加后减小的趋势,表明11.0 m潜水埋深下骆驼刺对资源的获取能力强于4.5 m潜水埋深下的骆驼刺,而2.5 m潜水埋深下骆驼刺比叶面积小于4.5 m潜水埋深下骆驼刺的比叶面积,可能也是盐分胁迫所导致的[27]。本研究还表明,叶片厚度与比叶面积和组织密度皆呈极显著的负相关关系(P<0.01),而且随潜水埋深的增加,叶片厚度先减小后增大,比叶面积和叶组织密度则均是先增大后减小,叶片厚度与比叶面积和组织密度随潜水埋深的变化趋势是相反的,说明在适应潜水埋深变化的过程中,骆驼刺的叶片厚度与比叶面积和组织密度是协同变化的。
3.2 不同潜水埋深下骆驼刺叶片叶绿素含量的变化
叶绿素是植物进行光合作用所需的重要功能分子,其中叶绿素a、叶绿素b都是植物用来捕获光能的重要光合色素,叶绿素a/b则可以反映捕光色素复合体Ⅱ(LHCⅡ)在含有叶绿素的结构中的比重[28]。已有研究表明,叶片光合能力与叶绿素含量之间具有显著的正相关关系[29-31]。此外,叶绿素含量的变化可以反映植物生存环境的变化,研究表明,干旱胁迫或土壤含水量过高都会使植物的叶绿素含量减小[32-34]。
本研究中,叶绿素含量随潜水埋深的增加而增加,叶绿素a/b随潜水埋深的增加而减小,说明潜水埋深的增加未对骆驼刺造成干旱胁迫,叶绿素含量的增加增强了骆驼刺叶片对光能的捕获能力,使其光合速率随潜水埋深的增加而提高,从而满足了骆驼刺随潜水埋深增加而产生的高合成高消耗的生理需求。张晓蕾等[14]研究也表明,潜水埋深的增加可提高骆驼刺叶片的净光合速率。但潜水埋深由2.5 m增加到4.5 m时,叶绿素a和叶绿素a/b的变化都不显著(P>0.05),只有叶绿素b显著增加(P<0.05),这表明在此变化过程中,潜水埋深的变化对叶绿素b的影响最大,骆驼刺主要通过增加叶绿素b的含量来捕获更多的光能以适应潜水埋深的增加;而当潜水埋深增加到11.0 m时,叶绿素a、叶绿素b和叶绿素(a+b)的含量都随之显著增加(P<0.05),叶绿素a/b则继续减小,表明在11.0 m潜水埋深条件下,骆驼刺不仅通过增加叶绿素b的含量来提高叶片的光合能力,更主要的是通过叶绿素a和叶绿素b的共同作用来使叶片的光合能力大幅提高。总之,潜水埋深的变化会对骆驼刺叶片叶绿素含量造成影响,潜水埋深的增加会引起叶片中叶绿素含量的增加,而且潜水埋深增加的深度不同对叶绿素含量的影响强度也不同,深度越大对叶绿素含量的影响越大。
3.3 不同潜水埋深下骆驼刺PSⅡ原初光化学效率和Fo等荧光参数的变化特征
叶绿素荧光含有丰富的光合作用信息,通过对各荧光动力学参数的分析可知植物在光合作用过程中利用光能的情况,因此测定植物叶绿素荧光已经成为了探测植物光合作用变化情况的重要手段[35]。荧光参数Fo、Fm、Fv/Fo、Fv/Fm分别表示初始荧光、最大荧光、PSⅡ潜在活性、PSⅡ最大光化学效率,研究表明,在受到环境胁迫时,PSⅡ结构会遭到破坏,PSⅡ活性会下降,表现为Fo升高,Fm、Fv/Fo、Fv/Fm下降[36-37]。
本研究中,潜水埋深由2.5 m增加到4.5 m时,Fo、Fm、Fv/Fo及Fv/Fm均未发生显著变化(P>0.05),而当潜水埋深增加到11.0 m时,Fm、Fv/Fo和Fv/Fm都随之显著增加(P<0.05),表明在11.0 m潜水埋深条件下,骆驼刺叶片的光合能力强于其在2.5和4.5 m潜水埋深条件下的光合能力,同时也表明与11.0 m潜水埋深条件相比,2.5 m潜水埋深及4.5 m潜水埋深生境在一定程度上对PSⅡ的结构造成了破坏,降低了PSⅡ的活性,抑制了光合原初反应过程,阻碍了电子在PSⅡ中的传递。Fm、Fv/Fo和Fv/Fm对潜水埋深变化的响应说明潜水埋深增加到11.0 m对骆驼刺叶片的叶绿素荧光特性产生了显著的影响,增强了骆驼刺叶片的光合能力。
4 结论
骆驼刺的叶面积、叶片厚度、比叶面积、叶绿素含量、Fm、Fv/Fo、Fv/Fm与潜水埋深之间具有较好的相关性。随着潜水埋深的变化,骆驼刺可以通过调控自身的叶片形态、叶绿素含量及叶绿素荧光特征适应不同的潜水埋深,潜水埋深由2.5 m增加到4.5 m时,骆驼刺主要通过改变叶片形态和叶绿素b的含量适应潜水埋深的变化,当潜水埋深由4.5 m增加到11.0 m时,骆驼刺不仅通过改变叶片形态和叶绿素b的含量适应潜水埋深的这种变化,同时还对叶绿素a的含量、Fm、Fv/Fo和Fv/Fm进行调控以适应11.0 m的潜水埋深。
本研究结果不仅可以为研究自然生长的骆驼刺叶片形态、叶绿素含量和叶绿素荧光与潜水埋深之间的关系提供一定的理论依据,还可以为策勒绿洲-荒漠过渡带中骆驼刺的保护和恢复工作提供科学参考。
References:
[1] 赵文智,刘鹄.荒漠区植被对地下水埋深响应研究进展.生态学报,2006,26(8):2702-2708.
Zhao W Z,Liu H.Recent advances in desert vegetation response to groundwater table changes.Acta Ecologica Sinica,2006,26(8):2702-2708.(in Chinese)
[2] Synder K A,William D G.Water resources used by riparian trees varies among stream types on the Pedro River,Arizonsa.Agricultural & Forest Metrology,2000,105(1-3):227-240.
[3] 樊自立,陈亚宁,李和平,马英杰,艾里西尔·库尔班,阿布都米吉提.中国西北干旱区生态地下水埋深适宜深度的确定.干旱区资源与环境,2008,22(2):1-5.
Fan Z L,Chen Y N,Li H P,Ma Y J,Alishir·Kurban,Abdiijit.Determ ination of suitable ecological groundwater depth in arid areas in northwest part of China.Journal of Aril Land Resources and Environment,2008,22(2):1-5.(in Chinese)
[4] 郝兴明,李卫红,陈亚宁.新疆塔里木河下游荒漠河岸(林)植被合理生态水位.植物生态学报,2008,32(4):838-847.
Hao X M,Li W H,Chen Y N.Water table and the desert riparian forest community in the lower reaches of tarim river,China.Chinese Journal of Plant Ecology,2008,32(4):838-847.(in Chinese)
[5] 冯文娟,徐力刚,王晓龙,李海英,姜加虎.鄱阳湖洲滩湿地地下水位对灰化薹草种群的影响.生态学报,2016,36(16):5109-5115.
Feng W J,Xu L G,Wang X L,Li H Y,Jiang J H.Response ofCarexcinerascenspopulations to groundwater level gradients in the Poyang Lake wetland.Acta Ecologica Sinica,2016,36(16):5109-5115.(in Chinese)
[6] 杨帆,安丰华,杨洪涛,王志春.松嫩平原苏打盐渍土区不同潜水埋深下羊草的光合特征.生态学报,2016,36(6):1519-1598.
Yang F,An F H,Yang H T,Wang Z C.Characteristics of leaf photosynthesis inLeymuschinensisgrown in saline-sodic soil area of the Songnen Plain,at different groundwater depths.Acta Ecologica Sinica,2016,36(6):1519-1598.(in Chinese)
[7] 樊自立.塔里木盆地绿洲形成与演变.地理学报,1993,48(5):421-427.
Fan Z L.A study on the formation and evolution of oases in Tarim Basin.Acta Geographica Sinica,1993,48(5):421-427.(in Chinese)
[8] 曾凡江,张希明,李小明.骆驼刺植被及其资源保护与开发的意义.干旱区地理,2002,25(3):286-288.
Zeng F J,Zhang X M,Li X M.Study on the characteristics ofAlhagisparsifoliaand its impact on resovrce protection and development.Arid Land Geography,2002,25(3):286-288.(in Chinese)
[9] 张晓蕾,曾凡江,刘波,刘镇,安桂香,孙旭伟.不同土壤水分处理对疏叶骆驼刺幼苗光合特性及干物质积累的影响.干旱区研究,2010,27(4):649-655.
Zhang X L,Zeng F J,Liu B,Liu Z,An G X,Sun X W.Effects of different soil moisture treatments on the photosynthesis and dry matter accumulation ofAlhagisparsifoliaseedlings.Arid Zone Research,2010,27(4):649-655.(in Chinese)
[10] 彭守兰,曾凡江,王会提,郭京衡,高欢欢,罗维成,宋聪.潜水埋深对疏叶骆驼刺(Alhagisparsifolia)幼苗生长和叶片形态的影响.中国沙漠,2014,34(2):396-404.
Peng S L,Zeng F J,Wang H T,Guo J H,Gao H H,Luo W C,Song C.Effects of water table depth on leaf morphology and growth ofAlhagisparsifoliaseedlings.Journal of Desert Research,2014,34(2):396-404.(in Chinese)
[11] Thomas F M,Arndt S K,Bruelheide H,Foetzki A,Gries D,Huang J,Popp M,Wang G,Zhang X M,Runge M.Ecological basis for a sustainable management of the indigenous vegetation in a Central-Asian desert:Presentation and first result.Journal of Applied Botany,2000,74(5):212-219.
[12] Arndt S K,Kahmen A,Arampatsis C,Adams M.Nitrogen fixation and metabolism by groundwater-dependent perennial plants in a hyperarid desert.Oecologia,2004,141(3):385-394.
[13] Zeng F J,Bleby T M,Landman P A,Adama M A,Arndt S K.Water and nutrient dynamics in surface roots and soils are not modified by short-term flooding of phreatophytic plants in a hyperarid desert.Plant and Soil,2006,279(1):129-139.
[14] 张晓蕾,曾凡江,刘波,张慧,刘镇,安桂香.不同地下水埋深下骆驼刺幼苗叶片生理参数光响应特性.干旱区地理,2011,34(2):229-235.
Zhang X L,Zeng F J,Liu B,Zhang H,Liu Z,An G X.Light response of leaf physiological parameters ofAlhagisparsifoliaShap. under different groundwater depths.Arid Land Geography,2011,34(2):229-235.(in Chinese)
[15] 张利刚,曾凡江,袁娜,刘波,罗维成,宋聪,彭守兰.不同水分条件下疏叶骆驼刺(Alhagisparifolia)生长及根系分株构型特征.中国沙漠,2013,33(3):717-723.
Zhang L G,Zeng F J,Yuan N,Liu B,Luo W C,Song C,Peng S L.Root growth and ramets architecture characteristics ofAlhagisparsifoliaunder different water treatments.Journal of Desert Research,2013,33(3):717-723.(in Chinese)
[16] 施宇,温仲明,龚时慧.黄土丘陵区植物叶片与细根功能性状关系及其变化.生态学报,2011,31(22):6805-6814.
Shi Y,Wen Z M,Gong S H.Comparisons of relationships between leaf and fine root traits in hilly area of the Loess Plateau,Yanhe River basin,Shaanxi Province,China.Acta Ecologica Sinica,2011,31(22):6805-6814.(in Chinese)
[17] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:137.
Li H S.Principles and Techniques of Plant Physiological Biochemical Experiment.Beijing:Higher Education Press,2000:137.(in Chinese)
[18] Strasser R J,Srivastava A,Tsimilli-Michael M.The fluorescence transient as a tool to characterize and screen photosynthetic samples.//In:Yunus M,Pathre U,Mohanty P.(eds).Probing Photosynthesis:Mechanism,Regulation and Adaptation (Chapter 25).London:Taylor and Francis Press,2000:443-480.
[19] 宝乐,刘艳红.东灵山地区不同森林群落叶功能性状比较.生态学报,2009,29(7):3692-3703.
Bao L,Liu Y H.Comparison of leaf functional traits in different forest communities in Mt. Dongling of Beijing.Acta Ecologica Sinica,2009,29(7):3692-3703.(in Chinese)
[20] 高景,王金牛,徐波,谢雨,贺俊东,吴彦.不同雪被厚度下典型高山草地早春植物叶片性状、株高及生物量分配的研究.植物生态学报,2016,40(8):775-787.
Gao J,Wang J N,Xu B,Xie Y,He J D,Wu Y.Plant leaf traits,height and biomass partitioning in typical ephemerals under different levels of snow cover thickness in an alpine meadow.Chinese Journal of Plant Ecology,2016,40(8):775-787.(in Chinese)
[21] Wright I J,Reich P B,Westoby M.Strategy shifts in leaf physiology,structure and nutrient content between species of high- and low-rainfall and high- and low-nutrient habitats.Functional Ecology,2001,15(4):423-434.
[22] Witkowski E T,Lamont B B.Leaf specific mass confounds leaf density and thickness.Oecologia,1991,88(4):486-493.
[23] 龚时慧,温仲明,施宇.延河流域植物群落功能性状对环境梯度的响应.生态学报,2011,31(20):6088-6097.
Gong S H,Wen Z M,Shi Y.The response of community-weighted mean plant functional traits to environmental gradients in Yanhe river catchment.Acta Ecologica Sinica,2011,31(20):6088-6097.(in Chinese)
[24] Cornelissen J H C,Lavorel S,Garnier E, Diaz S,Buchmann N,Gurvich D E,Reich P B,Steege H,Morgan H D,Heijden M G A,Pausas J G,Poorter H.A handbook of protocols for standardised and easy measurement of plant functional traits worldwide.Australian Journal of Botany,2003,51(4):335-380.
[25] Zhao H Y,Li Y L,Wang X Y,Mao W,Zhao X Y,Zhang T H.Variations in leaf traits of 52 plants in Horqin sand land.Journal of Desert Research,2010,30(6):1292-1298.
[26] 曾凡江,郭海峰,刘波,曾杰,张晓蕾.疏叶骆驼刺幼苗根系生态学特性对水分处理的响应.干旱区研究,2009,26(6):852-858.
Zeng F J,Guo H F,Liu B,Zeng J,Zhang X L.Response of ecological properties of roots ofAlhagisparsifoliaShap. seedlings to different irrigation treatments.Arid Zone Research,2009,26(6):852-858.(in Chinese)
[27] 赵生龙,曾凡江,张波,刘波,高欢欢,罗瀚林.盐分胁迫对骆驼刺幼苗叶片性状的影响.草业科学,2016,33(9):1770-1778.
Zhao S L,Zeng F J,Zhang B,Liu B,Gao H H,Luo H L.Effects of salt stress on leaf traits ofAlhagisparsifolia.Pratacultural Science,2016,33(9):1770-1778.(in Chinese)
[28] Anderson J M,Aro E M.Grana stacking and protection of photosystem Ⅱ in thylakoid membranes of higher plant leaves under sustained high irradiance:A hypothesis.Photosynthesis Research,1994,41(2):315-326.
[29] Efeoglu B,Ekmekci Y,Cicek N.Physiological responses of three maize cultivars to drought stress and recovery.South African Journal of Botany,2009,75(2):34 -42.
[30] Souza B D,Meiaso M V,Rodrigues B M.Water relation and and chlorophyll fluorescence responses of two leguminous trees from the Caatinga to different watering regimes.Acta Physiologiae Plantarum,2010,32(2):235-244.
[31] 孙金伟,吴家兵,任亮,张冠华,任斐鹏,姚付启.氮添加对长白山阔叶红松林2种树木幼苗光合生理生态特征的影响.生态学报,2016,36(21):6777-6785.
Sun J W,Wu J B,Ren L,Zhang G H,Ren F P,Yao F Q.Response of photosynthetic physiological characteristics to nitrogen addition by seedlings of two dominant tree species in a broadleaved-Korean pine mixed forest on Changbai Mountain.Acta Ecologica Sinica,2016,36(21):6777-6785.(in Chinese)
[32] 张彦妮,雷蕾,夏斌.干旱胁迫及复水对黄莲花幼苗生长和生理特征的影响.草业科学,2016,33(9):1681-1689.
Zhang Y N,Lei L,Xia B.Effects of drought stress and rewatering on seedling growth and physiological characteristics ofLysimachiadavurica.Pratacultural Science,2016,33(9):1681-1689.(in Chinese)
[33] 姚春娟,郭圣茂,马英超,赖晓莲,杨肖华.干旱胁迫对4种决明属植物光合作用和叶绿素荧光特性的影响.草业科学,2017,34(9):1880-1888.
Yao C J,Guo S M,Ma Y C,Lai X L,Yang X H.Effect of drought stress on characteristics of photosynthesis and chlorophyll fluorescence of four species ofCassia.Pratacultural Science,2017,34(9):1880-1888.(in Chinese)
[34] 曾成城,陈锦平,王振夏,贾中民,魏虹.狗牙根生长及叶绿素荧光对水分和种植密度的响应.草业科学,2015,32(7):1107-1115.
Zeng C C,Chen J P,Wang Z X,Jia Z M,Wei H.Response of growth and chlorophyll fluorescence characteristics ofCynodondactylonseedlings to water treatment and plant densities.Pratacultural Science,2015,32(7):1107-1115.(in Chinese)
[35] 张静,张元明.冻融过程对生物结皮中齿肋赤藓叶绿素荧光的影响.中国沙漠,2011,31(6):1479-1487.
Zhang J,Zhang Y M.Effects of freezing and thawing on chlorophyll fluorescence ofSyntrichiacaninervisin biological soil crusts.Journal of Desert Research,2011,31(6):1479-1487.(in Chinese)
[36] 郭瑞,周际,杨帆,李峰,李昊如,夏旭,刘琪.拔节孕穗期小麦干旱胁迫下生长代谢变化规律.植物生态学报,2016,40(12):1319-1327.
Guo R,Zhou J,Yang F,Li F,Li H R,Xia X,Liu Q.Growth metabolism of wheat under drought stress at the jointing-booting stage.Chinese Journal of Plant Ecology,2016,40(12):1319-1327.(in Chinese)
[37] Wang M,Gao Z K,Huang R H,Wang H Y,Zhang W L,Gao R F.Heat stress characteristics of photosystem Ⅱ in eggplant.Chinese Journal of Applied Ecology,2007,18(1):63-68.
