DNA微阵列芯片法检测耐药结核分枝杆菌的价值探讨
2018-03-21何建
何 建
2010年全国第五次结核病流行病学抽样调查报告显示我国肺结核患者的耐药情况较严重。与2000年调查结果相比,异烟肼(isoniazid, INH)的耐药率增加了11.0个百分点,利福平(rifampin,RFP)的耐药率减少了7.7个百分点,对结核分枝杆菌分离菌株的总耐多药率为6.8%,虽然下降了3.9个百分点,但仍高于全球的平均水平[1]。如此高的耐药率突显耐多药防控的必要性、紧迫性。耐药结核病的控制包括患者发现、治疗、管理等各过程。其中耐药结核病患者的发现是控制耐药结核病的第一环节。既往检测耐多药的经典药物敏感试验为比例法或绝对浓度法,但检测时间过长。WHO现推荐采用快速耐药结核病诊断技术以利于该类患者的早期发现。宜昌市第三人民医院自2014年5月起采用DNA微阵列芯片法进行结核病的INH、RFP耐药快速检测,并与传统药物敏感试验作比较,以了解该方法对耐药结核菌检测的应用价值。
1 材料与方法
1.1 标本来源 收集本院2014年5月1日—2015年5月31日结核分枝杆菌痰涂片阳性或痰结核培养阳性标本。其中痰涂片阳性标本125份,痰培养阳性标本40份。
1.2 痰菌检查 采用萋尔-尼尔逊(ziehl-neelsen,Z-N)抗酸染色法进行痰涂片检查。
1.3 痰结核分枝杆菌培养及药物敏感试验 结核分枝杆菌培养采用改良罗氏培养基,采用对硝基苯甲酸生长实验进行初步菌种鉴定,对鉴定为结核分枝杆菌的菌株采用绝对浓度法进行分枝杆菌药物敏感试验。试验方法依据中国防痨协会2006版《结核病诊断实验室检验规程》[2]进行。
1.4 DNA微阵列芯片法检测 DNA微阵列芯片法采用北京博奥生物有限公司药物敏感检测试剂盒进行检测,操作严格按照说明书进行。
1.4.1 核酸提取 向核酸提取管中加入80 μl核酸提取液,加入用无菌接种环挑取的培养阳性的1个菌落或涂片阳性的痰液,使用Extractor 36核酸快速提取仪震荡5 min,90 ℃水浴5 min,5000 rpm离心1 min,所提取核酸于-20 ℃暂存。
1.4.2 PCR扩增 每个样品设3个复孔进行扩增反应。分别取PCR扩增试剂1、2、3 各18 μl均加入 200 μl离心管中(3管),将核酸提取管中的上清液(包含待检样品DNA)2 μl依次加入到3个管中,并置于PCR扩增仪中,按说明书中的热循环程序进行PCR扩增。其中PCR扩增试剂1、2、3扩增的分别是分枝杆菌属探针序列(扩增产物1),rpoB基因突变位点序列(扩增产物2),katG和inhA基因突变位点序列(扩增产物3)。PCR引物序列由中国博奥生物有限公司提供[3]。
1.4.3 芯片杂交 将杂交缓冲液加热至50 ℃使其完全融化,混匀后各取9 μl分别装于2管中,将PCR产物1、PCR产物2各取3 μl加入上述装有杂交缓冲液的管中配制杂交混合物R;将PCR产物1、PCR产物3各取3 μl配制杂交混合物H;将杂交反应混合物加热至95 ℃变性5 min,冰浴3 min。吸取13.5 μl杂交混合物加入加样孔,微阵列1或3加入杂交混合物R,微阵列2加入杂交混合物H,盖上杂交盒并密封放入50 ℃恒温水浴锅中,时间为120 min。
1.4.4 芯片洗涤及干燥 将杂交盒拆开,将芯片取出放入盛有芯片洗涤液Ⅰ的容器中,并在恒温摇床上振荡,速度为80~100 rpm,洗涤3 min。再用芯片洗涤液Ⅱ在恒温摇床上振荡,速度为80~100 rpm,洗涤3 min。然后将芯片置于离心机中进行离心,转速为800 rpm,时间为5 min,甩干后扫描。
1.4.5 芯片扫描和结果判读 使用微阵列芯片扫描仪(Luxscan 10K-B)和相应软件进行信号读取及结果判读。
1.5 统计学处理 用CHISS 2004软件对数据进行统计学分析。在本研究中,金标准为传统药物敏感试验,以检测菌株表型耐药为真阳性,以检测菌株表型敏感为真阴性。分析DNA微阵列芯片法检测的灵敏度、特异度及一致性。2种方法检出率的差异性检验用配对四格表χ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 DNA微阵列芯片法检测INH耐药性 2种方法检测INH耐药结果见表1,配对χ2=0.500,P=0.480,表明2种方法检出率具有一致性,一致率为98.8%。以传统药物敏感试验绝对浓度法为金标准,DNA微阵列芯片法检测INH的灵敏度为87.5%,特异度为100%。
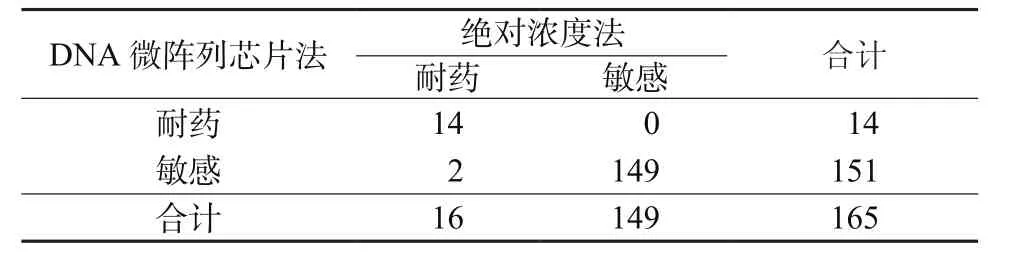
表1 2种方法检测INH耐药结果(例)Table 1 Results of INH resistance by 2 methods(cases)
2.2 DNA微阵列芯片法检测RFP耐药性 2种方法检测RFP耐药结果见表2,配对χ2=0.000,P=1.000,表明2种方法检出率具有一致性,一致率为99.4%。以传统药物敏感试验绝对浓度法为金标准,DNA微阵列芯片法检测RFP的灵敏度为83.3%,特异度为100%。
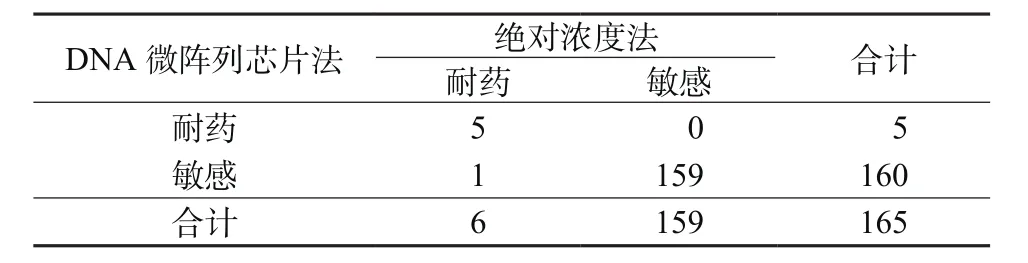
表2 2种方法检测RFP耐药结果(例)Table 2 Results of RFP resistance by 2 methods(cases)
2.3 DNA微阵列芯片法检测耐多药性 2种方法检测耐多药结果见表3,配对χ2=0.000,P=1.000,表明2种方法检出率具有一致性,一致率为100%。以传统药物敏感试验绝对浓度法为金标准,DNA微阵列芯片法检测耐多药的灵敏度为100%,特异度为100%。
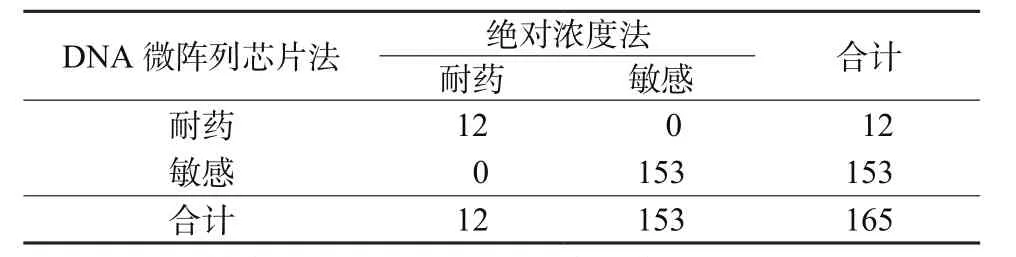
表3 2种方法检测耐多药耐药结果(例)Table 3 Results of multi drug resistance by 2 methods(cases)
3 讨 论
传统的药物敏感性方法是以固体培养为基础的绝对浓度法或比例法,但需较长时间。一般从患者就诊到获得药物敏感结果需要2~3个月[4]。采用液体培养法,如MGIT960系统,可将药物敏感试验时间缩短至2~4周,但仍不能满足临床需要[5]。因此,快速、简便的耐药检测方法一直是结核病研究的重要内容之一,也是及时治疗以保证结核病治疗效果的重要前提。
目前热门的快速检测方法主要是分子生物学检测方法。现只有该种方法能在2 d得到耐药检测结果。WHO也推荐采用分子生物学技术中的线性探针和Xpert MDR/RIF技术用于耐药结核病的检测[6]。DNA微阵列芯片技术与线性探针相似,都是通过检测2种抗结核一线药物INH和RFP的3个耐药基因katG、inhA和rpoB启动子的野生型及不同突变型来判断是否耐药[7]。主要技术特点是根据这3个耐药基因的特异性保守核酸序列,设计PCR扩增引物及相应的寡核苷酸探针,固定在芯片表面上,经与针对性的扩增被检测样本的 DNA片段杂交,并通过芯片扫描仪扫描杂交后的芯片上特定位置的荧光信号,从而检测出样品的耐药基因信息。该检测方法可在6 h内得到结果[8]。
本研究表明,DNA微阵列芯片法诊断INH耐药的敏感度为87.5%,诊断RFP耐药的敏感度为83.3%,诊断耐多药的敏感度为100%,三者特异度均为100%。DNA微阵列芯片法与传统药物敏感试验诊断INH耐药、RFP耐药、耐多药的一致率为98.8%~100%。显示了DNA微阵列芯片检测技术具有较高的敏感度和特异度,与传统药物敏感方法相比,一致性较高。因此,具有较好的可靠性及较高的检测效能。
本研究的不足之处是敏感的样本较少,使检验效能偏低,影响检验结果的可信度。后续有待进一步扩大样本量,进行检测并比较分析以得出更为准确的结论。
在本研究中,2例INH单耐药和1例RFP单耐药未被DNA微阵列芯片法检出,原因可能有以下两方面。首先,商品化DNA微阵列芯片试剂盒受检测探针的限制,所检测的耐药基因及相应位点不能覆盖目前已知的所有耐药基因及相应位点。例如:①结核分枝杆菌对INH的耐药与katG、inhA、kasA、ndh、ahpC 5种基因突变或缺失有关,其中80%以上的耐INH分离株与katG和inhA基因发生突变有关[9-10]。而目前采用的结核分枝杆菌耐药检测试剂盒主要通过检测INH耐药相关基因katG 315、inhA及位点来判断是否耐药。因此,如果是另外3种基因位点突变引起的耐药,可能该试剂盒无法检出。②结核分枝杆菌对 RFP的耐药主要与RNA聚合酶亚单位rpoB基因的突变有关,是否与RNA 聚合酶亚单位其他3 个基因rpoA、rpoC 或rpoZ 突变相关目前尚不清楚。廖小琴等[11]分析发现57株耐RFP结核分枝杆菌中有50株为rpoB基因突变,2株为rpoC突变。并且在rpoB 765、1001、1156位及rpoC 51位发现新的突变位点。而所使用的结核分枝杆菌耐药检测试剂盒探针检测范围仅为RFP耐药相关基因rpoB的531、526、513、516、511、533位共6个位点。因此,若为探针检测范围之外的其他相关基因(如rpoC或rpoB)的位点突变,则该检测试剂盒可能无法检出。
其次,在实际检测过程中,如果待检标本痰菌量太少或含有杂质,会造成核酸提取、扩增失败。因此,研发新的能覆盖所有已知耐INH、RFP相关基因及位点检测的试剂盒可能是进一步提高DNA微阵列芯片法耐药检测技术阳性率的方法之一。
总之,本研究对DNA微阵列芯片法检测耐药结核菌的效果作了初步评价,发现该检测方法具有较高的敏感度和特异度,与传统药物敏感试验相比具有较好的一致率。而且该方法可靠性较好且检测所需时间短,可以作为临床结核病耐药性的快速筛查方法。
[1]全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室. 2010年全国第五次结核病流行病学抽样调查报告[J]. 中国防痨杂志,2012,34(8):485-508.
[2]中国防痨协会基础专业委员会.结核病诊断实验室检验规程[M]. 北京:中国教育文化出版社,2006:13-65.
[3]周杨,欧喜超,乐军,等. 基因芯片诊断耐多药结核病的临床多中心研究 [ J ]. 中华检验医学杂志,2011,34(9):793-799.
[4]王心静,王仲元. 结核病实验室诊断新技术的临床应用[J].传染病信息,2014,27(6):373-376.
[5]蒋俊,张娟,张红,等. MGIT960系统行二线抗结核药物敏感性试验的实用性评价[J].中国防痨杂志,2012,34(8):527-531.
[6]世界卫生组织. 耐药结核病规划管理指南2011年更新版 [M].日内瓦:世界卫生组织,2011:3-7.
[7]王升启. 分子诊断技术在传染病病原体检测中的应用[J]. 传染病信息,2014,27(5):266-269.
[8]Guo Y, Zhou Y, Wang C, et al. Rapid, accurate determination of multidrug resistance in M. tuberculosis isolates and sputum using a biochip system[J]. Int J Tuberc Lung Dis, 2009, 13(7):914-920.
[9]Donstdar F, Khosravi AD, Farissa P, et al. Molecular analysis of isoniazid resistance in different genotypes of Mycobacterium tuberculosis isolates from iran[J]. Microb Drug Resist, 2008,14(4):273-279.
[10]Jiao WW, Mokrousov I, Sun GZ, et al. Molecular characteristics of rifampin and isoniazid resistant Mycobacterium tuberculosis strains from Beijing, China[J]. Chin Med J (Engl) , 2007, 120(9):814-819.
[11]廖小琴,刘梅,彭章丽,等. 耐利福平结核分枝杆菌 rpoA、rpoB、rpoC和 rpoZ 突变的研究[J]. 中华临床医师杂志,2013,7(22):9874-9878.
