酶法替代碱法提取琼脂生产技术开发
2018-03-21翁惠芬安风
翁惠芬, ,,, ,,,安风
(1.福建省绿麒食品胶体有限公司,福建 漳州 363100;2.集美大学食品与生物工程学院,福建 厦门 361021;3.福建省海藻多糖企业工程技术研究中心,福建 漳州 363100;4.福建省海洋功能食品工程技术研究中心,福建 厦门 361021)
0 引言
琼脂又名琼胶,是从石花菜(Gelidiumamansii)、江蓠(Gracilariaverrucosa)、鸡毛菜(Pterocladiaetenuis)等红藻中提取出来的一种天然多糖,是由琼脂糖和琼脂胶两部分组成[1],其中琼脂糖是由1,3-β-D-半乳糖和1,4-3,6内醚-ɑ-L-半乳糖结合成的链状中性多糖。琼脂具有凝胶、增稠和稳定性能,含有丰富的矿物质元素、多糖和膳食纤维,广泛应用于食品、轻工、日化、医药等领域中。目前,全世界琼脂的生产原料约60%来源于江蓠菜属,而在我国约80%来自江蓠菜属[2]。
琼脂的提取主要采用碱提法,常见的有低温高碱、中温高碱和高温稀碱3种。前2种碱提法温度适中,对琼脂造成的损失较少,但是因碱处理时间较长,碱用量大,清洗用水较多,在能耗和环保方面,企业负担较重。高温稀碱提取法碱用量较少,处理时间较短,清洗用水较少,相对其他两种方法,对环境压力较小,且产品品质较高,但因处理温度较高,容易造成胶质流失,影响产品得率,因此对工艺的控制要求较高。
目前企业多采用高温稀碱法提取琼脂,但随着琼脂需求量的日渐增长,高温稀碱工艺的能耗大、污水处理负担重等成本劣势日益凸显。因此,寻求一种高效、节能的绿色生产工艺,对琼脂产业化生产具有重要意义。王维香等[3]通过复合酶解法从裙带菜(Undariapinnatifida)中提取了硫酸多糖,确定了最佳工艺条件,硫酸多糖提取率为7.76%。赵谋明等[4]利用复合纤维素酶处理沙菜(Hypneaspinella),很大程度提高了卡拉胶的产率,虽然对卡拉胶的硬度和脆性影响不大,但对其凝胶强度略有影响。
酶法提取海藻多糖已经显示出其巨大的优势,可有效减少提取工艺过程中碱的用量,是一种绿色环保的生产工艺。但是,酶法提取海藻多糖工艺十分复杂,提取过程中需要对酶的种类及配比、酶加入量、提取温度、料水比、酶反应pH值、酶反应时间等多个因素进行深入研究。因此,到目前为止,酶法提取海藻多糖尚处在实验室研究阶段,无法实现工业化推广应用。本实验室分别采用纤维素酶辅助碱法工艺和完全酶法工艺提取江蓠琼脂,结果发现,纤维素酶促进细胞壁纤维素的分解,有利于琼脂胶质溶出,提高了产品得率;琼脂硫酸酯酶可有效脱除琼脂的硫酸基团,提高琼脂的凝胶强度[5-6]。在此基础上,本文拟以琼脂凝胶强度为考察指标,通过单因素试验优化及中试放大试验,优化生物酶法提取琼脂的工艺。该工艺替代碱法提取琼脂生产工艺,可有效减少工业用碱和清洗用水的使用量,是一种前景可期的提胶工艺。
1 材料与方法
1.1 材料与试剂
江蓠菜(Gracilarialemaneiformis)由绿新(福建)食品有限公司提供;纤维素酶(酶活力23 500 U/g)购自江苏锐阳生物科技有限公司;琼脂硫酸酯酶(酶活力251.9 U/mL)由本实验室发酵制备,来自假交替单胞菌Pseudoalteromonascarrageenovora,该菌株保藏于中国工业微生物菌种保藏管理中心,编号23819。
实验所用试剂均为分析纯,其中浓硫酸、草酸、无水亚硫酸钠、乙二胺四乙酸二钠、酒石酸钾钠、浓盐酸、硫酸钾、一水合柠檬酸、氢氧化钠、十二水合磷酸氢二钠购自国药集团化学试剂有限公司,三羟甲基氨基甲烷(Tris)购自北京索莱宝科技有限公司,次氯酸钠、草酸、羧甲基纤维素钠(CMC-Na)、3,5-二硝基水杨酸(DNS)、苯酚购自西陇化工股份有限公司。
1.2 高温稀碱法提取琼脂工艺
称取清洗烘干至恒重江蓠50 g,加入800 mL水,在90 ℃的条件下,于质量分数为7%碱溶液中处理3 h,用自来水冲洗至中性。再依次加入质量分数0.1%硫酸、0.015% EDTA-Na2、0.015%草酸浸泡1 h,清洗至中性。用有效氯质量分数为0.04%的次氯酸钠溶液漂白1 h,水洗至中性。加入原料15~20倍水进行煮胶,压榨得到胶液,凝固,切块,冻融,干燥。
1.3 酶法辅助提取江蓠琼脂工艺流程
酶法辅助提取江蓠琼脂工艺的具体流程如下:
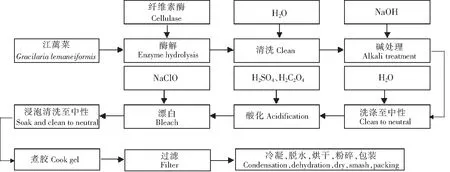
1.4 复合酶法提取江蓠琼脂工艺流程
复合酶法提取江蓠琼脂工艺的具体流程如下:

1.5 实验方法
1.5.1 纤维素酶活力测定
参照文献[7],取4支25 mL具塞试管,分别加入2.0 mL CMC-Na溶液,其中3支加入已稀释的待测酶液0.5 mL,另一支作空白。将试管放置于50 ℃水浴中反应30 min后,分别加入3.0 mL DNS溶液,在空白管加入0.5 mL已稀释的待测酶液,沸水浴中处理10 min后定容至25 mL,以空白管调零,在540 nm处测定吸光度值。在以上条件下,1 min水解底物产生1 μg葡萄糖的酶量为1个酶活力单位。计算公式为:酶活力(U·g-1)=A×(1/0.5)×n×(1/30)×1000,其中,A为吸光度在标准曲线上的还原糖量(mg);1/0.5为换算成1 mL的酶液;n为酶液稀释倍数;1/30为换算成1 min;1000为单位换算系数。
1.5.2 琼脂硫酸酯酶粗酶液酶活力测定
参照文献[8]并进行适当调整,反应体系包括80 μL 20 mmol/L对硝基苯硫酸钾(p-NPS)(以50 mmol/L pH值7.0的Tris-HCl缓冲液配制),20 μL酶液(稀释20倍),50 ℃下反应10 min后,加入25 μL 1 mol/L NaOH终止反应,加入预冷蒸馏水875 μL,在410 nm下测定吸光度值,以灭活酶的反应体系作对照。琼脂硫酸酯酶的活力(U)定义为:在上述条件下,每分钟催化生成1 μg对硝基苯酚(p-NP)所需的酶量。
1.5.3 凝胶强度的测定
参照GB 1975—2010方法测定凝胶强度,配制质量分数1.5%的琼胶溶液,等量倒入2个100 mL烧杯中,冷却,待凝胶形成后,盖上表面皿,室温放置15 h后,在凝胶强度测定仪上测定凝胶强度[9]。凝胶强度以质量分数1.5%琼胶(干基计)凝胶在15 ~20 s内抗破法码的质量(g)与装置杆下端的表面积(cm2)比值表示,单位为g·cm-2。
1.5.4 透明度的测定
配制质量分数为1%的琼胶溶液,趁热(高于95 ℃)倒入比色皿中,室温放置24 h,用紫外分光光度计在400~800 nm 间扫描,确定最大吸收波长700 nm,在最大吸收波长处测定样品的透光率(T)[10]。
1.5.5 融化温度和凝固温度的测定
参照文献[11],配制质量分数1.5%琼脂溶液,取10.0 mL装入试管中,室温下冷却过夜,在凝胶上放一个小玻璃珠,将试管置于30 ℃水浴中水浴10 min后,再以1 ℃/min的速度升温,当小球珠下落时,此时的温度即为融化温度。
配制质量分数1.5%琼脂溶液,室温下凝固,测定装置同融化温度测定装置,待试管内凝胶凝固即倾斜试管时,凝胶能保持形体不变,抽出温度计,凝胶表面不变形,此时的温度即为凝固温度。
1.5.6 硫酸根含量的测定
参照文献[12],称取0.05 g干燥至恒重的琼胶于锥形瓶中,加入25 mL 1 mol/L的盐酸,在105 ℃的条件下消化4~5 h。待样品冷却后,加蒸馏水定容至25 mL,活性炭脱色后过滤并取1 mL上清液于试管中,然后加入3 mL 质量分数1%的吐温-BaCl2溶液,振荡混匀,静置10 min,在360 nm下测定吸光度值,根据所作硫酸根标准曲线方程(y= 3.338 1x-0.006 3,R2= 0.999 1)换算出硫酸根含量。
1.5.7 琼胶得率的测定
琼胶得率/%=m琼脂×(1-水分含量)×100/[m江蓠×(1-水分含量)],式中:m江蓠为没有经过预处理的江蓠质量;m琼脂为琼脂质量。其中水分含量测定参考GB 5009.3—2016[13]进行。
2 结果与分析
2.1 酶法辅助提取琼脂工艺
2.1.1 酶解反应单因素结果与分析
碱质量分数是影响琼脂提取率和凝胶强度的主要因素。江蓠通过碱处理后能减少影响凝胶强度的硫酸基团含量。不同碱质量分数对琼脂产品凝胶强度的影响效果如图1a所示,可见,对酶降解后的江蓠进行碱处理,随着碱用量的增加,琼脂的凝胶强度明显升高,在碱质量分数为5%处达到最大值,继续增加碱用量将使凝胶强度降低。因为江蓠经过酶处理之后,纤维素酶作用于藻体,使藻体致密的细胞壁破裂,原来与纤维素结合的胶质溶出,较高质量分数的碱处理加剧了对琼脂的裂解。
在固定碱质量分数和碱处理温度条件下,江蓠经酶处理后琼脂凝胶强度随碱处理时间的变化情况如图1b所示,可见,随着碱处理时间的延长,琼脂凝胶强度不断增大,处理时间为2.5 h时达到最大。这可能是由于江蓠碱处理时间越长,硫酸基去除越彻底,琼脂凝胶强度随碱处理时间的延长而增强;而随着江蓠进行碱处理时间的再延长,所提取琼脂的凝胶强度却逐渐下降,可能是因为经过酶处理后的江蓠,其部分胶质已溶出。当经过长时间的碱处理,藻体再次发生胶溶现象,导致胶体大量流入碱液而造成损失,并且在试验中也发现,碱处理时间越长,胶体自溶、流失也越严重,琼脂的产率越低。
酶量的添加对体系的酶活力和江蓠菜的作用程度具有直接影响,结果如图1c所示,可见,随着酶用量的增加,琼胶凝胶强度明显增加,这是由于结构致密的细胞壁逐渐被纤维素酶水解,利于琼胶的溶出。再经过一段时间的碱处理后,溶出的胶脱除了硫酸基使得凝胶强度增高。随着酶用量的增加,溶出的胶也随之增多,增大了碱对胶结构破坏的机会。另外,由于纤维素酶作用底物专一性不强,可能切断琼胶1~4键,使凝胶强度下降。而且,纤维素酶作用后,纤维素类物质溶解度大大增加,这些杂质的溶入会影响多糖高分子结构的形成。
酶水解过程中酶及底物均易受到体系pH值的影响。不同酶处理pH值对琼脂提取效果的影响如图1d所示。可见,在较高酸度条件下,琼脂的凝胶强度较低,可能是由于江蓠藻体致密的细胞壁被破坏从而达到软化,再经过高温碱处理后,胶质大量溶出而被碱破坏,且在这一阶段溶出的胶也将随水洗而流失。因此,江蓠酶处理时应尽量选择在中性条件下进行,这样对琼脂分子结构不会造成破坏,对凝胶强度影响小。
酶处理时间的长短直接影响到底物的降解程度及水解产物的种类,酶的稳定性及酶活力随反应时间的变化情况如图1e所示。可见,琼脂的凝胶强度随着酶处理时间的延长呈现先上升后下降的趋势,因为超过一定的作用时间后,纤维素酶开始作用于胶质分子从而引起凝胶强度的下降。另外,江蓠经过长时间酶处理,细胞壁破坏过大,在碱处理时容易对胶进行降解从而影响琼脂的凝胶强度。因此,必须控制适宜的酶处理时间。
酶处理温度与酶水解速度密切相关。由图1f可知,酶处理温度对琼脂凝胶强度有显著影响,随着温度的升高,酶分子热运动加快,增加了酶与江蓠细胞壁纤维素的碰撞,使江蓠细胞壁受到破坏,在进行碱处理时,有利于碱的溶入进而易于硫酸基的脱除。但考虑到酶处理温度过高会使酶蛋白变性,影响酶活力,不仅影响产品得率和品质,而且会使酶无法重复利用,造成酶的浪费。因此,选择合适的酶处理温度对酶法辅助提取有重要的意义,根据单因素试验结果将酶解温度设定为45 ℃。
2.1.2 碱质量分数降至3%对小试优化工艺的影响
通过上述对酶法辅助提取琼脂的小试工艺进行优化可以发现,江蓠经酶处理后再进行碱处理可显著减少碱的用量。但对于琼脂生产企业来说,如果能够利用酶法进一步减少碱的用量甚至利用酶法完全取代碱法工艺,将为企业的可持续发展创造更为优良的条件。在上述优化工艺的基础上,对碱质量分数进一步降低,固定碱质量分数为3%,酶处理温度为45 ℃,对工艺条件中的加酶量、酶处理时间、碱处理时间再进一步优化。
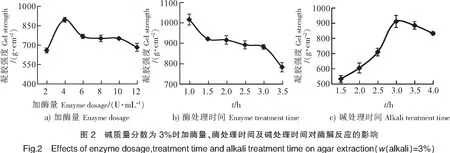
在碱质量分数降至3%后再对江蓠进行酶处理,随着酶用量的增加,琼脂的凝胶强度呈现上升的趋势,在加酶量达到4 U/mL时,凝胶强度达到最大895.5 g/cm2。随着酶用量的进一步增加,凝胶强度开始下降,在加酶量为6~8 U/mL这一阶段变化趋势较小,可能是因为纤维素降解后生成的还原糖对酶的作用产生了抑制。因此,选择最适加酶量为4 U/mL(见图2a)。
在酶处理时间为1 h时,提取的琼脂凝胶强度达到最大值1017.0 g/cm2。由于琼脂生产企业对琼胶提取的规模较大,在各个工艺排水的阶段耗时比较长,如果酶处理反应的时间太短,将不利于生产上的实际操作。因此,选择最适酶处理时间为1 h(见图2b)。
随着碱处理时间的延长,琼脂凝胶强度不断增大,在处理时间为3 h时达到最大,这可能是由于江蓠碱处理时间越长,硫酸基去除越彻底。而随着江蓠进行碱处理时间的延长,琼脂的凝胶强度逐渐下降,但下降趋势较为缓慢,可能是因为经过长时间的碱处理,琼脂的结构被慢慢破坏,藻体也随之发生了胶溶的现象。因此,选择最适碱处理时间为3 h(见图2c)。

2.1.3 酶法辅助提取琼脂小试工艺验证
在上述优化条件下,即:碱质量分数3%、碱处理时间2.5 h、加酶量4 U/mL、酶处理时间2.5 h、酶处理温度45 ℃、酶处理pH 值7.0的条件下进行小试验证试验,以确认小试工艺的稳定性,试验结果见表1。表1中,碱法为采用碱质量分数为7%的处理工艺提取,酶法辅助对照为没有经过酶预处理直接采用质量分数为3%的碱处理工艺提取。

表1 酶法辅助提取工艺琼脂指标测定结果
由表1可知,经酶处理后,碱质量分数降至3%,在此工艺条件下,酶法的产率要略高于碱法,而且凝胶强度要高于碱法。影响凝胶强度的因素有很多,包括硫酸基及羰基含量、单糖组成、相对分子质量大小、分子的立体结构等[14]。从测得的硫酸基含量可知,酶法所提琼胶的硫酸基含量要低于碱法,可解释酶法凝胶强度要高于碱法。此外,二者在凝固温度、融化温度及透明度间区别不明显,凝固温度和融化温度的变化与琼胶化学性质相关,也受到相对分子质量大小及分布的影响[15]。其中,融化温度主要受相对分子质量大小的影响,随着相对分子质量的增加而升高[16]。
2.2 复合酶处理江蓠海藻的条件优化
酶法辅助提取琼脂工艺经过优化,碱质量分数由原来的7%减少到3%。但提取过程中还是会排放含有较高质量分数碱的废水,对环境保护也会造成一定的压力。江蓠琼脂提取过程中,碱的作用一方面是破坏细胞壁,有利于胶质溶出,另一方面是脱除琼脂分子上的硫酸基团,使其凝胶强度提高。因此,试验采取复合酶的方法,加入纤维素酶破坏江蓠的细胞壁,并加入本实验室发酵得到的琼脂硫酸酯酶脱除琼脂分子的硫酸基团,提高琼脂分子的凝胶强度,从而达到完全替代碱的目的。酶法工艺提取琼脂过程复杂,影响因素较多,如酶解温度、时间、pH值、用量等都会影响酶解程度,间接影响了所提取到的琼脂的品质和产率。因此,本试验采用单因素试验的方法,对复合酶法提取琼脂生产工艺进行了优化。
2.2.1 酶法提取琼脂单因素试验优化
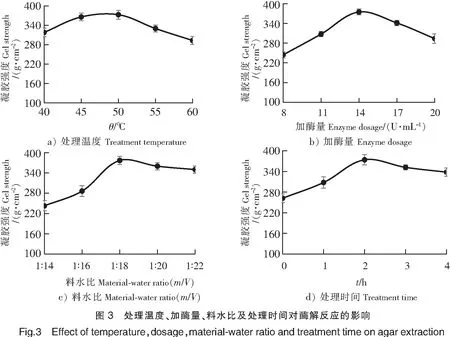
温度是影响酶催化反应的重要因素,复合酶法提取琼脂工艺随酶处理温度的变化情况如图3a所示,可见,复合酶的酶解温度在50 ℃时,琼脂的凝胶强度达到最大值373 g·cm-2。应该是纤维素酶在最适温度下达到最佳酶活力,充分破坏江蓠藻细胞壁,使琼脂硫酸酯酶充分进入藻体细胞与硫酸基团作用,从而脱除硫酸基,提高凝胶强度。在60 ℃时,由于温度较高,直接影响了复合酶的活力,因此凝胶强度较低。基于上述结果,选取50 ℃为复合酶处理江蓠海藻的温度。
在一定的原料基础上,适量的纤维素酶用量不仅保证了纤维素的分解效率,同时也避免了对琼脂分子的破坏。由图3b可知,当体系中纤维素酶单位活力在8~14 U/mL时,随着纤维素酶含量的增加,琼脂的凝胶强度逐渐增加,并在单位活力为14 U/mL时,达到最大值375 g·cm-2。这是因为在合适的纤维素酶活力下,江蓠藻细胞壁的纤维素被充分水解,胶质溶出,在硫酸酯酶的作用下,硫酸基被脱除,从而提高了凝胶强度。随着纤维素酶单位活力的提高,胶质大量溶出,在后续的酸化和漂白作用下,琼脂分子部分被破坏,导致凝胶强度的下降。基于上述结果,选择纤维素酶的单位活力为14 U/mL。
料水比影响酶和江篱藻的接触面积,从而影响反应的速率。称取洗净并烘干至恒重的江蓠50.0 g,在纤维素酶和琼脂硫酸酯酶的用量不变的情况下,研究体系料水比对琼脂品质的影响(见图3c)。可见,当料水比(m/V)在1∶14~1∶18之间时,琼脂的凝胶强度呈现逐渐上升趋势,并在1∶18时达到最大值。因为当体系水量足够时,可以增大纤维素酶与江篱藻的接触面积,加快反应速率,利于胶质溶出,与琼脂硫酸酯酶充分作用。当料水比继续增加时,由于体系水量增大,纤维素酶的单位活力下降,影响了反应速率。因此,当料水比大于1∶18时,琼脂的凝胶强度略微降低。基于上述结果,选择1∶18作为复合酶处理江蓠藻的体系料水比。
处理时间直接影响到酶解程度,进而影响到琼脂的品质。由图3d可知,随着处理时间的延长,琼脂的凝胶强度呈现先上升后下降的趋势,在处理2 h时,达到最大凝胶强度。因为适宜的酶解时间可以充分分解江蓠藻细胞壁的纤维素,使胶质溶出,与硫酸酯酶充分作用,脱除硫酸基。如果酶解时间过长,江蓠藻细胞壁破坏过大,容易导致胶质溶出,造成流失,而且在后续工序处理中,琼脂分子可能受到化学试剂的破坏,进而影响了琼脂的凝胶强度。综合考虑,选择2 h为复合酶处理江蓠藻的时间。
2.2.2 复合酶法工艺琼脂小试工艺验证
根据上述优化条件,即:酶处理温度50 ℃、体系纤维素酶单位活力14 U/mL、料液比1∶18、酶处理时间2 h的条件下进行小试验证试验,结果见表2。表2中,碱法为采用碱质量分数7%的处理工艺提取,酶法对照为没经过酶预处理直接进行酸处理提取得到。
由表2可知,采用复合酶法工艺提取江蓠琼脂,产率略高于碱法工艺,但凝胶强度却明显较低。从硫酸基含量可以看出,酶法工艺琼脂的硫酸基含量显著高于碱法工艺,而硫酸基含量直接影响了琼脂的凝胶强度。此外,酶法工艺琼脂的融化温度较碱法工艺低,可能是两种工艺提取的琼脂的相对分子质量存在差异所致。在透明度方面,碱法工艺的琼脂较高,但二者在凝固温度方面差异不明显。

表2 复合酶法提取工艺琼脂指标测定结果
2.3 酶法辅助与复合酶法提取琼脂工艺200 L中试放大试验
在酶法辅助和复合酶法提取琼脂小试工艺验证的基础上,进行了200 L中试放大试验,以进一步确认小试工艺的稳定性及用于工厂中试的可行性,实验结果见表3。
由于生物反应器的规模不同,其流体与动量,热量和质量传递性能存在差异,在大小不同的反应器中进行同一试验,有可能导致在中试反应器上不能达到小试反应器的最优结果[17]。从表3可知,3种工艺提取得到的琼脂,酶法辅助工艺的凝胶强度最大,碱法工艺次之,复合酶法工艺的最低,该结果与所测得的硫酸基团含量比较趋势相呼应。可见,中试提取所得的琼脂与小试提取的琼脂,所比较指标的变化趋势不变,试验结果重复性较好。
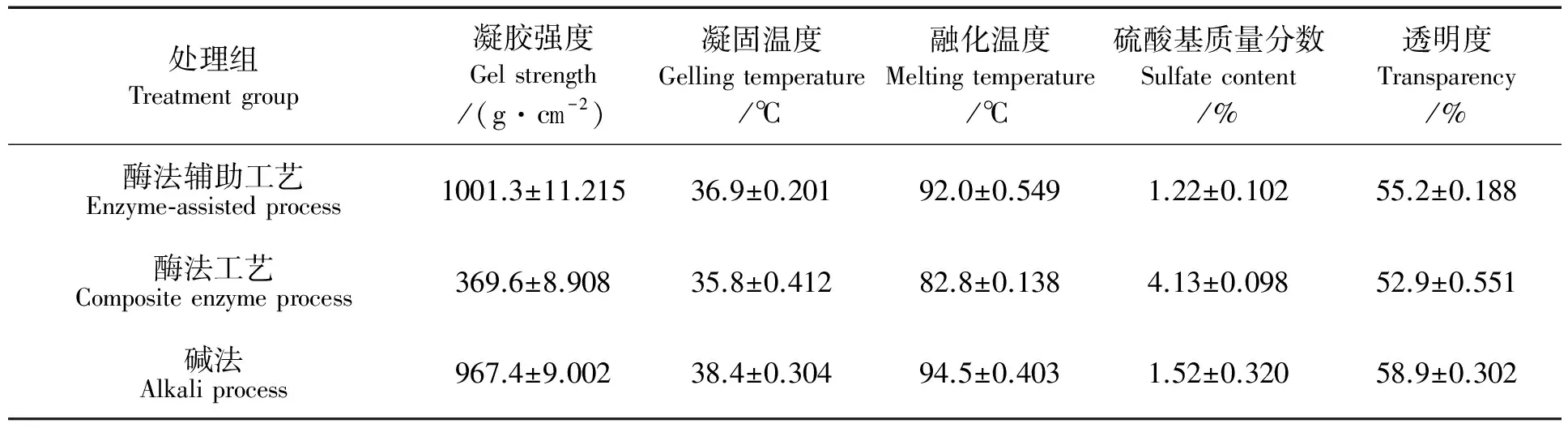
表3 酶法辅助和复合酶法提取工艺琼脂指标测定结果
3 结论
为了减少琼脂提取过程中碱的用量,建立琼脂清洁生产工艺,通过单因素实验对酶法辅助工艺和复合酶法工艺提取琼脂进行了优化,确定了最优工艺条件。其中,酶法辅助提取琼脂工艺为:碱质量分数3%,碱处理时间2.5 h,加酶量4 U/mL,处理温度45 ℃,pH值7.0;复合酶法提取琼脂工艺为:处理温度50 ℃,处理时间2 h,体系中纤维素酶单位活力为14 U/mL,琼脂硫酸酯酶单位活力为26.6 U/mL,料水比(m/V)为1∶18。对上述小试工艺进行验证试验,其中酶法辅助工艺所提琼胶的凝胶强度为831.9 g/cm2,产率为18.9%,两指标均优于传统工艺;复合酶法工艺提取得到的琼脂凝胶强度为377.2 g/cm2,得率18.3%。同时,对两种工艺分别进行了200 L放大试验,所获得琼脂产品的凝胶强度分别为1001.3 g/cm2和369.6 g/cm2,相关工艺指标均呈现良好的稳定性和重复性。
[1]SOMERVILLE J C.Structure of agar-agar[J].Nature,1937,139(3516):512-513.
[2]龙梦娴.琼脂降解相关酶类及酶法制备新琼寡糖的研究[D].武汉:华中农业大学,2011.
[3]王维香,邢雪琳.复合酶解-热水浸提法提取裙带菜硫酸多糖的研究[J].辽宁师范大学学报(自然科学版),1998,21(4):315-318.
[4]赵谋明,林伟锋,杨晓泉,等.酶法处理沙菜藻体对卡拉胶得率和品质的影响研究[J].食品科学,2002,23(6):27-31.
[5]殷勤,肖安风,朱艳冰,等.酶解龙须菜粗多糖硫酸基工艺优化[J].集美大学学报(自然科学版),2015,20(3):173-178.
[6]殷勤,肖安风,倪辉,等.食鹿角菜交替假单胞菌芳香基硫酸酯酶的克隆、表达及酶学性质[J].中国食品学报,2017,17(3):20-27.
[7]中华人民共和国国家发展和改革委员会.纤维素酶制剂:QB 2583—2003[S].北京:中国轻工业出版社,2004.
[8]FU X T,KIM S M.Agarase:review of major sources,categories,purification method,enzyme characteristics and applications[J].Marine Drugs,2010,8(1):200-218.DOI:10.3390/md8010200.
[9]中华人民共和国卫生部.食品添加剂琼脂:GB 1975—2010 [S].北京:中国标准出版社,2010.
[10]NORMAND V,AYMARD P,LOOTENS D L,et al.Effect of sucrose on agarose gels mechanical behaviour[J].Carbohydrate Polymers,2003,54(1):83-95.DOI:10.1016/S0144-8617(03)00153-X.
[11]金骏,林美娇.海藻利用与加工[M].北京:科学出版社,1993:177-186.
[12]李龙.龙须菜琼脂糖的提取技术研究[D].福州:福建农林大学,2013.
[13]中华人民共和国国家卫生和计划生育委员会.食品中水分的测定:GB 5009.3—2016[S].北京:中国标准出版社,2016.
[14]史升耀,唐湛祥.江蓠琼胶的研究Ⅱ:碱处理对琼胶质和量的影响[J].水产学报,1982,6(1):51-58.
[15]ROCHAS C,LAHAYE M.Average molecular weight and molecular weight distribution of agarose and agarose-type polysaccharides[J].Carbohydrate Polymers,1989,10(4):289-298.DOI:10.1016/0144-8617(89)90068- 4.
[16]WATASE M,NISHINARI K.Rheological properties of agarose gels with different molecular weights[J].Rheologica Acta,1983,22(6):580-587.DOI:10.1007/BF01351404.
[17]威以政,汪叔雄.生物反应动力学与反应器[M].北京:化学工业出版社,2007.
