侵染蚕豆ClYVV的鉴定及其衍生的小干扰RNA的深度测序鉴定研究
2018-03-21张趁华郑红英严丹侃韩科雷彭杰军鲁宇文章东方陈剑平
张趁华,郑红英,严丹侃,韩科雷,4,彭杰军,鲁宇文,林 林,章东方,陈剑平,*, 燕 飞,*
(1.福建农林大学 生命科学学院,福建 福州350002; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江省和农业部植保生物技术重点实验室,省部共建浙江省植物有害生物防控国家重点实验室培育基地,浙江 杭州310021; 3.安徽省农业科学院 植物保护与农产品质量安全所,安徽 合肥230031; 4.南京农业大学 植物保护学院,江苏 南京 210095)
马铃薯Y病毒属(Potyviruses)病毒是一类重要的植物病原,是马铃薯Y病毒科(Potyviridae)的第一大属,同时也是最大的RNA病毒属。该属病毒基因组有1条正单链RNA构成,基因组编码一个多聚蛋白,并由自身蛋白酶裂解成多个具有不同功能的病毒蛋白,电镜观察下病毒粒子呈无包膜弯曲线状。该属病毒分布广,能侵染豆科、茄科、菊科、苋科和藜科等多科植物,是大豆、马铃薯、烟草、玉米等重要农作物的主要病害,可造成多种作物明显减产,对农业生产安全可造成严重威胁[1-2]。
三叶草黄脉病毒(Cloveryellowveinvirus, ClYVV)是马铃薯Y病毒属的成员,基因组是正义单链RNA,全长约有10 kb,该基因编码一个大的多聚蛋白,由自身蛋白酶裂解成11个成熟蛋白质[3-4]。ClYVV由英国的Hollings 和 Nariani在白三叶草中首次分离并报道[5]。目前,ClYVV是世界范围内侵染豆科植物、观赏植物和牧草的分布式病原体之一[6-13],可引起植株新鲜绿豆荚变形坏死、叶片早落、发育迟缓,严重的可引起植株全身坏死,扭曲变形坏死等多种病害症状,部分病例可致植株死亡,导致直接的经济损失[14-15]。
在中国,仅在二十多年前的山东根据ClYVV生物学和血清学的特征检测到几例病样[16-17],但到目前为止,这种病毒还没有进一步的分子鉴定。本研究以安徽省合肥市具有明显花叶症状的蚕豆新生叶片为研究对象,利用病毒来源的siRNA的重新测序来重建和测序侵染蚕豆的病毒,然后通过逆转录聚合酶链式反应(RT-PCR)验证序列的准确性。此外,还分析了来自ClYVV的病毒sRNA读取的表征。
1 材料与方法
1.1 试验材料
在安徽省合肥市采集具有明显花叶症状的蚕豆新生叶片,采集后迅速投于液氮中,置于-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 蚕豆病叶组织RNA的提取和小RNA深度测序分析
应用总RNA纯化试剂盒(LC Sciences, Cat. TRK-1001)从50 mg采集的蚕豆病叶组织中提取总RNA,对RNA进行定量并提交给LC-Bio Inc.(中国杭州)。用TruSeq小RNA样品制备试剂盒制备小RNA文库,并在HiSeq2000平台(Illumina)上从两端(配对末端)测序。序列读取并修剪,以除去低质量和接头序列,并使用Velvet Zerbino DR和PFOR Wu QF从头组装算法进行组装。通过对GenBank数据库的BLASTn和BLASTx搜索来分析组装的重叠群,并且手动组装重叠的重叠群。
1.2.2 蚕豆样品双链RNA的提取、cDNA的合成和ClYVV病毒序列扩增
为了进一步鉴定病毒,使用双链RNA提取方法[18],从10 g蚕豆病叶样品中提取病毒双链RNA(dsRNA)。使用ReverTra Ace-α-TM(Toyobo)[19],用引物M4-T合成第一链cDNA。使用cDNA末端的快速扩增(RACE)PCR对病毒基因组的5′ 和3′ 末端进行PCR,并使用重叠的特异性引物对进行常规RT-PCR(引物见表1),扩增拼接了ClYVV-HF的全基因组序列,序列比较用CLUSTALW[20]完成。
表1ClYVV PCR扩增引物序列
Table1The PCR amplification primer sequence of ClYVV

引物名称Primername引物序列Primersequence(5⁃3’)扩增片段长度Amplifiedfragmentlength/bpClYVV⁃1ClYVV⁃1(+):AAAATATAAAATCAATACAAGACAAATClYVV⁃1(-):CTCTTTATTACACCTCTCAC1023ClYVV⁃2ClYVV⁃2(+):GTGAGAGGTGTAATAAAGAGClYVV⁃2(-):ATGTATTTCGCTGCTTCCTG1067ClYVV⁃3ClYVV⁃3(+):CAGGAAGCAGCGAAATACATClYVV⁃3(-):GACAATCTGAGTGATGCGCTG1049ClYVV⁃4ClYVV⁃4(+):CAGCGCATCACTCAGATTGTCClYVV⁃4(-):CAAAGGAAAGTTGGTCTTGC1280ClYVV⁃5ClYVV⁃5(+):GCAAGACCAACTTTCCTTTGClYVV⁃5(-):ACTATGTAGCACGCTCAAGT1138ClYVV⁃6ClYVV⁃6(+):ACTTGAGCGTGCTACATAGTClYVV⁃6(-):ACTCTGCATCAATATCCTCATTC846ClYVV⁃7ClYVV⁃7(+):GAATGAGGATATTGATGCAGClYVV⁃7(-):CTCAGTGTCAACCAAGCCA1024ClYVV⁃8ClYVV⁃8(+):TGGCTTGGTTGACACTGAGClYVV⁃8(-):TGAGCAAGTCATCATAACCC1097ClYVV⁃9ClYVV⁃9(+):GGGTTATGATGACTTGCTCAClYVV⁃9(-):CTCGCTCTATAAAGATCAGA1223
1.2.3 ClYVV的生物学检测和电镜观察
取适量的蚕豆病叶组织,在液氮中研磨至粉末状,加入灭菌的1×PBS 溶液混合均匀后,摩擦接种本氏烟、豇豆、黄豆,四季豆和蚕豆,观察是否出现病毒病病症;若有病症,采集病叶,进行RT-PCR检测后(检测引物为(+):CATTCCCACTTAAGCCAATTC; (-):AAGATCAGATTCACAACGAGG)用2%的磷钨酸溶液负染,在电镜下观察。
2 结果与分析
2.1 蚕豆病叶组织小RNA深度测序初步分析结果
小RNA深度测序初步分析结果表明,除去宿主起源的重叠群之后,剩余的重叠群与马铃薯Y病毒属中的病毒具有高度的序列相似性,总共1 361 555个重叠群被定位到ClYVV,组装的病毒重叠群覆盖了ClYVV模板的100%。
2.2 ClYVV病毒序列扩增和组装
为了验证由sRNA读取组装的ClYVV基因组,以表1中的引物通过RT-PCR,扩增到了ClYVV-HF基因组序列,证实了ClYVV的存在(图1)。将扩增的PCR产物切胶回收,与载体连接检测后送公司测序,将测序得到的片段拼接,获得ClYVV-HF分离株完整的基因组全序列。获得的ClYVV-HF分离株的完整的基因组排除3′ 末端的poly(A)尾巴外长度为9 585个核苷酸(nt),其中5′-UTR为191 nt;P1为906 nt,酶切位点位于F/S;Hc-Pro为1 371 nt,酶切位点位于F/S和G/G;P3为1 044 nt,酶切位点位于G/G和E/S;P3N-PIPO为179 nt,为移码产生的蛋白;6K1为159 nt,酶切位点位于E/S和Q/S;CI为1 905 nt,酶切位点位于Q/S和E/S;6K2为159 nt,酶切位点位于E/S和Q/G;NIa-VPg为573 nt,酶切位点位于Q/G和E/S;NIa-Pro为729 nt,酶切位点位于E/S和Q/A;NIb为1 558 nt,酶切位点位于Q/A和Q/S;CP为811 nt,酶切位点位于Q/S(图2)。该序列已上传到GenBank数据库中(登录号为KU922565)。
2.3 ClYVV的生物学检测和电镜观察
蚕豆病叶组织摩擦接种本氏烟、豇豆、黄豆、四季豆和蚕豆,3~4周后均表现出病毒病症,其系统叶片表现出斑驳、褶皱、叶脉黄化等症状(图4-a,b,d,e,f),取摩擦接种病毒植株的系统叶片首先进行RT-PCR检测,扩增出的片段条带单一,大小与预期结果相符(图3),将扩增的PCR产物切胶回收,与载体连接检测后送公司测序,所得序列为ClYVV特异性片段序列。将检测后的带毒病叶进行电镜观察,可观察到丝状病毒颗粒的存在(图4-c),表明ClYVV可通过汁液摩擦接种多种豆科作物。
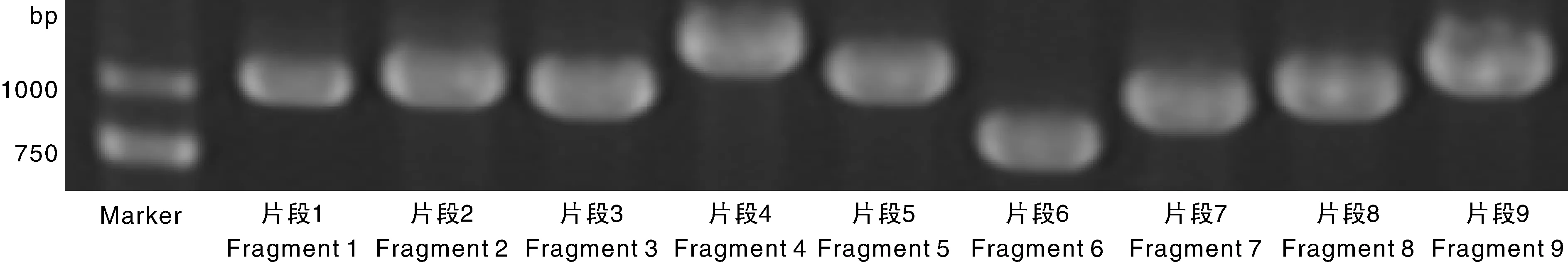
图1 ClYVV-HF病毒基因序列的分段扩增Fig.1 Nine fragments amplified of CGMMV-HF

图2 ClYVV-HF基因组结构示意图Fig.2 Genome organization of ClYVV-HF
2.4 ClYVV小RNAs分析
进一步分析了ClYVV衍生的小干扰RNA的表征,来源于蚕豆样本的ClYVV与其基因组相匹配的sRNAs序列主要分布在19~25 nt,其中以21 nt和22 nt核苷酸为主(图5-A)。其中,vsiRNAs的大小为21 nt,占总RNA的66.84%,其次为22 nt,占总RNAs的26.76%(图5-A),ClYVV vsiRNA的大小类别分析结果表明,21nt长的siRNA是其主要的抗病毒沉默组分,而DCL4是病毒siRNA的主要生产者。为了确定具有不同AGO复合物的vsiRNA之间的潜在相互作用,分析了其5′-末端核苷酸的vsiRNA的相对丰度。生物信息学分析揭示了来源于ClYVV的siRNA 5′-末端核苷酸腺苷(A)和尿苷(U)发生了强偏差(图5-B),这个结果与先前报道的与优先结合亲和力的AGO蛋白的小RNA 5′末端U(AGO1)和A(AGO2和AGO4)的报道一致[21-22]。为了探索vsiRNAs的起源,对vsiRNAs的极性分布进行了表征分析。比对结果显示,来自ClYVV基因组正义链RNAs的vsiRNA(57.59%)高于源自ClYVV基因组反义链RNAs的vsiRNA(42.41%)(图5-C),两种不同来源的vsiRNA的比例为1.36︰1.0。其中,在ClYVV编码的11个基因中,产生自CI编码框的vsiRNA数量最多,其次是HC-Pro和NIb;另一方面,在ClYVV的所有基因中,正义链衍生的vsiRNA数量均多于负义链衍生的vsiRNA数量(1.41∶1.00),其中,来源于CP、6K1和VPg基因正义链衍生的vsiRNA数量分别比反义链衍生的vsiRNA数量分多71%、63%和55%,相比之下,在3′-UTR和5′-UTR区域,情况则相反(0.66∶1.00)(图5-D)。为了鉴定来自ClYVV基因组的vsiRNA产生的热点,将vsiRNA与ClYVV基因组序列进行了比对。在基因组中广泛分布的ClYVV衍生的siRNA揭示了除了在ClYVV基因组中有超过800个读段的7个热点外,整个ClYVV基因组对ClYVV衍生的siRNA的形成提供了相对均匀的贡献,在产生的这7个热点中,21-nt vsiRNA占主导(图5-E)。
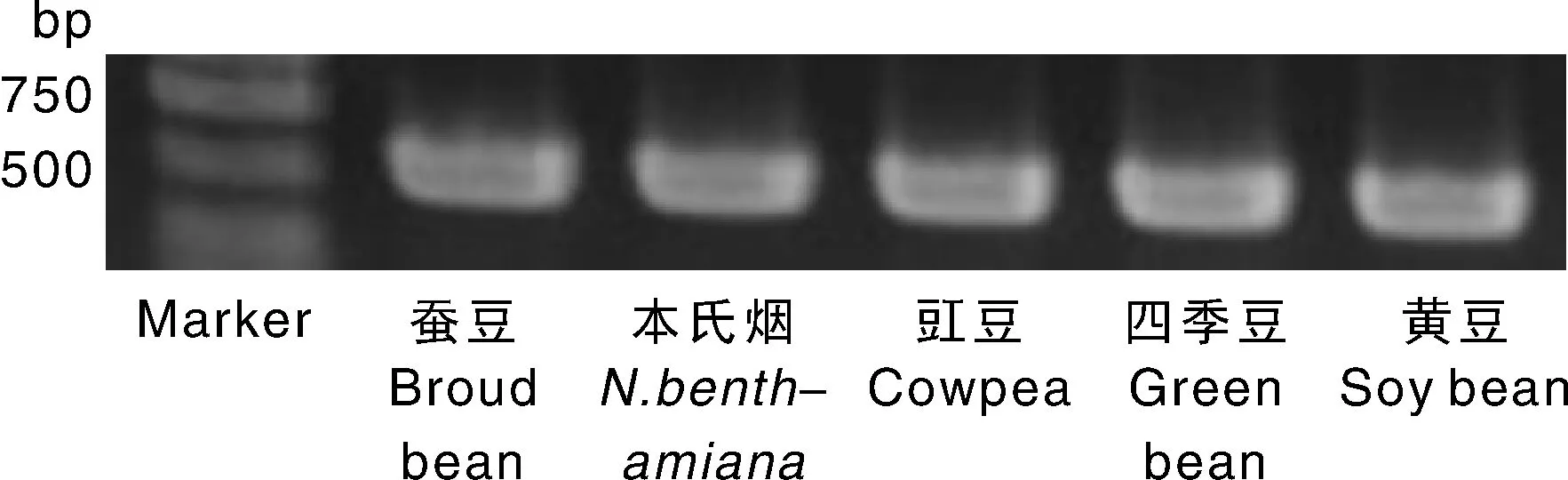
图3 ClYVV摩擦接种相关寄主后的RT-PCR检测结果Fig.3 The RT-PCR results of ClYVV infected hosts

a,蚕豆;b,本氏烟;c,电镜图片;d,豇豆;e,四季豆;f,黄豆。a, Broad bean; b, N.benthamiana; c, Electron microscopy picture; d, Cowpea; e, Green bean; f, Soybean.图4 ClYVV摩擦接种相关寄主后的症状表现及电镜观察Fig.4 Symptoms and electron microscopic observation of ClYVV infected hosts
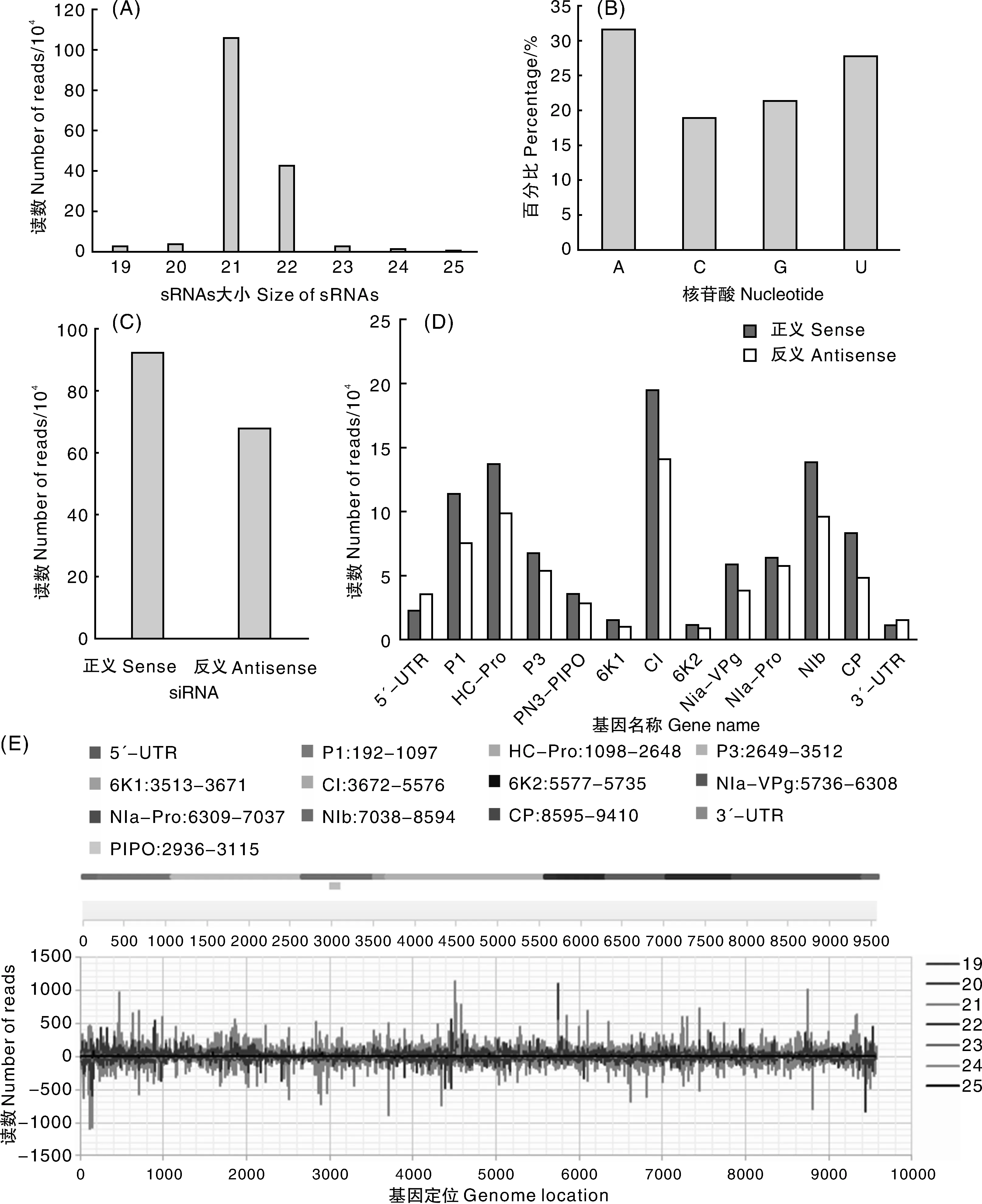
A,来源于蚕豆样本的ClYVV与其基因组相匹配的病毒sRNA序列的分布;B,来源于ClYVV的siRNA 5′-末端核苷酸的丰度分析;C,来源于ClYVV基因组正义与反义siRNA统计分析;D,来源于ClYVV各组分和UTRs的正义和反义siRNA统计分析;E,与ClYVV基因组相关的ClYVV来源的siRNA简介;轴上方的条表示衍生自病毒基因组(有义)链的siRNA,而轴下方的是衍生自互补(反义)链的siRNA。A, Distribution of virus sRNA sequences matching ClYVV genome from ClYVV infected broad bean; B, 5′-terminal nucleotide abundance of ClYVV-derived siRNA analyzed as unique sequences; C, Distinguished as sense (+) or antisense (-) polarity with respect to the ClYVV genome; D, Total sense versus antisense siRNA reads from individual genes and the UTRs of ClYVV genome; E, Profile of ClYVV-derived siRNAs along the ClYVV genome. Bars above the axis represent siRNAs derived from the viral genomic (sense) strand, and those below the axis are siRNAs derived from the complementary (antisense) strand.图5 蚕豆来源的siRNAs简要分析Fig.5 Genome organization of ClYVV Anhui isolates
3 讨论
在病毒侵染植物中,对应于病毒基因组的小干扰RNA(siRNA)形成大部分小RNA群体。许多病毒已经通过从重叠siRNA序列中重组病毒序列被成功鉴定出来[23-24]。通过病毒衍生小RNA的深度测序和组装,研究发现,安徽省合肥市蚕豆中存在ClYVV,并使用了重叠的特异性引物对其进行常规RT-PCR,扩增拼接了ClYVV-HF的全基因组序列,同时还分析了ClYVV-HF衍生的小干扰RNA的特征。
迄今为止,仅有3个ClYVV完整序列被报道,其中一个为韩国大豆来源(KF975894)[25],2个具有相同基因组,为日本的蚕豆来源(AB011819、NC_003536)[26-27]。本研究的ClYVV-HF全长核苷酸序列与日本和韩国分离株的核苷酸同源性分别为95.45%和95.10%,氨基酸同源性分别为100%和98.44%。考虑到这些菌株之间的保守性,本研究认为中国的ClYVV和日本的ClYVV可能属于同一菌株。而对于植物病毒vsiRNA的研究,在先前很多报道中,21 nt和22 nt核苷酸在vsiRNA中所占比重较大[28-30],vsiRNA的大小分布反映了RNA沉默应对RNA病毒的途径。
随着农业经济和运输业的高速发展,植物病毒也呈现出一种高速蔓延的趋势。我国是豆科作物的种植大国,本研究表明ClYVV可通过汁液摩擦接种在多种豆科植物上进行机械传毒,豆科作物种植过程中的不当操作以及农产品的高速流通都有可能引起ClYVV的广泛传播,造成经济损失。本研究是关于中国ClYVV分离株全部核苷酸序列的首次报道。研究获得的序列数据将进一步为中国豆类植物和其他寄主上发生的ClYVV流行病学提供研究基础和见解。
[1] 马雪青, 王永刚, 周贤婧, 等. 马铃薯病毒研究新进展[J]. 食品工业科技, 2010, 31(10):429-434.
MA X Q, WANG Y G, ZHOU X J, et al. Research advances of potato virus[J].ScienceandTechnologyofFoodIndustry, 2010, 31(10):429-434.(in Chinese with English abstract)
[2] 尹明华, 刘燕, 郁雪婷,等. 怀玉山高山马铃薯茎尖再生苗6种病毒的DAS-ELISA检测与分析[J]. 浙江农业学报,2017,29(10):1699-1705.
YIN M H, LIU Y, YU X T, et al. DAS-ELISA detection and analysis of six kinds of viruses in plantlets regenerated from Hua-iyushan high mountain potato shoot-tips[J].ActaAgriculturaeZhejiangensis, 2017,29(10):1699-1705. (in Chinese with English abstract)
[3] CHUNG B Y, MILLER W A, ATKINS J F, et al. An overlapping essential gene in the Potyviridae[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2008, 105(15): 5897-5902.
[4] SASAYA T, SHIMIZU T, NOZU Y, et al. Biological, serological, and molecular variabilities of clover yellow vein virus[J].Phytopathology, 1997,87(10):1014-1019.
[5] HOLLINGS M, NARIANI T. Some properties of clover yellow vein, a virus fromTrifoliumrepensL.[J].AnnalsofAppliedBiology, 1965, 56(1): 99-109.
[6] FOSTER R, MUSGRAVE D. Clover yellow vein virus in white clover (Trifoliumrepens) and sweet pea (Lathyrusodoratus) in the North Island of New Zealand[J].NewZealandJournalofAgriculturalResearch,1985, 28(4):575-578.
[7] IREY M, ADKINS S, BAKER C. Clover yellow vein virus Identified in Ammi majus in Florida[J].PlantDisease, 2006, 90(3):380.
[8] KEHOE M A, COUTTS B A, BUIRCHELL B J, et al. Plant virology and next generation sequencing: experiences with a Potyvirus[J].PLoSOne, 2014, 9(8):e104580
[9] LARSEN R C, MIKLAS P N, EASTWELL K C, et al. A strain of Clover yellow vein virus that causes severe pod necrosis disease in snap bean[J].PlantDisease, 2008, 92(7):1026-1032.
[10] MORAN J, VAN RIJSWIJK B, TRAICEVSKI V, et al. Potyviruses, novel and known, in cultivated and wild species of the family Apiaceae in Australia[J].ArchivesofVirology, 2002, 147(10):1855-1867.
[11] ORTIZ V, CASTRO S, ROMERO J. First report of Clover yellow vein virus in grain legumes in Spain[J].PlantDisease, 2009, 93(1):106.
[12] PASEV G, KOSTOVA D, TURINA M. A New virulent isolate of Clover yellow vein virus onPhaseolusvulgarisin Bulgaria[J].JournalofPhytopathology, 2014, 162(11/12):703-711.
[13] YAMAMOTO H. Mosaic disease of bupleurum (Bupleurumgriffithii) caused by Clover yellow vein virus[J].AnnalsofthePhytopathologicalSocietyofJapan, 2003, 69(4):420-421.
[14] HART J P, GRIFFITHS P D. A series of eIF4E alleles at the Bc-3 locus are associated with recessive resistance to Clover yellow vein virus in common bean[J].TheoreticalandAppliedGenetics, 2013, 126(11):2849-2863.
[15] LARSEN R, MYERS J. A pod necrosis disease (chocolate pod) of snap bean (Phaseolusvulgaris) in Oregon caused by a strain of Clover yellow vein virus[J].Phytopathology, 2006, 96:S169.
[16] 李长松, 朱汉城. 侵染菜豆的三叶草黄脉病毒的鉴定[J]. 山东农业大学学报, 1989(4):223-226.
LI C S, ZHU H C. Identification of Clover yellow vein virus infectingPhaseolusvulgaris[J].JournalofShandongAgriculturalUniversity, 1989(4):223-226.(in Chinese with English abstract)
[17] 李长松. 侵染扁豆的三叶草黄脉病毒的鉴定[J]. 中国病毒学, 1991,6(3):223-226.
LI C S. Identification of Clover yellow vein virus infecting Dolichos lablab[J].VirologicaSinica, 1991,6(3):223-226.(in Chinese with English abstract)
[18] TZANETAKIS I E, MARTIN R R. A new method for extraction of double-stranded RNA from plants[J].JournalofVirologicalMethods, 2008, 149(1):167-170.
[19] CHEN J, ADAMS M. A universal PCR primer to detect members of the Potyviridae and its use to examine the taxonomic status of several members of the family[J].ArchivesofVirology, 2001, 146(4):757-766.
[20] LARKIN M A, BLACKSHIELDS G, BROWN N, et al. Clustal W and Clustal X version 2.0[J].Bioinformatics, 2007, 23(21):2947-2948.
[21] MI S, CAI T, HU Y, et al. Sorting of small RNAs intoArabidopsisargonautecomplexes is directed by the 5′ terminal nucleotide[J].Cell, 2008, 133(1):116-127.
[22] MONTGOMERY T A, HOWELL M D, CUPERUS J T, et al. Specificity of ARGONAUTE7-miR390 interaction and dual functionality in TAS3 trans-acting siRNA formation[J].Cell, 2008, 133(1):128-141.
[23] HAGEN C, FRIZZI A, KAO J,et al. Using small RNA sequences to diagnose, sequence, and investigate the infectivity characteristics of vegetable-infecting viruses[J].ArchivesofVirology, 2011, 156(7):1209-1216.
[24] KREUZE J F, PEREZ A, UNTIVEROS M, et al. Complete viral genome sequence and discovery of novel viruses by deep sequencing of small RNAs: a generic method for diagnosis, discovery and sequencing of viruses[J].Virology, 2009, 388(1):1-7.
[25] SHIN J C, KIM M K, KWAK H R, et al. First report of Clover yellow vein virus onGlycinemaxin Korea[J].PlantDisease, 2014, 98(9):1283.
[26] RAVELO G, KAGAYA U, INUKAI T, et al. Genetic analysis of lethal tip necrosis induced by Clover yellow vein virus infection in pea[J].JournalofGeneralPlantPathology, 2007, 73(1):59-65.
[27] UYEDA I, TAKAHASHI T, TAKAHASHI Y. A cDNA clone to clover yellow vein potyvirus genome is highly infectious[J].VirusGenes, 1997, 14(3):235-243.
[28] MITTER N, KOUNDAL V, WILLIAMS S, et al. Differential expression of tomato spotted wilt virus-derived viral small RNAs in infected commercial and experimental host plants[J].PloSOne, 2013, 8(10):e76276.
[29] PANTALEO V, SALDARELLI P, MIOZZI L, et al. Deep sequencing analysis of viral short RNAs from an infected Pinot Noir grapevine[J].Virology, 2010, 408(1):49-56.
[30] YAN F, ZHANG H, ADAMS M J, et al. Characterization of siRNAs derived from rice stripe virus in infected rice plants by deep sequencing[J].ArchivesofVirology, 2010, 155(6):935-940.
