橄榄假丝酵母控制苹果果实青霉病的效果及机制
2018-03-20蔡孟轩周雅涵张鸿雁邓丽莉姚世响曾凯芳
蔡孟轩,周雅涵,张鸿雁,邓丽莉,姚世响,曾凯芳*
(西南大学食品科学学院,重庆 400715)
苹果是重要的温带水果,由于其生态适应性较强,果品营养价值高,被世界上很多的国家列为主要消费果品[1-2]。但其在采后贮运过程中会受到多种真菌侵染而腐烂变质,其中由扩展青霉(Penicillium expansum)引起的青霉病是常见的病害之一[3-5]。P. expansum是产展青霉素的主要菌种,主要通过侵染的方式导致果实腐烂[6]。经研究发现,展青霉素具有致畸、致癌和免疫毒性,且能够引起一系列急、慢性疾病甚至细胞水平的突变,对人体具有一定的危害作用[7]。目前,化学杀菌剂是控制苹果采后青霉病的主要方式之一,如多菌灵、甲基托布津、苯来特、噻苯咪唑等,但化学杀菌剂的长期使用对人类健康和环境造成了一定的危害,且会导致微生物产生抗药性,从而降低防治效果[8];因此寻找一种新型的防治苹果采后青霉病的技术手段尤为必要。
利用拮抗微生物控制果蔬采后病害是近年来的研究热点[9]。近年来的研究发现,在果蔬采后病害控制中具有较好效果的酵母大约有20多种,其主要为假丝酵母属(Candida)、隐球酵母属(Cryptococcus)、梅奇酵母属(Metschnikowia)、毕赤酵母属(Pichia)、黏红酵母属(Rhodotorula)和丝孢酵母属(Trichosporon)等[9-12]。相关的研究表明,假丝酵母属能有效抑制苹果采后灰霉病[13-14]、柑橘青霉病和绿霉病[15-16]、桃果实软腐病[17]等的发生。其中齐藤假丝酵母(Candida saitoana)[18-19]和假丝酵母菌CWW-4菌株[20]在病害控制和拮抗机理方面已被研究得较为清楚。Guerrero等[21]研究发现,橄榄假丝酵母(Candida oleophila)对苹果青霉病具有一定的抑制作用,且这种抑制作用可能与果实抗性相关酶活力变化有关,但目前关于其对苹果青霉病的生防机制研究还不够系统和深入。因此本实验以苹果为实验材料,采用C. oleophila对苹果果实进行处理,研究不同处理模式下C. oleophila对苹果青霉病的控制效果,并通过分析离体条件下C. oleophila对青霉菌的抑制作用、C. oleophila在苹果果实伤口处的生长情况以及果实伤口周围抗性相关酶活力的变化,初步探讨C. oleophila控制苹果P. expansum发病的机制,为苹果青霉病的生物防治提供一定的理论参考,也为生防酵母的应用提供了技术支持和理论指导,从而减少化学杀菌剂的使用。
1 材料与方法
1.1 材料与试剂
P. expansum分离自发病苹果果实。采用组织分离法从发病苹果果实上分离病原菌,并根据致病性检测结果、病原菌菌落形态、菌丝形态以及分子生物学鉴定结果鉴定为P. expansum。
C. oleophila分离自重庆北碚歇马镇冯家槽柑橘树(锦橙447)叶片表面[22],根据分子生物学鉴定结果鉴定为C. oleophila。
‘红富士’苹果产自甘肃静宁,取大小均一、无机械伤、成熟度基本一致的果实作为实验材料。
葡萄糖、琼脂粉、酵母浸膏、牛肉膏、次氯酸钠成都科龙化工试剂厂。
1.2 仪器与设备
SW-CJ-1F超净工作台 苏净集团安泰有限公司;B203生物显微镜 重庆奥特光学仪器有限公司;BS-4G振荡培养箱 金坛市富华仪器有限公司;DHP-9082电热恒温培养箱、DZF-6000真空干燥箱、HWS-28数显恒温水浴锅 上海齐欣科学仪器有限公司;PSX-280手提式高压杀菌锅 上海申安医疗器械厂;XB.K.25型血球计数板 上海求精生化试剂有限公司;GL-20G-Ⅱ高速冷冻离心机 上海安亭科学仪器厂;SL602N高精显电子天平 上海民桥精密科学仪器有限公司;S-4800扫描电子显微镜(scanning electron microscope,SEM)、E-1045型离子溅射仪 日本Hitachi公司;PowerPac电泳仪 美国Bio-Rad公司;G:BOX EF凝胶成像仪英国Syngene公司;SYNERGYH1MG全自动酶标仪美国BioTek公司。
1.3 方法。
1.3.1 C. oleophila悬浮液的制备
悬浮液制作:1)活化菌种:28 ℃条件下,在NYDA培养基上扩大培养C. oleophila 48 h;2)液体培养:挑取一环NYDA培养基上的C. oleophila于NYDB培养基中,在180 r/min、28 ℃摇床中培养24 h;3)离心浓缩:4 000 r/min、4 ℃离心10 min,用无菌水洗涤2 次;4)血球计数板计数后用无菌水稀释到1×108CFU/mL和1×107CFU/mL备用。
1.3.2 P. expansum孢子悬浮液的制备
P. expansum接种于PDA培养基上,25 ℃培养7 d后,用接种环刮取适量P. expansum,4 层纱布过滤,血球计数板计数,并用无菌水调整浓度至1×104孢子/mL的孢子悬浮液,待用[23]。
1.3.3 C. oleophila对苹果果实接种发病率和病斑直径影响的测定
同孔接种和异孔接种实验:将果实随机分为2 组。用无菌打孔器在果实赤道部位等距离打孔(直径3 mm、深度3 mm),每个苹果打3 个伤口,每个处理组果实伤口处分别加入20 μL下述液体:无菌水(阳性对照)、1×108CFU/mL C. oleophila悬浮液。同孔处理:4 h后,在果实伤口处接入20 μL的1×104孢子/mL P. expansum孢子悬浮液。异孔处理:24 h后,在每个伤口右侧5 mm打一个同样大小的孔,在新孔中加入20 μL的1×104孢子/mL P. expansum孢子悬浮液。
浸泡接种实验:将果实随机分成2 组。将果实浸泡于下述液体:无菌水(阳性对照)、1×108CFU/mL C. oleophila悬浮液;2 min后自然晾干。用无菌打孔器在果实赤道部位等距离地打伤口(直径3 mm,深度3 mm),每个苹果打3 个伤口。24 h后,每个伤口处分别加入20 μL的1×105孢子/mL P. expansum孢子悬浮液。
待菌液吸收后,单果包装,置于25 ℃、相对湿度90%~95%条件下贮藏,定期统计果实发病率和病斑直径。发病率的计算如下式。每组处理5 个果实,实验重复3 次。

1.3.4 离体条件下C. oleophila对P. expansum的抑菌作用测定
1.3.4.1 平板对峙实验
用无菌打孔器在装有20 mL PDA培养基的平板(直径为90 mm)上打两个相距40 mm、直径10 mm的小孔。在两组培养基的一孔内分别加入0.l mL的无菌水(阳性对照)和1×108CFU/mL C. oleophila悬浮液。在另一孔内均加入20 μL浓度为1×106孢子/mL的P. expansum孢子悬浮液,进行平板对峙实验。每组处理3 个培养皿,用Parafilm膜密封后置于25 ℃下培养,20 d后观察拮抗菌与病原菌的生长情况,实验重复3 次[24]。
1.3.4.2 C. oleophila挥发性物质对P. expansum的抑制作用测定
采用平板对扣法。吸取100 μL的无菌水(阳性对照)和1×108CFU/mL C. oleophila悬浮液,分别涂布于NYDA培养基平板上。将平板至于28 ℃培养48 h后,在另一个PDA平板中央接入1 μL 1×106孢子/mL的P. expansum孢子悬浮液,两板对扣用Parafilm膜密封,置于25 ℃下培养20 d后,用十字交叉法测量菌落直径。每组处理3 个培养皿,实验重复3 次[25]。
1.3.5 C. oleophila处理后酵母在苹果果实的生长情况测定
1.3.5.1 C. oleophila接种处理后酵母在苹果果实伤口处的生长动态测定
伤口接种处理:将果实随机分成2 组,接种处理方法同1.3.3节同孔接种法。待菌液吸收后,单果包装,贮藏在25 ℃、相对湿度90%~95%环境下,以接种后1 h测定的酵母菌数为起始值,每天取一次样,用稀释平板法测定酵母数目。取样时,用消毒的打孔器取伤口处直径为10 mm的果肉组织10 份,放入含10 mL无菌水的消毒研钵内研磨至匀浆,25 ℃条件下培养48 h后计数,结果以每伤口处酵母数量为单位(lg(cells/wound))表示,每个重复5 个果实,实验重复3 次[26]。
1.3.5.2 C. oleophila悬浮液浸泡处理后酵母在苹果果实表皮生长动态测定
将果实浸泡于浓度为1×108CFU/mL C. oleophila悬浮液中2 min,自然晾干。单果包装后,除取样操作不同外,其他均同1.3.5.1节。取样时,用消毒的削皮刀削取苹果果皮,取2 cm×1 cm的果皮5 份放入含10 mL无菌水的消毒研钵内研磨至匀浆。
1.3.5.3 C. oleophila接种处理后酵母在苹果果实伤口处的定殖情况观察
伤口接种处理:将果实随机分成2 组,接种处理方法同1.3.3节同孔接种法。待果实晾干后单果包装,置于25 ℃、相对湿度90%~95%条件下贮藏24 h。
SEM样品制备:1)样品取材:每组取3 个果实,在果实伤口处切下大小约3 mm×3 mm×3 mm的组织小块;2)固定:将组织小块保存在0.1 mol/L磷酸缓冲液配制的pH 6.8、体积分数2.5%戊二醛溶液中过夜固定,固定液置于4 ℃冰箱中;3)清洗:用上述相同的磷酸缓冲液漂洗至少2 次,待脱水;4)脱水:分别用30%、50%、70%、85%、95%乙醇各脱水一次,100%乙醇脱水2 次,每次脱水时间为10 min;5)置换:叔丁醇浓度由低至高置换,分别用50%、70%、90%、95%叔丁醇置换一次,100%叔丁醇置换2 次,每次10 min;6)干燥:放入真空干燥箱中干燥,温度65 ℃,真空度大于0.08 kPa。干燥时间2 h。将干燥的组织块用双面胶粘到金属台上,用离子溅射仪对金属台喷金、镀膜。7)观察、照相[27]。
1.3.6 C. oleophila对苹果果实相关防御机制酶活力影响的测定
1.3.6.1 样品处理及取样
将果实随机分成2 组,接种处理方法同1.3.3节同孔接种法。待液体吸收后,单果包装,贮藏在25 ℃、相对湿度90%~95%环境下。从第0天开始取样,每隔24 h进行一次取样,连续取样6 次,取样部位为苹果果实打孔伤口周围1 cm直径的健康果实组织。每个处理重复3 次,每个重复30 个果实,实验重复3 次。1.3.6.2 过氧化物酶活力的测定
过氧化物酶(peroxidase,POD)活力的测定参照曹建康等[28]的方法并作适当改进。于470 nm波长处室温下测定反应3 min的吸光度变化,以每分钟吸光度变化1为一个酶活力单位(U)。
1.3.6.3 多酚氧化酶活力的测定
多酚氧化酶(polyphenol oxidase,PPO)活力的测定参照Srivastava等[29]的方法并作适当改进。于420 nm波长处室温下测定反应3 min的吸光度变化,以每分钟吸光度变化1为一个酶活力单位(U)。
1.3.6.4 苯丙氨酸解氨酶活力的测定
苯丙氨酸解氨酶(L-phenylalanin ammonia-lyase,PAL)的测定参照Assis等[30]的方法并作适当改进。在室温下测定保温(1h)前后290 nm波长处吸光度的变化,每小时每克苹果吸光度改变0.01定义为一个酶活力单位(U)。
1.4 数据分析
Excel 2016软件统计分析所有数据,计算标准误差并制图;应用SPSS 22软件进行方差分析(analysis of variance,ANOVA),利用邓肯氏多重比较对差异显著性进行分析(P<0.05)。
2 结果与分析
2.1 C. oleophila对苹果果实青霉病的控病效果
接种处理后苹果果实的发病情况如图1所示。同孔接种实验结果表明,C. oleophila处理组果实的发病率和病斑直径显著低于对照组果实(P<0.05),对照组果实在贮藏第4天发病率达到100%;而在5 d的贮藏期内,C. oleophila处理组果实均未发病,说明C. oleophila可能与P. expansum间存在竞争机制,通过竞争抑制了霉菌的生长。异孔接种实验结果表明,第3天和第4天C. oleophila处理组果实的发病率和病斑直径均显著低于对照组果实(P<0.05);对照组果实在贮藏第4天发病率达到100%,而C. oleophila处理组果实在贮藏第5天发病率达到100%;贮藏第4天时,对照组果实发病率是C. oleophila处理组的1.32 倍,对照组果实病斑直径是C. oleophila处理组的1.56 倍;说明拮抗酵母对果实自身抗病相关系统有一定的诱导作用。浸泡接种实验结果表明,C. oleophila处理组果实的发病率和病斑直径显著低于对照组果实(P<0.05);贮藏第4天时,对照组果实发病率和病斑直径分别是C. oleophila处理组的3.53 倍和3.77 倍。


图1 C. oleophila对苹果果实青霉病发病率和病斑直径的影响Fig.1 Effect of C. oleophila on disease incidence and lesion diameter of apple with P. expansum inoculation
2.2 离体条件下C. oleophila对P. expansum的抑菌作用
C. oleophila与P. expansum异孔生长情况如图2所示。图2B结果表明,C. oleophila周围无抑菌圈,证明C. oleophila不产生抑菌次生代谢产物。
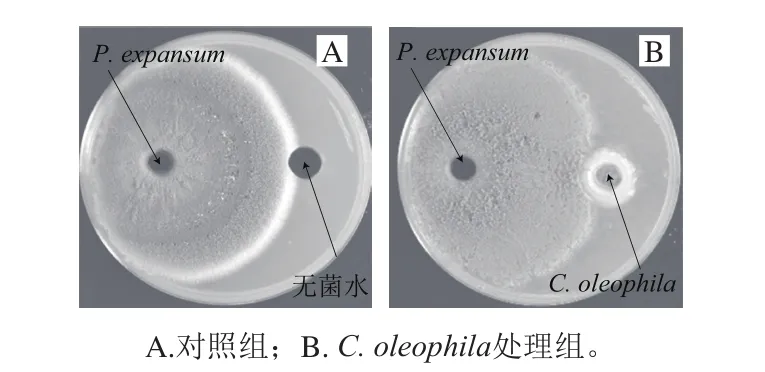
图2 离体条件下C. oleophila对P. expansum的抑菌作用Fig.2 Antibacterial effect of C. oleophila under in vitro culture conditions
2.3 C. oleophila挥发性物质对P. expansum的抑制作用
C. oleophila挥发性物质对P. expansum的抑制作用如图3所示。与对照组相比,C. oleophila的挥发性物质对P. expansum的生长无显著抑制作用(P>0.05)。
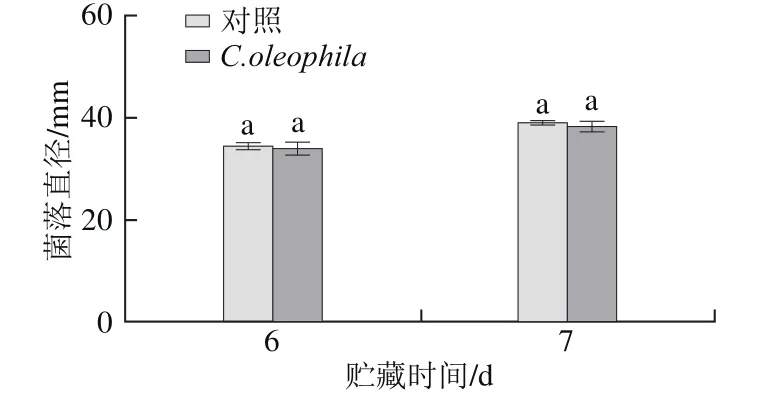
图3 C. oleophila挥发性物质对P. expansum的抑制作用Fig.3 Inhibitory effect of volatile components from C. oleophila on P. expansum
2.4 C. oleophila在苹果果实上的生长状况
2.4.1 C. oleophila在苹果果实上的生长动态
C. oleophila在苹果果实上的生长动态如图4所示。损伤接种处理后苹果果实伤口处酵母的生长动态结果(图4A)表明,C. oleophila能在果实伤口处迅速定殖、扩增。在第2天时,C. oleophila在苹果伤口处的活菌数达到最高值,比第0天增加了2.24 lg(cells/wound);4 d后,C. oleophila的活菌数保持稳定。浸泡处理后苹果果皮处酵母的生长动态(图4B)结果表明,C. oleophila能在苹果果皮定殖、扩增。在贮藏第2天时,C. oleophila在苹果果皮处的活菌数达到最高值;3 d后,C. oleophila的活菌数虽略有下降,但基本保持稳定。
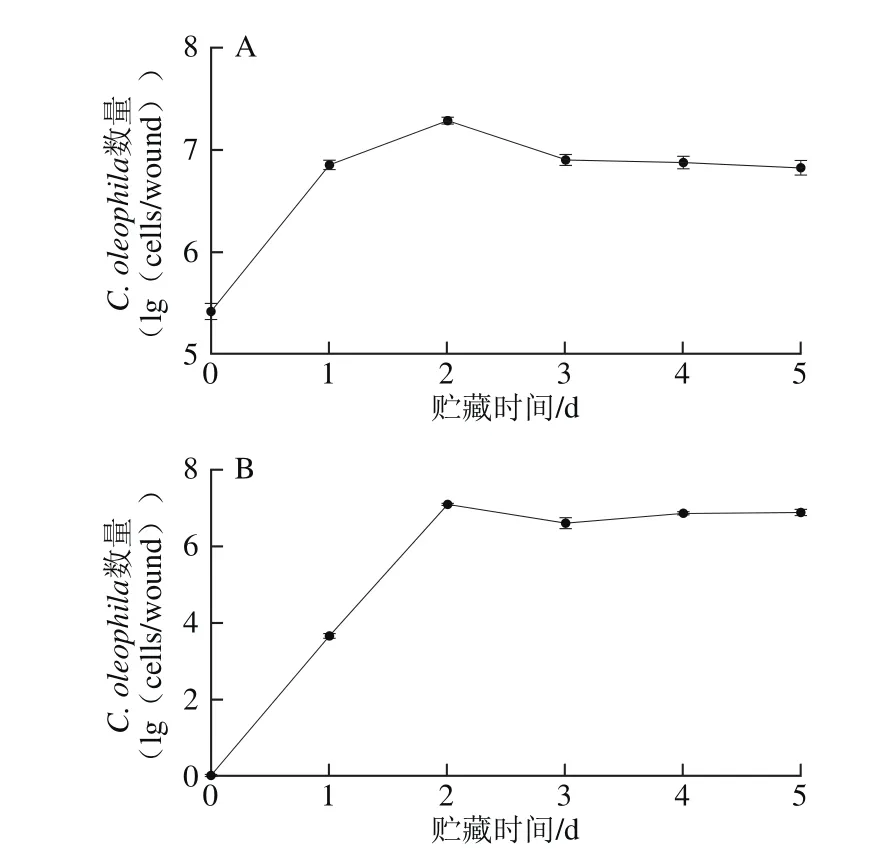
图4 C. oleophila在苹果果实伤口处(A)和果皮处(B)的生长动态Fig.4 Population dynamics of C. oleophila on apple wounds (A) and apple peel (B) after soaking
2.4.2 果实伤口处C. oleophila的生长情况
C. oleophila与病原菌在果实伤口处的生长情况如图5所示。从图中可以清晰地看到P. expansum菌丝笔直、粗壮(图5A);C. oleophila处理组未能观察到P. expansum菌丝,C. oleophila在果实伤口处生长旺盛、大量繁殖、形态清晰、结构完整,果实伤口有大量的酵母附着(图5B)。
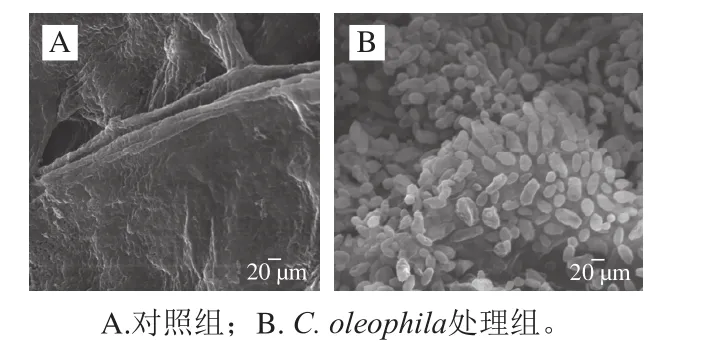
图5 SEM观察到的C. oleophila处理组果实伤口处酵母菌的生长情况(×4 000)Fig.5 SEM observation of the growth of C. oleophila on apple wounds (× 4 000)
2.5 C. oleophila对苹果果实抗病相关酶活力的影响
2.5.1 C. oleophila对苹果果实POD和PPO活力的影响
C. oleophila对苹果果实POD和PPO活力的影响如图6所示,在5 d的贮藏期内,两个处理组的苹果果实PPO和POD活力均显著提高(P<0.05),总体大致呈先上升后下降的趋势。与对照组相比,C. oleophila处理组果实的PPO和POD活力增加更明显,且在接种第2天时,C. oleophila处理组果实的PPO活力约为对照组的1.84 倍,POD活力约是对照组的3.45 倍。

图6 C. oleophila对果实POD(A)和PPO(B)活力的影响Fig.6 Effect of C. oleophila inoculation on POD (A) and PPO (B)activities in apple fruits
2.5.2 C. oleophila对苹果果实PAL活力的影响
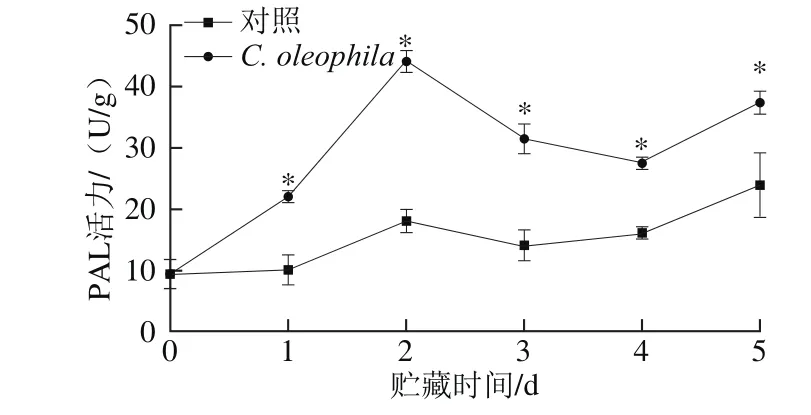
图7 C. oleophila对苹果果实PAL活力的影响Fig.7 Effect of C. oleophila inoculation on PAL activity in apple fruits
图7表明,在5 d的贮藏期内,苹果果实的PAL活力总体大致呈先上升后下降再上升的趋势。C. oleophila处理组苹果果实的PAL活力显著高于对照组(P<0.05),且在接种第2天时,C. oleophila处理组果实的PAL活力约为对照组的2.44 倍。
3 讨 论
酵母对果蔬病害的控制机制有多种,酵母可通过营养和空间的竞争,分泌抗生素、挥发性物质等方式来抑制病原菌生长[31-33],本研究所使用C. oleophila对苹果青霉病的控制机制也包括多个方面。C. oleophila的抑菌机制主要表现在与病原菌竞争营养和空间,其挥发性物质对青霉菌的生长无显著抑制作用。本研究中C. oleophila在果实伤口处的生长情况与同孔接种实验结果说明营养和空间的竞争是酵母抑菌的主要机制之一。通过观察C. oleophila在苹果果实伤口处的生长动态发现,C. oleophila能在苹果果实伤口处迅速定殖、扩增,且在第2天时活菌数达到最高值,通过SEM图可以清晰地看到酵母在果实伤口处生长旺盛并大量繁殖,其形态清晰、结构完整,且果实伤口处有大量的酵母附着。因此,可初步推断C. oleophila对P. expansum的主要抑菌机制为:C. oleophila在果实伤口迅速生长,果实伤口处的空间被C. oleophila占据,使P. expansum不能与果实伤口接触,无法吸收营养物质,抑制P. expansum的快速生长繁殖,从而控制果实青霉病的发生。
异孔损伤接种实验表明,C. oleophila处理对苹果青霉病有着较好的控制效果,经C. oleophila处理的果实发病率和病斑直径显著低于对照组果实(P<0.05)。诱导果实产生抗性是拮抗酵母控制果实病害的主要机制之一[34]。通常拮抗酵母通过诱导苹果POD、PPO活力的升高,以及木质素的大量积累,增加果实抗病性[35]。本实验结果表明,当用C. oleophila作用于苹果果实时,在5 d的贮藏期内果实PPO、POD活力显著提高(P<0.05),且在贮藏第2天达到峰值,分别为对照组的1.84 倍和3.45 倍。PAL是苯丙烷类代谢途径中的关键酶,它与植物抗毒素和酚类化合物的形成有着密切的关系,通过促进次生代谢产物的生成来提高果实的诱导抗病性[36]。在本实验中,C. oleophila能显著提高果实的PAL活力(P<0.05),在贮藏第2天时为对照组的2.44 倍,这与Wisniewski等[8]的研究类似。
浸泡实验结果表明,经C. oleophila浸泡处理的苹果果实青霉病的发病率和病斑直径都显著低于对照组(P<0.05)。同时,本实验还研究了C. oleophila悬浮液浸泡处理后酵母在苹果果实表皮生长情况。结果表明,C. oleophila能在苹果果皮定殖、扩增;因此推测C. oleophila能够通过稳定附着于苹果果皮抑制果实青霉病的发生。
综上所述,C. oleophila对于抑制苹果果实青霉病的发病进程具有较好的效果,其控制苹果青霉病发病的机制包括诱导果实产生抗性,以及与病原菌竞争营养和空间。通过比较不同处理模式下C. oleophila对苹果青霉病的控制效果,发现C. oleophila在同孔接种处理下比异孔接种处理对苹果青霉病的发病进程具有更好的控制作用,并且C. oleophila不能通过分泌抗生素、挥发性物质等方式来抑制P. expansum的生长;说明C. oleophila主要是通过营养与空间竞争抑制苹果青霉病的发生。通过浸泡接种的处理方式,模拟实际生产中C. oleophila对苹果青霉病发病进程的控制,将苹果浸泡于C. oleophila悬浮液中,C. oleophila能稳定附着于苹果果皮表面,当苹果受到机械伤时,C. oleophila能够稳定附着于苹果果皮,从而抑制果实青霉病的发生。
本研究结果表明,C. oleophila作为控制果蔬采后病害的生物拮抗菌,其主要通过与病原菌竞争营养成分和空间、提高果蔬抗病相关酶活性来控制果蔬采后病害的发生。因此,在实际应用过程中可以将C. oleophila与其他物质进行复配以增加酵母在苹果果皮的数量,从而增强酵母的生防效果。
[1] XIE B G, LIU Y L, ZOU H Q, et al. Determination of D-glucaric acid and/or D-glucaro-1,4-lacton in different apple varieties through hydrophilic interaction chromatography[J]. Food Chemistry, 2016,203: 1-7. DOI:10.1016/j.postharvbio.2016.03.003.
[2] REINKENSMEIER A, STEINBRENNER K, HOMANN T, et al.Monitoring the apple polyphenol oxidase-modulated adduct formation of phenolic and amino compounds[J]. Food Chemistry, 2016, 194: 76-85. DOI:10.1016/j.foodchem.2016.02.009.
[3] LAI T F, WANG Y, BAI X L, et al. Dissecting inhibitory effect of boric acid on virulence and patulin production of Penicillium expansum[J]. Postharvest Biology & Technology, 2016, 117: 187-196.DOI:10.1016/j.postharvbio.2016.03.003.
[4] DA ROCHA NETO A C, MARCELO M, DI PIERO R M. Antifungal activity of salicylic acid against Penicillium expansum and its possible mechanisms of action[J]. International Journal of Food Microbiology,2015, 215: 64-70. DOI:10.1016/j.ijfoodmicro. 2015.08.018.
[5] ZHU Y Y, YU J, BRECHT J K, et al. Pre-harvest application of oxalic acid increases quality and resistance to Penicillium expansum in kiwifruit during postharvest storage[J]. Food Chemistry, 2016, 190:537-543. DOI:10.1016/j.foodchem.2015.06.001.
[6] DESMARCHELIER A, MUJAHID C, RACAULT L, et al.Analysis of patulin in pear- and apple-based foodstuffs by liquid chromatography electrospray ionization tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2011, 59(14): 7659-7665.DOI:10.1021/jf201461r.
[7] DE SOUZA SANT’ANA A, ROSENTHAL A, DE MASSAGUER P R. The fate of patulin in apple juice processing: a review[J].Food Research International, 2008, 41(5): 441-453. DOI:10.1016/j.foodres.2008.03.001.
[8] WISNIEWSKI M E, WILSON C L. Biological control of postharvest diseases of fruits and vegetables: recent advances[J]. Hortscience,1992, 27(2): 94-98. DOI:10.1016/j.fm.2014.11.0.
[9] JANISIEWICZ W J, KORSTEN L. Biological control of postharvest diseases of fruits[J]. Annual Review of Phytopathology, 2002, 40(1):411-441. DOI:10.1146/annurev.phyto.40.120401.130158.
[10] LI C, ZHANG H, YANG Q, et al. Ascorbic acid enhances oxidative stress tolerance and biological control efficacy of Pichia caribbica against postharvest blue mold decay of apples[J]. Journal of Agricultural and Food Chemistry, 2014, 62(30): 7612-7621.DOI:10.1021/jf501984n.
[11] MARI M, BERTOLINI P, PRATELLA G C. Non-conventional methods for the control of post-harvest pear diseases[J]. Journal of Applied Microbiology, 2003, 94(5): 761-766. DOI:10.1046/j.1365-2672.2003.01920.
[12] SPADARO D, GULLINO M L. State of the art and future prospects of the biological control of postharvest fruit diseases[J]. International Journal of Food Microbiology, 2004, 91(2): 185-194. DOI:10.1016/S0168-1605(03)00380-5.
[13] USALL J, TEIXIDÓ N, TORRES R, et al. Pilot tests of Candida sake (CPA-1) applications to control postharvest blue mold on apple fruit[J]. Postharvest Biology & Technology, 2001, 21(2): 147-156.DOI:10.1016/S0925-5214(00)00131-9.
[14] EL-GHAOUTH A, SMILANICK J L, WILSON C L. Enhancement of the performance of Candida saitoana by the addition of glycolchitosan for the control of postharvest decay of apple and citrus fruit[J]. Postharvest Biology and Technology, 2000, 19(1): 103-110.DOI:10.1016/S0925-5214(00)00076-4.
[15] MEKBIB S B, REGNIERT J C, KORSTEN L, et al. Efficacy and mode of action of yeast antagonists for control of Penicillium digitatum in oranges[J]. Tropical Plant Pathology, 2011, 36(4): 233-240. DOI:10.1590/s1982-56762011000400004.
[16] SALLAM M A N, BADAWY I F M, IBRAHIM A R. Biocontrol of green mold of orange using some yeasts strains and their effects on postharvest quality parameters[J]. International Journal of Plant Pathology, 2012, 3(1): 14-24. DOI:10.3923/ijpp.2012.14.24.
[17] FAN Q, TIAN S P, XU Y, et al. Biological control of rhizopus rot of peach fruits by Candida guilliermondii[J]. Acta Botanica Sinica, 2000,42(10): 1033-1038.
[18] ELGHAOUTH A, SMILANICK J L, BROWN G E, et al.Application of Candida saitoana and glycolchitosan for the control of postharvest diseases of apple and citrus fruit under semi-commercial conditions[J]. Plant Disease, 2000, 84(3): 243-248. DOI:10.1094/PDIS.2000.84.3.243.
[19] EL GHAOUTH A, WILSON C L, WISNIEWSKI M. Control of postharvest decay of apple fruit with Candida saitoana and induction of defense responses[J]. Phytopathology, 2003, 93(3): 344-348.DOI:10.1094/PHYTO.2003.93.3.344.
[20] 梁学亮, 郭小密. 假丝酵母对柑橘采后绿霉病的抑制效果[J]. 华中农业大学学报, 2006, 25(1): 26-30. DOI:10.13300/j.cnki.hnlkxb.2006.01.007.
[21] GUERRERO V, GUIGON C, BERLANGA D, et al. Complete control of Penicillium expansum on apple fruit using a combination of antagonistic yeast Candida oleophila[J]. Chilean Journal of Agricultural Research,2014, 74(4): 427-431. DOI:10.4067/S0718-58392014000400008.
[22] LIU Y, WANG W H, ZHOU Y Y, et al. Isolation, identif i cation and in vitro screening of Chongqing orangery yeasts for the biocontrol of Penicillium digitatum on citrus fruit[J]. Biological Control, 2017, 110:18-24. DOI:10.1016/j.biocontrol.2017.04.002.
[23] 路来风. 海洋拮抗酵母Rhodosporidium paludigenum对柑橘果实抗性的增强效应及其生物学机理研究[D]. 杭州: 浙江大学, 2015: 31.
[24] 于帅. 果蔬采后病害生物防治型酵母菌的筛选[D]. 济南: 山东轻工业学院, 2010: 12-13.
[25] 许春青. 芒果炭疽病菌拮抗酵母的筛选、鉴定及其保护剂的评价[D].武汉: 华中农业大学, 2013: 18-19.
[26] 罗杨. 膜醭毕赤酵母对柑橘采后青绿霉病害的生物防治及机理研究[D]. 重庆: 西南大学, 2011: 21-22.
[27] 程雷. 两种酵母对“红富士”苹果采后病害的生物防治研究[D]. 南京: 南京农业大学, 2010: 16.
[28] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 142-147.
[29] SRIVASTAVA M K, DWIVEDI U N. Delayed ripening of banana fruit by salicylic acid[J]. Plant Science, 2000, 158(1/2): 87-96.DOI:10.1016/S0168-9452(00)00304-6.
[30] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology & Technology, 2001,23(1): 33-39. DOI:10.1016/S0925-5214(01)00100-4.
[31] SPADARO D, DROBY S. Development of biocontrol products for postharvest diseases of fruit: the importance of elucidating the mechanisms of action of yeast antagonists[J]. Trends in Food Science &Technology, 2016, 47(49): 39-49. DOI:10.1016/j.tifs.2015.11.003.
[32] MEDINA-CÓRDOVA N, LÓPEZ-AGUILAR R, ASCENCIO F, et al.Biocontrol activity of the marine yeast Debaryomyces hansenii against phytopathogenic fungi and its ability to inhibit mycotoxins production in maize grain (Zea mays L.)[J]. Biological Control, 2016, 97: 70-79.DOI:10.1016/j.biocontrol.2016.03.006.
[33] 郑芳园. 间型假丝酵母C410产生挥发性抗真菌物质的条件优化及其对草莓储藏期病害的防治研究[D]. 武汉: 华中农业大学, 2012: 3-4.
[34] 毛淑波. 罗伦隐球酵母结合热空气处理对草莓采后病害的防治及其机理研究[D]. 南京: 南京农业大学, 2013: 8-9.
[35] 刘普. 柑橘采后生防菌柠檬形克勒克酵母(34-9)产生的活性物质及其他抑菌机制的研究[D]. 武汉: 华中农业大学, 2011: 12.
[36] PELLEGRINI L, ROHFRITSCH O, FRITIG B, et al. Phenylalanine ammonia-lyase in tobacco. molecular cloning and gene expression during the hypersensitive reaction to tobacco mosaic virus and the response to a fungal elicitor[J]. Plant Physiology, 1994, 106(3): 877-886.
