基于Monte Carlo模拟法对液态乳中黄曲霉毒素M1的风险评估
2018-03-20耿梦梦徐明芳陈耕南
耿梦梦,徐明芳,*,王 阳,黎 明,陈耕南
(1.暨南大学生命科学技术学院,广东 广州 510632;2.暨南大学应急管理研究中心,广东 广州 510632)
中国是液态乳的巨大消费国,液态乳和乳制品对各个年龄段的人适用,是因为液态乳是人体内的主要营养来源之一。根据联合国粮食及农业组织预测,2015年世界鲜奶产量达到8.01亿 t,增长1.5%,中国原料乳产量大致为3 700万 t左右,全国液态乳产量为2 074.63万 t,同比增长4.32%[1]。生鲜液态乳中有害物质的来源主要有霉菌毒素污染、农药残留、兽药残留、重金属污染、微生物污染和人为添加剂。而黄曲霉毒素作为霉菌毒素之一就是其中最为重要的一种[2]。
黄曲霉毒素是由一类黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)等真菌产生的次级代谢产物。迄今为止,至少有300多种不同的黄曲霉毒素被发现,包括黄曲霉毒素B1(aflatoxin B1,AFB1)、B2(aflatoxin B2,AFB2)、G1(aflatoxin G1,AFG1)、G2(aflatoxin G2,AFG2)和M1(aflatoxin M1,AFM1)等。其中AFM1是由AFB1在肝脏中经微粒体细胞色素P450羟基化代谢的产物,当奶牛食用了被AFB1污染的饲料后,其生产的液态乳及乳制品中就会污染。AFM1的基本结构是由二氢呋喃环和氧杂萘邻酮构成,进入机体后能诱发p53基因特定密码子的特定碱基突变,从而诱发癌变,是人类原发性肝癌的主要致病因素之一。除此之外,AFM1还具有致畸、致突变和免疫抑制等非致癌躯体有害作用。世界卫生组织(World Health Organization,WHO)的国际癌症研究机构根据其细胞毒性及致癌效应,将其定义为Ⅱ类致癌物[4]。对此,国际组织及相关国家制定了食品中AFM1的限量标准。欧盟规定,液态乳和乳制品中AFM1的含量不能超过0.05 μg/kg。美国与我国对乳及乳制品中AFM1的限量标准为0.5 μg/kg,婴儿乳品中不得检出[5]。
暴露评估是风险评估的核心步骤,分为点评估和概率评估两种。点评估模型采用食物高消费量和污染物高残留量进行计算,一般按照y=计算,其中y为某种危害物的人群暴露量(摄入量);Xi,0.95为第i类食物消费量分布的95%分位数;Ci,max为第k类食物中某一危害物的最大残留量;p为消费食物种类数目;为被评估人群的平均体质量。
点评估法一般选取第95百分位数或第97.5百分位数用以反映高暴露量人群的情况。Michlig等[6]通过点评估法评估了在大型贮罐液态乳中AFM1的污染水平,并进一步确定了阿根廷原料乳暴露评估与AFM1污染有关的风险因子,认为商业饲料污染是最主要的风险因子。目前,对黄曲霉毒素的暴露评估主要采用的是点评估法,该法简单易行,评估成本低,但忽略了个体差异,结构较为保守,无法量化个体水平消费量和食品中化学物水平的变异,也无法对参数估计的不确定性做出说明[7]。近年来,由美国Palisade公司开发的基于Monte Carlo模拟技术的风险分析软件@Risk已被应用于安全定量风险评估工作中[8]。Monte Carlo模拟是应用于人体暴露评估的最为广泛的概率评估法,此方法一般先拟合分布,然后进行抽样,可以认为是从总体中抽样,能够有效地量化变异性。美国环境保护署在风险分析政策中将其定为风险分析基本方法[9],概率暴露评估是使用概率模型表现群体中不同风险等级可能性或表征暴露评估中的不确定性,应用随机(概率)模型建立和分析风险的不同情形[10-12]。由于概率评估的结果能反映风险分布更为真实的情况,因此Monte Carlo方法越来越多地应用到食品安全风险分析中[13-14]。
健康风险评估过程中将有毒物质分为基因毒物质和躯体毒物质,其中基因毒性物质包括放射性污染物和致癌性化学物,躯体毒物质为非致癌性有毒化学物质,根据有毒物质的类别,评价模型分为化学致癌物风险模型、非化学致癌物风险模型和放射性物质风险模型[15-17]。AFM1作为一种遗传毒性致癌物,在风险评估中被视为无阈值化合物,即不存在不产生致癌效应的最小安全剂量(no observed adverse effect level,NOAEL)[18]。2005年,食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)在第64次会议上首次提出了将暴露边界比(margin of exposure,MOE)应用于遗传毒性致癌物风险描述上[19],即用实验动物致癌剂量(或人群致癌剂量)和人群摄入量的比值来描述风险。AFM1除能促进肿瘤的发生外,还具有非致癌毒性,目前国际组织对黄曲霉毒素进行的风险评估还没有建立其健康指导值,但有文献报道了同样具有致肝癌毒性的微囊藻毒素的每日耐受摄入量(tolerable daily intake,TDI)[20-24],评估微囊藻毒素的非致癌健康风险,为AFM1的非致癌健康风险评估提供了参考。
本研究基于液态乳中AFM1污染调查得到的数据和中国居民营养与健康调查数据库中食物消费量和人口学数据,构建暴露评估模型,对消费液态乳对AFM1的暴露水平进行概率评估,并结合欧盟食品安全局(European Food Safety Authority,EFSA)基于人群流行病学数据建立的剂量-反应关系所提出的BMDL10(对照组中出现10%肝癌发生率的95%统计学可信区间下限值)[25]对其产生的致癌风险进行描述,并参考微囊藻毒素的TDI值,设定AFM1的TDI值范围,评估非致癌健康风险,以期为相关部门制定风险管理政策提供科学依据和数据支撑。
1 材料与方法
1.1 材料与试剂
液态乳样品的采集:综合考虑居民日常饮乳习惯及市场消费情况等因素,本研究以不同品种奶源液态乳为研究对象,于2015年12月至2016年5月随机采样,总共采379 个样品,其中,样品A 91 个、样品B 72 个、样品C 72 个、样品D 72 个、样品E 72 个(A、B、C、D、E分别代表液态乳的不同品种,相对应的数值表示该品种液态乳的采样次数)。
AFM1标准品(纯度>99.8%) 以色列Fermentek公司;乙腈、甲醇(色谱纯) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
1100高效液相色谱(high performance liquid chromatography,HPLC)仪(包括数据分析平台、荧光检测器) 美国Agilent公司;AFM1免疫亲和柱(柱容量100 ng) 北京华安麦科有限公司;超纯水仪 美国Thermo公司。
1.3 方法
1.3.1 样品制备
根据GB 5413.37—2010《食品安全国家标准 乳和乳制品中黄曲霉毒素M1的测定》测定样品乳中的AFM1含量,精确量取50 mL液态乳样品,置于离心管中,于35 ℃恒温水浴锅中温浴15 min。10 ℃、6 000 r/min离心10 min,恢复至室温。量取40 mL上清液分次转移到气控操作架上20 mL注射器中,调节压力,控制试样以2~3 mL/min稳定的流速过柱,直至2~3 mL空气通过柱体。向上述注射器内加入10 mL水,以稳定的流速洗柱,弃去全部流出液,并使2~3 mL空气通过柱体。准确加入2.0 mL乙腈至上述注射器,以1~2 mL/min稳定流速将亲和柱上的AFM1洗脱下来,收集全部洗脱液于锥形管中。然后用氮气在30 ℃下将洗脱液蒸发至体积50 µL,再用水定容到1 mL,过0.22 μm微孔过滤器后转移至样品瓶,供HPLC分析。
1.3.2 HPLC检测条件
色谱柱:C18柱(250 mm×4.6 mm,5 μm);流动相:25%乙腈水溶液;流速1.0 mL/min;荧光检测器:发射波长360 nm、激发波长440 nm;柱温30 ℃。
1.3.3 风险评估方法
1.3.3.1 暴露评估模型的构建
本研究基于Monte Carlo模拟和Bootstrap抽样技术,采用概率评估方法构建暴露评估模型。参照美国环境保护署(United States Environmental Protection Agency,US EPA)发布的化学污染物健康风险评估模型,采用日暴露量(chronic daily intake oral,CDIoral)模拟评估居民饮用液态乳暴露AFM1的水平[26]。CDIoral根据公式(1)计算。
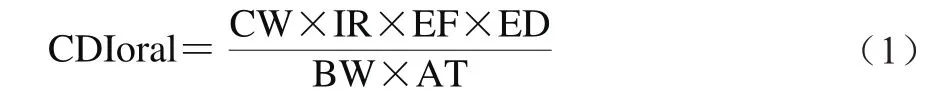
式中:CDIoral为居民消费液态乳对AFM1的日吸收量/(µg/(kg•d));CW为液态乳中AFM1的含量/(μg/kg);IR为日均摄入量;EF为暴露频率(365 d/年);ED为暴露持续时间(70 年);AT为平均时间(70×365 d);BW为人群平均体质量/kg[27]。
1.3.3.2 风险描述模型的构建
基因毒性致癌物的风险描述模型:AFM1能诱发p53基因特定密码子的碱基突变,从而诱发癌变,为基因毒性致癌物[28]。基因毒性致癌物为无阈值化合物,即不存在NOAEL。因此,本研究将MOE应用于基因毒性致癌物的风险描述,根据CDIoral模拟评估,应用MOE对液态乳中AFM1进行风险描述[18],MOE根据公式(2)计算。

式中:P O D为致癌效应分离点(p o i n t o f departure),基于人群流行病学数据确定的数据中,参考EFSA建立的剂量-反应关系,BMDL10(对照组中出现10%肝癌发生率的95%统计学可信区间下限值)为0.87(µg/(kg•d))[25]。MOE≥100,表示液态乳中AFM1的致癌风险是可以接受的;MOE<100,表示液态乳中AFM1的致癌风险超过了可以接受的限度,应当采取适当的风险管理措施。
躯体毒性致癌物的风险描述模型:AFM1除了具有促进肿瘤发生的毒性外,还具有皮肤致敏、免疫抑制等有害作用[29],本研究以危害指数(hazard index,HI)来表征液态乳中AFM1对居民的非致癌风险。世界卫生组织(World Health Organization,WHO)对AFM1的ADI值并未作出规定,根据USEPA规定,在未规定ADI值情况下,其值可用TDI代替。本研究以同为致肝癌毒素的微囊藻的TDI(0.04 µg/(kg•d))为参考[20],设定AFM1的TDI值分别为0.005、0.010、0.020、0.040、0.060 µg/(kg•d),根据公式(3)分别计算居民的HI[18]。

HI>1,表示液态乳中AFM1的非致癌风险是可以接受的;HI<1,表示液态乳中AFM1的非致癌风险超过了可以接受的限度,应当采取适当的风险管理措施。
1.4 数据统计分析
1.4.1 风险评估软件
以上模拟抽样过程在美国Palisade公司的基于Monte Carlo模拟技术的@Risk7.0专业风险分析软件环境下运行,且评估中使用的各种参数对应的概率分布采用@Risk7.0提供的标准分布函数来显示。
1.4.2 风险评估相关数据处理
低于检测限的AFM1污染数据按照WHO和US EPA建议的数据处理方法,即1/2检出限替换处理[7]。采用SPSS 13.0统计软件的单因素方差分析比较差异显著性。每个液态乳样品平行测定3 次,用Excel 2013计算结果。
变异系数又称“标准差率”,是衡量不同液态乳中各观测值变异程度的一个统计量,采用标准差与平均值的比值(相对值)来表示。
2 结果与分析
2.1 HPLC检测液态乳中AFM1

图1 AFM1标准品(a)与液态乳样品(b)的HPLC图Fig.1 HPLC chromatogram of AFM1 standard (a) and milk samples (b)
AFM1标准品及不同乳源液态乳样品通过HPLC检测的色谱图如图1,AFM1标准品的出峰时间为5.7 min,以此做定性分析。
2.2 液态乳中AFM1污染的时间分布
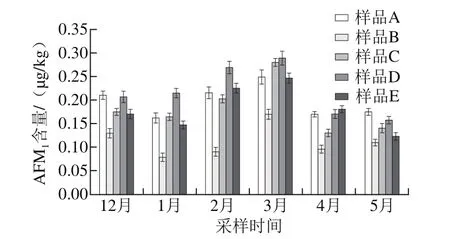
图2 液态乳中AFM1污染的时间分布Fig.2 Temporal distribution of AFM1 concentrations in contaminated milk
由图2可知,从2015年12月开始,液态乳样品中AFM1含量逐渐上升,到次年3月份升到最高,随后略有下降。这是因为3月份为南方的回南天,气候温暖、湿度大,适合黄曲霉菌的大量繁殖,到4~5月份后,温度逐渐升高,天气炎热干燥,AFM1的污染程度略微下降。对于不同奶源液态乳来说,样品D的污染水平较高,A和C相当,B的污染水平最低。
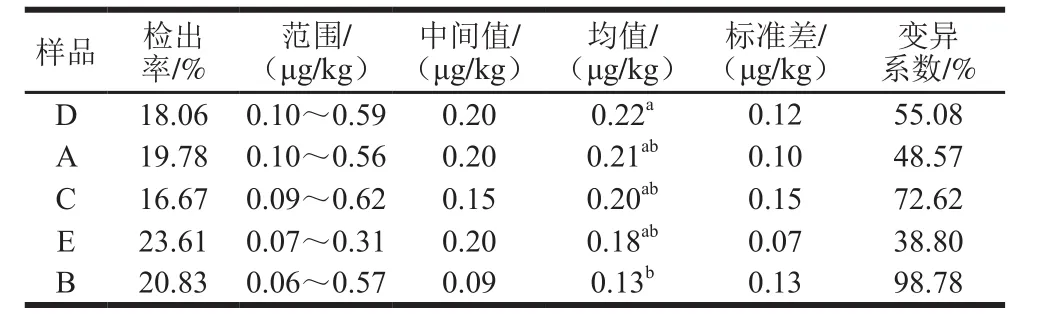
表1 液态乳中AFM1的污染水平比较Table1 Comparison of AFM1 levels in milk samples
由表1可知,样品C中AFM1污染水平范围明显宽于其他品牌的液态乳,最大污染水平达到0.62 μg/kg;样品B、D、A污染水平范围次之;E液态乳污染水平范围最窄(污染水平较集中),仅为0.07~0.31 μg/kg。不同奶源液态乳中AFM1的污染平均值经单因素方差分析表明,样品D与B的污染水平差异显著。
2.3 液态乳中AFM1的暴露评估
2.3.1 液态乳中AFM1污染水平的分布拟合
利用基于Monte Carlo模拟技术的@Risk7.0软件对不同液态乳中AFM1污染水平监测数据进行分布拟合。结果显示,AFM1污染数据比较符合Pareto、Expon、Laplace等分布类型。运用@Risk7.0软件自带的赤池信息量准则(Akaike’s information criterion,AIC)、贝叶斯信息准则(Bayesian information criterions,BIC)、Chi-Squared、Anderson-Darling和Kolmogorov-Smirnov统计检验方法对上述分布的拟合度进行检验。
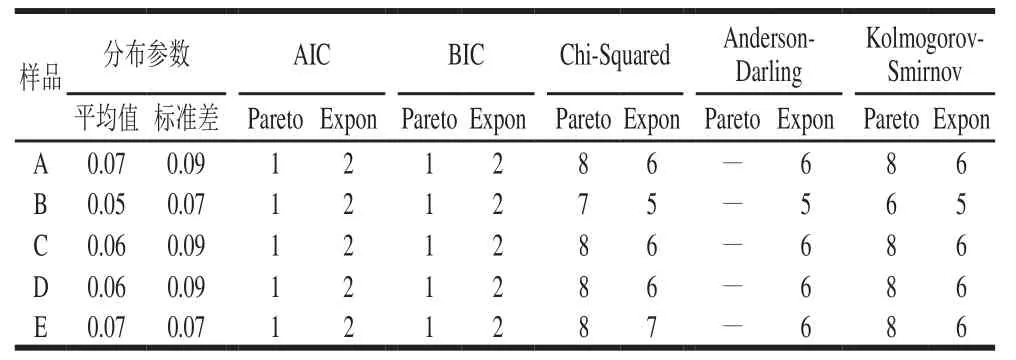
表2 5 个样品液态乳中AFM1最佳拟合分布及相关参数Table2 Optimum fitting distribution of AFM1 concentrations in five milk samples and related parameters
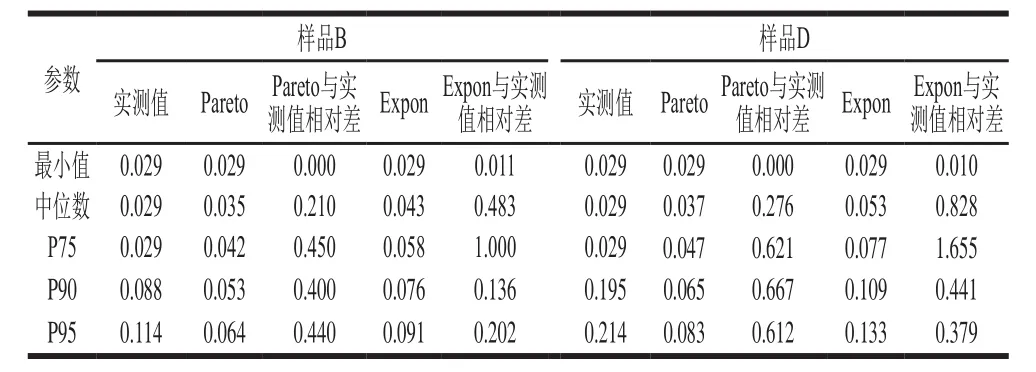
表3 两种理论分布对样品分布拟合的相关参数Table3 Parameters of two theoretical distribution models for milk sample
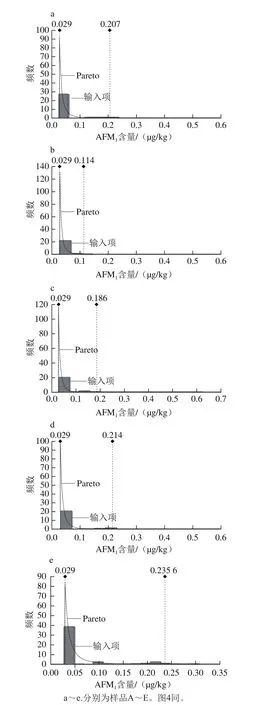
图3 不同液态乳中AFM1含量数据分布拟合的概率密度曲线Fig.3 Probability density curve for distribution fitting of AFM1 concentration in different milk samples
综合考虑拟合结果(表2),确定样品中AFM1污染数据最佳概率拟合分布类型有Pareto和Expon分布。基于样品B、D的污染水平达显著差异,以此为例,拟合后各参数值比较结果见表3,Pareto比Expon更适合液态乳样品的分布。因此,5 个样品分布分别记为Risk Pareto(2.661 5,0.029)、Risk Pareto(3.765 2,0.029)、Risk Pareto(3.370 8,0.029)、Risk Pareto(2.854 6,0.029)和Risk Pareto(2.423 5,0.029)(图3)。
2.3.2 居民消费不同液态乳AFM1的日均暴露量计算
采用1.3.3.1节中确定的液态乳中AFM1污染水平的暴露模型,结合相关的暴露参数,利用@Risk7.0风险分析软件,分别随机从不同样品液态乳中AFM1的污染水平分布中抽取数值计算AFM1膳食暴露量概率分布,每次模拟过程迭代10 000 次,暴露结果如图4所示。
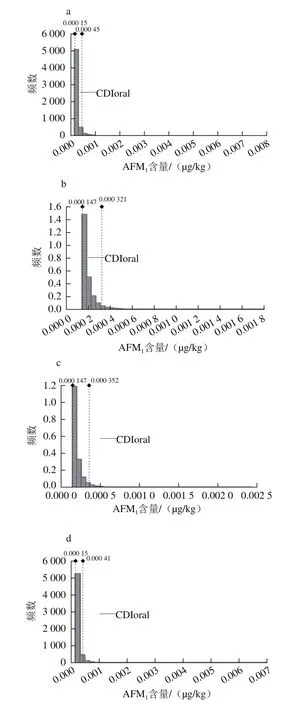
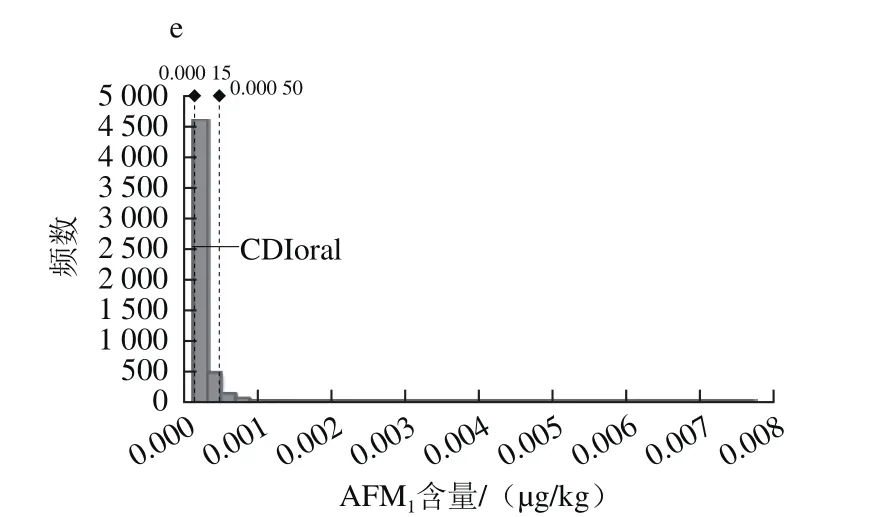
图4 饮用液态乳途径的AFM1日均暴露量概率分布Fig.4 Probabilistic distribution of average daily intake of AFM1 through milk consumption
百分位数是个类似平均值的统计学概念,是把所有数值从小到大排列后,按照百分数进行划分(表4),百分位数10%表示整个暴露量区间从低到高至数据10%时的暴露量,依次类推,100%即最高暴露量的位点。暴露评估的结果显示,消费不同液态乳途径的AFM1日暴露量的平均值依次为0.000 23、0.000 20、0.000 21、0.000 22、0.000 25 µg/(kg·d),中位数依次为0.000 19、0.000 17、0.000 18、0.000 18、0.000 19 µg/(kg·d),第99百分位数的AFM1暴露量分别为0.000 82、0.000 49、0.000 57、0.000 73、0.000 97 µg/(kg·d),其他百分位数概率下的暴露量如表4所示。
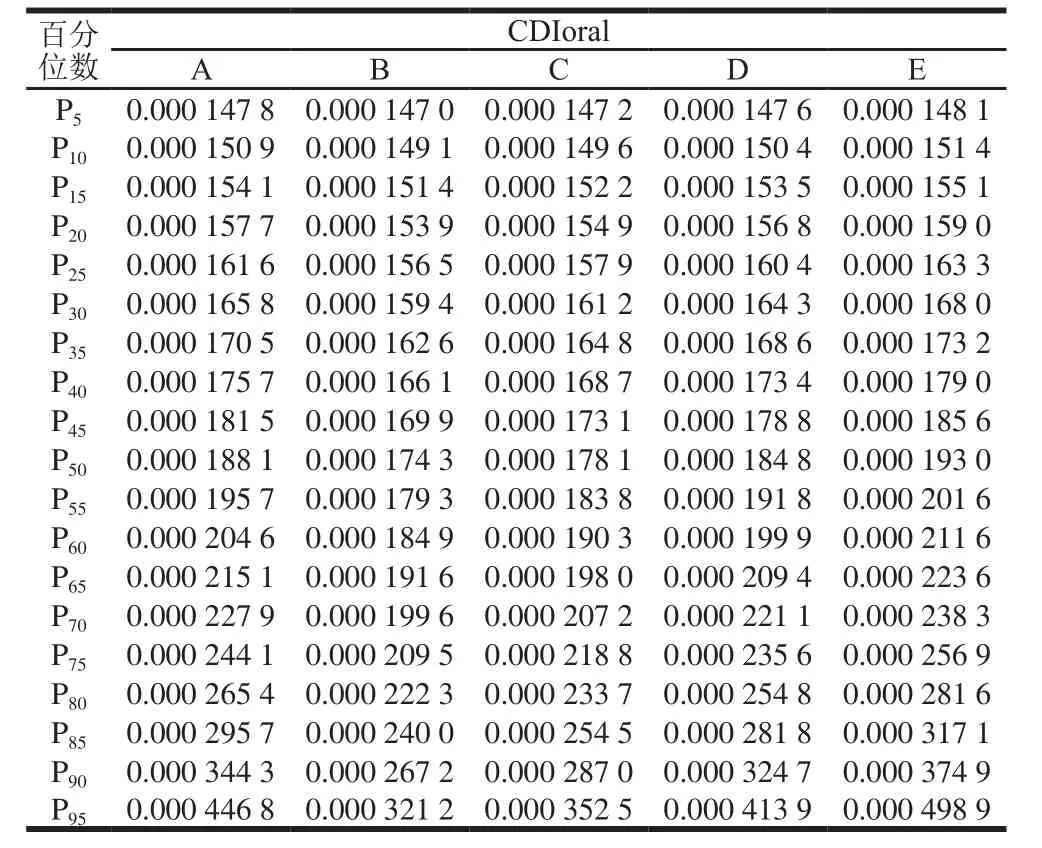
表4 居民日饮用液态乳途径AFM1暴露量百分位数值Table4 Average daily intake of AFM1 from milk products
2.4 样品E中AFM1的风险描述
2.4.1 样品E中AFM1的致癌性风险描述
由2.3.2节中AFM1分别在不同样品液态乳中的日均暴露量来看,饮用样品E液态乳的日均暴露量在各个百分位数均高于其他液态乳样品。因此本研究以样品E为例进行风险描述。采用1.3.3.2节中致癌性风险的计算公式,结合暴露参数,利用@Risk软件,分别随机从样品E液态乳中AFM1污染水平分布中抽取数值计算不同人群消费样品E液态乳暴露AFM1的致癌性风险概率,每次模拟循环10 000次,风险评估结果如表5所示。

表5 不同人群通过样品E液态乳暴露AFM1致癌性风险Table5 Carcinogenic risk associated with dietary exposure to AFM1 from milk sample E for different populations
根据表5结果,不同人群消费样品E液态乳暴露AFM1的致癌性风险值MOE均大于100,说明在抽样检测的时间段内,不同人群通过饮用液态乳暴露AFM1对健康的致癌性风险很小。对于样品E液态乳,不同人群间致癌性风险评估经t检验表明,结果存在极显著差异(t=0.000 1<0.01)。不同年龄组人群中,幼儿(2~3、4~6 岁)和儿童(7~13 岁)3 个年龄组人群由于体质量较轻,而液态乳摄入量相对较高,致癌性风险明显高于其他年龄组人群,需重点关注;青少年(14~17 岁)和60岁以上的老年人的致癌性风险相当;18~59 岁的成年人的致癌性风险最小。对于不同地域的人群,城市居民通过液态乳摄入AFM1的致癌性风险值均显著高于农村人群,是由于城市居民的饮奶量远高于农村人群。而对于不同性别的人群,由于男性在体质量和液态乳摄入量方面均高于女性,经配对样本t检验得两个人群的风险不存在显著差异(t=0.276>0.05)。
2.4.2 样品E中AFM1的非致癌性风险描述
采用1.3.3.2节中AFM1的非致癌性风险模型,计算不同人群消费样品E液态乳暴露AFM1的致癌性风险概率,每次模拟循环10 000 次,风险评估结果如表6所示。
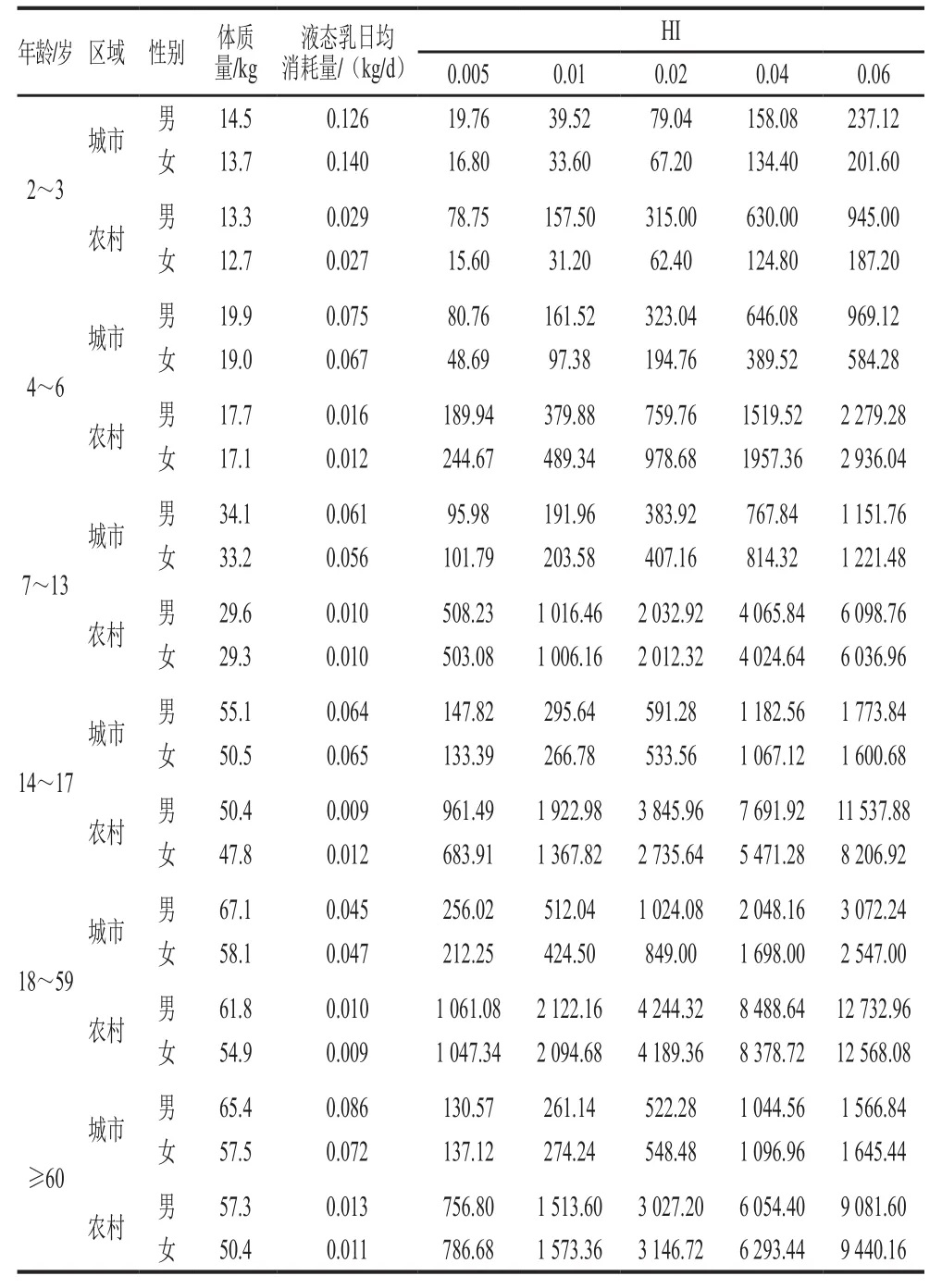
表6 不同人群通过样品E液态乳对AFM1非致癌性风险Table6 Non-carcinogenic health risk associated with dietary exposure to AFM1 from milk sample E for different populations
由表6可知,不同人群饮用样品E液态乳摄入AFM1的非致癌性风险HI值均大于1,(与致癌性风险是相同的),说明在抽样检测的时间段内,通过饮用液态乳摄入AFM1对健康的非致癌性风险很小。在设定的5 个不同水平的TDI值下,非致癌风险最高的农村女幼儿(2~3 岁)HI值为15.60,其他不同人群的HI值均高于显著高于15.60,说明非致癌风险很小。但在特定区域特定状况下对于幼儿和儿童的风险,仍需引起相关部门的高度关注。
3 结 论
本次调查的379 个液态乳样品中,AFM1的检出率为19.79%,平均含量为0.19 µg/kg,最高污染水平为0.62 µg/kg。在检测的不同液态乳样品中,样品E的检出率最高,为23.61%,平均含量为0.18 μg/kg,而样品D的平均污染水平最高,为0.22 μg/kg。样品B的变异系数最大,为98.78%,分布较广泛,样品E的分布最集中,变异系数为38.80%。
在构建液态乳中AFM1暴露评估模型的基础上,结合相关暴露参数,采用基于Monte Carlo模拟技术的@Risk7.0风险评估软件,分别对液态乳中AFM1的污染水平进行分布拟合,并通过5 种拟合度检验,选出拟合最优分布,依次为Risk Pareto(2.661 5,0.029)、Risk Pareto(3.765 2,0.029)、Risk Pareto(3.370 8,0.029)、Risk Pareto(2.854 6,0.029)和Risk Pareto(2.423 5,0.029)。结合相关暴露参数,计算了通过饮用液态乳摄入AFM1的日均暴露量。
运用@Risk软件,分别以MOE和HI值表征饮用液态乳途径的AFM1的致癌性和非致癌性风险。结果表明,不同人群通过饮用不同奶源的液态乳摄入AFM1的致癌性风险值均显著大于100,非致癌风险值在TDI取值0.005 µg/(kg•d)时仍均大于1,在抽样检测的时间段内,仅通过饮用液态乳摄入AFM1对健康的风险很小。
[1] 李胜利, 姚琨, 曹志军, 等. 国家奶业体系: 2015年奶牛产业技术发展报告[J]. 中国畜牧杂志, 2016, 52(2): 34-39.
[2] CAMPAGNOLLO F B, GANEV K C, KHANEGHAH A M, et al. The occurrence and effect of unit operations for dairy products processing on the fate of aflatoxin M1: a review[J]. Food Control, 2016, 68:310-329. DOI:10.1016/j.foodcont.2016.04.007.
[3] SCAGLIONI P T, BADIALE-FURLONG E. Rice husk as an adsorbent: a new analytical approach to determine af l atoxins in milk[J].Talanta, 2016, 152: 423-431. DOI:10.1016/j.talanta.2016.02.042.
[4] FALLAH A A, FAZLOLLAHI R, EMAMI A. Seasonal study of aflatoxin M1contamination in milk of four dairy species in Yazd, Iran[J]. Food Control, 2016, 68: 77-82. DOI:10.1016/j.foodcont.2016.03.018.
[5] 卫生部. 食品中真菌毒素限量: GB 2761-2011[S]. 北京: 中国标准出版社, 2011: 2-4.
[6] MICHLIG N, SIGNORINI M, GAGGIOTTI M, et al. Risk factors associated with the presence of aflatoxin M1in raw bulk milk from Argentina[J]. Food Control, 2016, 64: 151-156. DOI:10.1016/j.foodcont.2015.12.025.
[7] 叶孟亮, 聂继云, 徐国锋, 等. 苹果中4 种常用农药污染水平及其膳食暴露评估[J]. 中国农业科学, 2016, 49(7): 1289-1302.DOI:10.3864/j.issn.0578-1752.2016.07.007.
[8] 白新明. 蔬菜农药残留对人体健康急性风险概率评估研究[J]. 食品科学, 2014, 35(5): 208-212. DOI:10.7506/spkx1002-6630-201405041.
[9] 刘潇威. 农产品中重金属风险评估的研究与进展[J]. 农业环境科学学报, 2007, 26(1): 15-18.
[10] 田文, 裴斐, 文良, 等. 食用油中有机污染物的筛查与风险评估[J].食品科学, 2016, 37(24): 203-208. DOI:10.7506/spkx1002-6630-201624032.
[11] 董庆利. 蒸煮米饭中蜡样芽孢杆菌的定量暴露评估[J]. 食品科学,2013, 34(21): 306-310. DOI:10.7506/spkx1002-6630-201321061.
[12] 杨岳平, 胡长鹰, 李克亚, 等. 毒理学关注阈值方法在食品接触材料风险评估中的应用[J]. 食品科学, 2015, 36(23): 334-339.DOI:10.7506/spkx1002-6630-201523060.
[13] 钱永忠, 李耘, 周德庆, 等. 农产品质量安全风险评估-原理、方法和应用[M]. 北京: 中国标准出版社, 2007: 113-139.
[14] 王永杰, 贾东红. 健康风险评价中的不确定性分析[J]. 环境工程,2003, 21(6): 66-69. DOI:10.13205/j.hjgc.2003.06.022.
[15] US Environmental Protection Agency. Guideline for Exposure Assessment[R]. Washington D.C.: US EPA, 1992.
[16] 陈胜军, 李来好, 杨贤庆, 等. 我国水产品安全风险来源与风险评估研究进展[J]. 食品科学, 2015, 36(17): 300-304. DOI:10.7506/spkx1002-6630-201517055.
[17] 吴黎明, 李耘, 余林生. 蜂产品中有害物暴露评估方法[J]. 食品科学,2011, 32(11): 324-328.
[18] 罗祎. 食品安全风险分析化学危害评估[M]. 北京: 中国质检出版社,2012: 83-90.
[19] World Health Organization. Evaluation of certain food contaminants:sixty-fourth report of the Joint FAO/WHO Expert Committee on Food Additives[J]. WHO Technical Report Series, 2006, 930: 8-25.
[20] 王伟琴. 饮用水源水中微囊藻毒素的遗传毒性与健康风险评价[D].杭州: 浙江大学, 2010: 6-17.
[21] 王超, 彭涛, 吕怡兵, 等. 江南某城市饮用水及其水源水中微囊藻毒素调查及初步健康风险评价[J]. 环境化学, 2014, 33(7): 1237-1238.DOI:10.7524/j.issn.0254-6108.2014.07.027.
[22] 詹晓静, 向垒, 李彦文, 等. 农田土壤中微囊藻毒素污染特征及风险评价[J]. 中国环境科学, 2015, 35(7): 2129-2136.
[23] 杨晓红, 蒲朝文, 张仁平, 等. 水体微囊藻毒素污染对人群的非致癌健康风险[J]. 中国环境科学, 2013, 33(1): 181-185.
[24] 孟元华, 朱鹏飞, 龚燕, 等. 太湖水产品中微囊藻毒素-RR的污染状况及初步健康风险评估[J]. 食品安全质量检测学报, 2016, 7(5):1794-1797.
[25] 白艺珍, 丁小霞, 李培武, 等. 应用暴露限值法评估中国花生黄曲霉毒素风险[J]. 中国油料作物学报, 2013, 35(2): 211-216. DOI:10.7505/j.issn.1007-9084.2013.02.017.
[26] 张建英. 饮用水氯化消毒副产物污染控制技术及健康风险评价的研究[D]. 杭州: 浙江大学, 2006: 52-53.
[27] 金水高. 中国居民营养与健康状况调查报告之十: 2002营养与健康状况数据集[M]. 北京: 人民卫生出版社, 2008: 347-378.
[28] WILLIAMS G M. DNA reactive and epigenetic carcinogens[J].Experimental and Toxicologic Pathology, 1992, 44: 457-463.
[29] ZHANG J, ZHENG N, LIU J, et al. Aflatoxin B1and aflatoxin M1induced cytotoxicity and DNA damage in differentiated and undifferentiated Caco-2 cells[J]. Food and Chemical Toxicology, 2015,83: 54-60. DOI:10.1016/j.fct.2015.05.020.
