超微型大豆皮水不溶性膳食纤维理化及吸附特性
2018-03-20郭增旺刁静静李朝阳全志刚满永刚张丽萍
郭增旺,马 萍,刁静静,2,李朝阳,全志刚,满永刚,张丽萍,2,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319)
膳食纤维对人体具有重要的生理功能,在饮食中增加膳食纤维的含量可减少冠心病的几率;减轻长期大量饮酒对胰脏的损伤[1-3];降低血液中胆固醇的含量;提高肾切除者对氮的排泄功能[4-6];摄取适当比例的水溶性和水不溶性膳食纤维,可以改善肠道的吸收功能、预防结肠癌[7-9]。天然的大豆皮膳食纤维具有明显的生理活性,能够有效地降血糖、降血脂、抗氧化、吸附重金属、促进肠道蠕动等[10-13],但是由于大豆皮粗纤维的韧性较强、口感粗糙,生产利用率极低,导致了功能成分和资源的浪费。目前对于大豆皮中膳食纤维的加工利用,国内只有少量报道。与国外相比我国对于大豆皮的利用还没有足够的重视,对其深度开发利用的研究还很少,几乎还都停留在饲料的加工方面。因此,从大豆皮中提取纤维素并对其进行加工改性处理,对大豆皮的深加工和经济效益有重要意义。
目前,大豆皮的改性处理方式主要包括酶改性、磷酸盐处理、细粉化处理等技术[14-15],但因成本高、改性后加工特性不良等缺陷并未形成产业化。相关研究表明,超微化可以改善颗粒的润湿性、粒度、比表面积、孔隙率并促进对有效成分的吸收[16]。到目前为止,国内外关于大豆皮膳食纤维粉碎改性处理只做到了细化,并没有将粒径与理化功能特性进行量化分析。因此,本研究将采用不同程度的超微粉碎对大豆皮纤维进行加工处理,通过研究不同粒度的大豆皮水不溶性膳食纤维理化及吸附功能特性分析,为大豆皮在食品加工领域更好地发挥膳食纤维作用提供理论参考。
1 材料与方法
1.1 材料与试剂
大豆皮水不溶性膳食纤维由国家杂粮技术研究中心实验室自制。
氢氧化钾、乙醇、无水乙醚、硫酸钾、盐酸、浓硫酸、胆固醇、胆酸钠、邻苯二甲醛、无水乙醇、硝酸银、冰醋酸、硫酸、糠醛(均为分析纯) 天津广成化学试剂有限公司;D-无水葡萄糖(纯度≥98) 大连美仑生物技术有限公司;硝酸铅、硫酸铜、硫酸镉、硫酸锌(均为分析纯) 天津大茂试剂有限公司;鸡蛋、花生油 市售;猪油由国家杂粮技术研究中心实验室自制。
1.2 仪器与设备
QYF-50型气流粉碎机 昆山市密友集团;JW-BK200A多功能双站全自动比表面及孔径分析仪北京精微高博有限公司;53WB-紫外分光光度计、WSB-L型白度仪 上海精密科学仪器有限公司;NDF-7型旋转黏度计 天津永利达实验室设备有限公司;分析天平、摇床、移液枪、恒温水浴箱、离心机、搅拌器 上海申生科技有限公司。
1.3 方法
1.3.1 超微型大豆皮水不溶性膳食纤维的制取
称取一定量大豆皮,45 ℃温水浸泡两次,烘干粉碎,过40 目。按1∶25(m/V)的比例加蒸馏水,搅拌振荡至样品完全分散后,加入50 μL/g蛋白酶液混匀,调节pH值至7.0,50 ℃水浴恒温振荡器中反应2.5 h,反应完毕后7 000 r/min离心10 min,弃上清液,再采取4 g/100 mL的NaOH溶液进行碱解0.5 h后,清水冲洗至中性,沉淀干燥,粉碎过80 目筛,即得到大豆皮水不溶性膳食纤维[17]。将大豆皮水不溶性膳食纤维在频率100、150、200、250、300 Hz条件下进行气流粉碎,得到超微型大豆皮水不溶性膳食纤维,分别为IDF-a、IDF-b、IDF-c、IDF-d、IDF-e。
1.3.2 理化性质测定
1.3.2.1 粒度及比表面积测定
采用激光粒度测定仪和双通道全自动比表面积分析仪测定粒度和比表面积。
1.3.2.2 持水力测定
取1.0 g超微型大豆皮水不溶性膳食纤维于50 mL离心管内,加入40 mL蒸馏水,室温存放24 h后,4 000 r/min离心30 min,倒掉上清液,记录湿质量(ma),105 ℃干燥箱烘干至恒质量,记录干质量(mb)。持水力计算公式如式(1)所示。
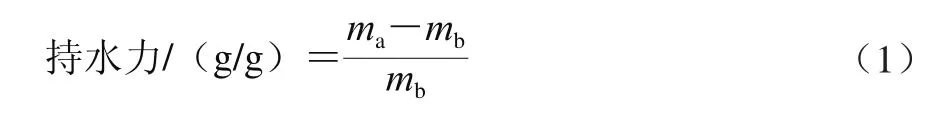
式中:ma为沉淀质量/g;mb为样品干质量/g。
1.3.2.3 持油力的测定
将150 mm Grade54型号定量滤纸置于花生油中浸泡20 min,取出悬挂30 min至无油滴滴出且质量恒定(ma);取0.2 g超微型大豆皮水不溶性膳食纤维(m),用已吸油至恒质量的定量滤纸包裹,于花生油中浸泡20 min,取出悬挂3 h至无油滴滴出且质量恒定(mb)。持油力计算公式如式(2)所示。
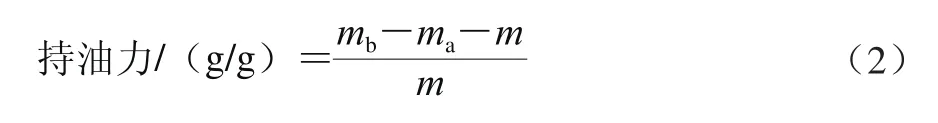
式中:ma为浸油后滤纸质量/g;mb为浸油后滤纸和样品总质量/g;m为样品质量/g。
1.3.2.4 白度的测定
采用白度仪进行测定。
1.3.2.5 黏度的测定
配制质量分数为2%、5%、10%、15%的超微型大豆皮水不溶性膳食纤维悬浊液,搅拌1 h后,采用NDF-7型旋转黏度计测定黏度。
1.3.2.6 阳离子交换能力的测定
称取1.0 g的超微型大豆皮水不溶性膳食纤维,加入30 mL的0.1 mol/L的HCl溶液,浸泡24 h后过滤,蒸馏水洗至中性,10%的硝酸银溶液滴定滤液,直到不含氯离子为止(无白色沉淀产生),取0.25 g处理过的样品加入到100 mL的15 g/100 mL NaCl溶液中,用磁力搅拌机搅拌均匀后,每次用0.2 mL 的0.1 mol/L NaOH溶液进行滴定,记录对应的pH值,直到pH值变化很小为止,根据得到的数据作V(NaOH)与pH值关系图[17]。
1.3.3 超微型大豆皮水不溶性膳食纤维吸附能力的测定
1.3.3.1 对油脂吸附作用的测定
对不饱和脂肪的吸附作用测定:取3.0 g(m1)超微型大豆皮水不溶性膳食纤维,加食用花生油24 g,37 ℃放置2 h,4 000 r/min离心15 min,弃掉上层油脂,沉淀用滤纸吸去游离的花生油,称质量得到m2。对不饱和脂肪吸附能力计算公式如式(3)所示。
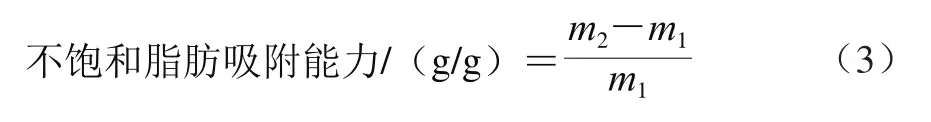
式中:m1为样品质量/g;m2为沉淀质量/g。
对饱和脂肪吸附作用的测定:取3.0 g(m1)超微型大豆皮水不溶性膳食纤维,加猪油24 g,37 ℃放置2 h,在4 000 r/min的条件下离心15 min,弃掉上层油脂,沉淀用滤纸吸去游离的花生油,称质量得到m3。对饱和脂肪吸附能力计算公式如式(4)所示。
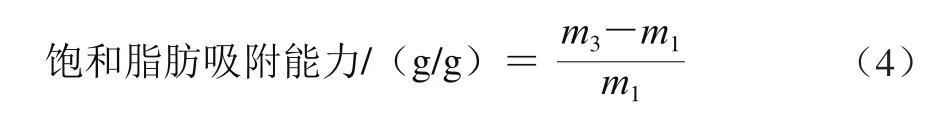
式中:m1为样品质量/g;m3为沉淀质量/g。
1.3.3.2 对胆固醇吸附作用的测定
胆固醇含量的标准曲线制作:取0、1、2、3、4、5 mL的1 mg/mL胆固醇标准溶液,冰乙酸对应补足至5 mL,混匀后加入OPA试剂(10 mg邻苯二甲醛溶于乙酸,定容至100 mL配制成)15 mL和浓硫酸10 mL,配制时边加浓硫酸边振荡,充分混匀,室温静置10 min,测定OD550nm,绘制标准曲线。
对胆固醇吸附能力的测定:取新鲜鸡蛋的蛋黄,加入9 倍体积的蒸馏水充分打制成乳液。取5种2.0 g超微型大豆皮水不溶性膳食纤维,加50 g搅打完成的蛋黄乳液,搅拌均匀,调节pH值至2.0和7.0,37 ℃恒温振荡2 h,4 000 r/min离心20 min,取上清液,采用邻苯二甲醛法在550 nm波长处测定光密度值,根据标准曲线计算上清液中的胆固醇质量[9]。吸附能力计算公式如式(5)所示。
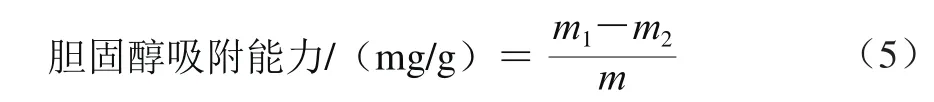
式中:m1为吸附前蛋黄乳液的胆固醇质量/mg;m2为吸附后上清液中胆固醇质量/mg;m为超微型大豆皮水不溶性膳食纤维质量/g。
1.3.3.3 对胆酸钠吸附作用的测定
胆酸钠含量标准曲线的制作:取不同质量浓度的胆酸钠标准溶液1 mL于50 mL具塞试管中,加体积分数45%盐酸溶液6 mL,混合均匀后,加入1 mL体积分数0.3%的糠醛溶液混匀,65 ℃水浴加热30 min,冷却至室温后测定OD620nm,绘制标准曲线。
对胆酸钠吸附能力的测定:取0.2、0.3 g胆酸钠,分别加入15 mmol/L的NaCl溶液100 mL,调pH值至7.0,加超微型大豆皮水不溶性膳食纤维1.0 g并混合均匀,37 ℃恒温振荡2 h,4 000 r/min离心20 min,取上清液测定胆酸钠质量[9]。吸附能力计算公式如式(6)所示。
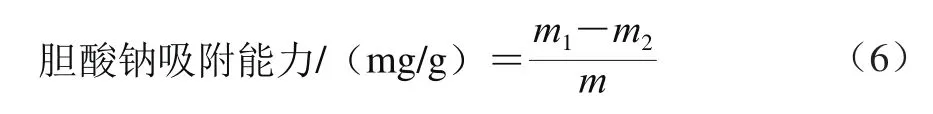
式中:m1为吸附前溶液的胆酸钠质量/mg;m2为吸附后上清液中胆酸钠质量/mg;m为超微型大豆皮水不溶性膳食纤维质量/g。
1.3.3.4 对葡萄糖吸附作用的测定
取1.0 g超微型大豆皮水不溶性膳食纤维(m),加入100 mL浓度c0为5、10、50、100 mmol/L的葡萄糖溶液,37 ℃搅拌6 h,4 000 r/min离心20 min,取上清液测定葡萄糖浓度c1,按照式(7)计算葡萄糖的吸附能力。
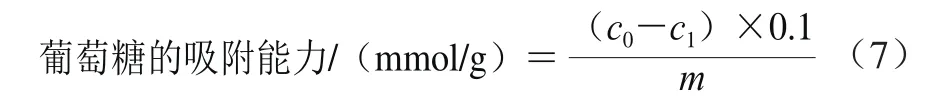
式中:c0为吸附前葡萄糖浓度/(mmol/L);c1为上清液葡萄糖浓度/(mmol/L);m为超微型水不溶性膳食纤维质量/g。
1.3.3.5 对重金属吸附能力的测定
硝酸铅、硫酸铜、硫酸铬和硫酸锌溶液分别按照参考文献[18]配制,各重金属离子质量浓度为1 mg/mL。准确称取1.0 g超微型大豆皮水不溶性膳食纤维,加入100 mL的1 mg/mL重金属溶液,分别调节pH值至2.0和7.0,37 ℃恒温振荡3 h,4 000 r/min离心20 min,采用原子吸收分光光度计测定溶液中的重金属含量,根据反应前后含量差计算吸附能力。
1.3.4 扫描电子显微镜分析
分别对IDF-a、IDF-c、IDF-d进行500 倍扫描电子显微镜分析,观察不同粉碎程度的膳食纤维形貌特征。
1.4 数据处理
所有数据均为5 次平行实验测定的平均值,用SPSS 19.0版本统计软件包进行统计学处理数据并进行单因素方差分析。
2 结果与分析
2.1 超微型大豆皮水不溶性膳食纤维理化特性
2.1.1 粒度与比表面积
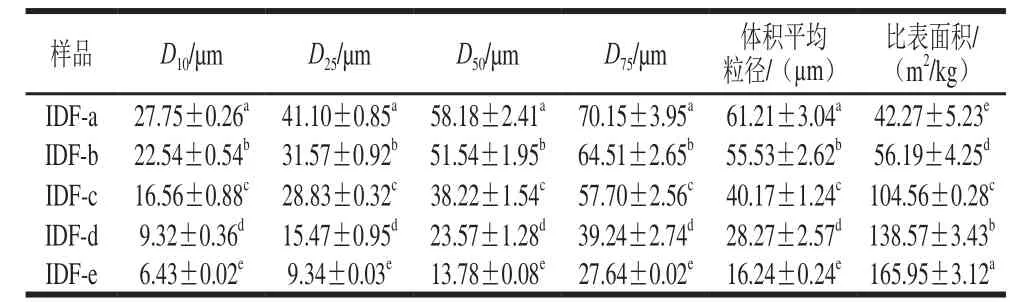
表1 超微型大豆皮水不溶性膳食纤维的粒度与表面积Table1 Particle sizes and specific surface areas of ultramicro insoluble dietary fiber from soybean hull
由表1可以发现经过超微粉碎处理的大豆皮水不溶性膳食纤维D50、体积平均粒径、比表面积均显著改变。随着粉碎功率的增大,膳食纤维所受到的剪切力越大,粉碎程度越高,粒径分布越集中。颗粒的微粉化使得比表面积和孔隙率均显著增大,功能性和口感均可得到改善[19]。经过微粉化的大豆皮水不溶性膳食纤维不再具有粗糙的颗粒感,能广泛地应用于各类食品和保健品中。
2.1.2 白度、持水力、持油力

表2 超微型大豆皮水不溶性膳食纤维的白度、持水力、持油力Table2 Whiteness and water- and oil-holding capacity of ultramicro insoluble dietary fiber from soybean hull
由表2可知,IDF-e的持水力、持油力最高,分别为2.31、5.27 g/g,比IDF-a分别提高了1.07、2.53 g/g,持水力和持油力的上升幅度和粒度及比表面积的变化趋势相似,并均高于酶解及细粉改性的大豆皮膳食纤维[17,20]。随着粒度的减小、比表面积的增大,引起反射因数的增大,导致白度随之增大。粉碎程度越大,粒度越小,更多的亲水、亲油基团暴露出来;并且比表面积增大,与水及油的接触面积也相应增大,持水力和持油力均显著提高。
2.1.3 黏度
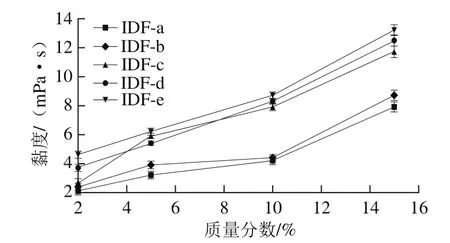
图1 超微型大豆皮水不溶性膳食纤维的黏度曲线Fig.1 Viscosity curves of ultramicro insoluble dietary fi ber from soybean hull soybean hull soybean hull
图1 反映的是超微型大豆皮水不溶性膳食纤维的黏度变化。随着超微型大豆皮水不溶性膳食纤维质量分数的增大和粒度的减小,黏度均有一定程度上升。IDF-a和IDF-b差异不显著,IDF-c、IDF-d和IDF-e三者差异不显著,但IDF-a、IDF-b和IDF-c、IDF-d、IDF-e两组之间差异显著。溶液中膳食纤维粒度越小,比表面积越大,暴露的基团越多,导致其分子间力越大和结构越紧密,变形所需的剪切力越大,引起黏度增大[21];而IDF-a和IDF-b两者的比表面积小,分子结构和分子间作用力差异不大,导致两者黏度差异不显著。
2.1.4 阳离子交换能力
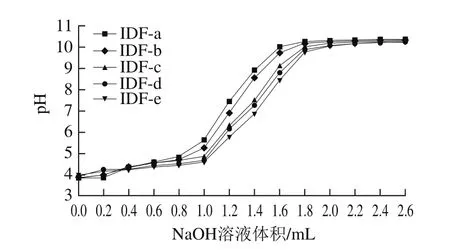
图2 超微型大豆皮水不溶性膳食纤维阳离子交换能力Fig.2 Cation exchange capacity of ultramicro insoluble dietary fi ber from soybean hull
图2 反映的是超微型大豆皮水不溶性膳食纤维的阳离子交换能力。不同粒度的超微型大豆皮水不溶性膳食纤维阳离子交换能力不同,随着粒度的减小,其阳离子交换能力反而增强,IDF-a、IDF-b两者差异不显著,IDF-c、IDF-d、IDF-e三者差异不显著,但是两组之间的差异显著。NaOH溶液的消耗量达到1.8 mL时,溶液的pH值趋于稳定,阳离子交换能力基本达到平衡。膳食纤维的分子结构均带有一些侧链基团,这些侧链基团含有些羧基和氨基,可以起到弱酸性阳离子交换作用,与阳离子实现可逆交换[20,22]。超微粉碎处理后,膳食纤维的比表面积增大,粒度减小,使更多能进行有机阳离子交换的基团暴露出来,弱酸性表现更明显,阳离子交换能力越强,呈现出一种能维持pH值稳定和离子浓度平衡的作用。当膳食纤维被摄入到机体内,能起到维持机体胃肠道的pH值,为渗透压和化学反应提供缓冲环境,增加其机体消化吸收能力的作用[20,23],并能与Ca2+、Zn2+等阳离子结合,使Na+与K+交换,并吸附Na+,使之随粪便排出体外,降低因Na+摄入过量而引起的许多疾病的发生率。
2.2 超微型大豆皮水不溶性膳食纤维的吸附特性
2.2.1 对油脂的吸附作用
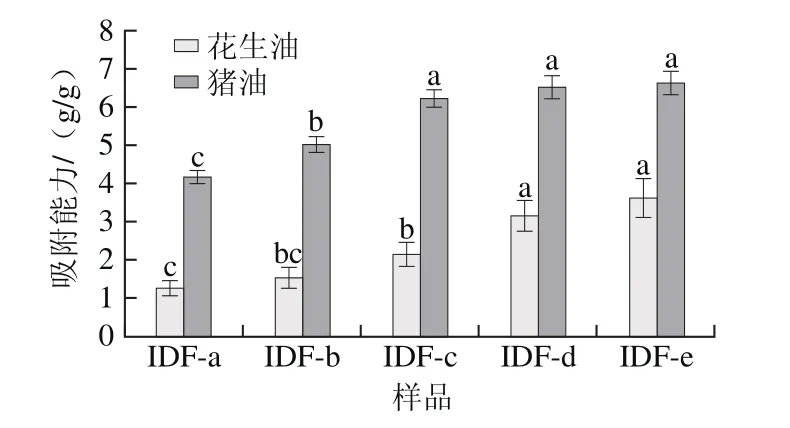
图3 超微型大豆皮水不溶性膳食纤维对油脂吸附能力Fig.3 Oil and fat-absorbing capacity of ultramicro insoluble dietary fi ber from soybean hull
图3 反映的是超微型大豆皮水不溶性膳食纤维对油脂的吸附能力。大豆皮水不溶性膳食纤维粒度越小,对猪油和花生油的吸附能力越强,并且对猪油的吸附能力明显高于花生油。通过显著性分析发现,体积平均粒径低于28 μm时对花生油的吸附能力差异不显著;体积平均粒径低于40 μm时对猪油的吸附能力差异不显著。由于不饱和脂肪分子结构具有双键电子云空间位阻的效果[24],导致其吸附能力下降,当粒度减小到一定程度时,单个分子的体积同样会减小,其整体吸附油脂的能力也会相应减弱。当粒度降低到一定程度后,对花生油、猪油的吸附能力基本不再增加。本实验进行模拟体外消化,表明超微型大豆皮水不溶性膳食纤维具有吸附花生油、猪油的特性,能降低肠道对花生油、猪油的吸附作用。
2.2.2 对胆固醇的吸附作用
通过实验可以得到胆固醇质量浓度与光密度值之间的标准曲线回归方程为y=1.778 5x+0.017 3,R2=0.998 2,说明OD值与胆固醇质量浓度具有良好的正相关性。
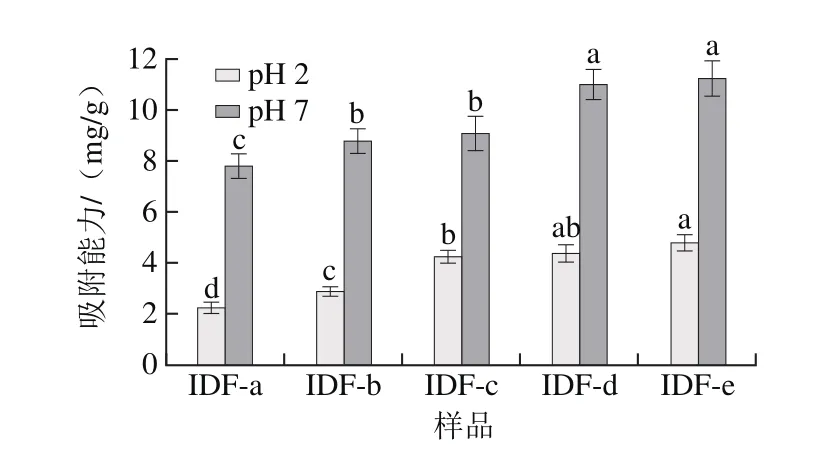
图4 超微型大豆皮水不溶性膳食纤维对胆固醇吸附能力Fig.4 Cholesterol-absorbing capacity ultramicro insoluble dietary fi ber from soybean hull
胆固醇是心血管疾病的诱发因子,而膳食纤维具有降低血脂、胆固醇的功能。膳食纤维可在小肠内壁形成黏性溶液或带功能基团的黏膜层,这层黏膜层可成为甘油三脂和胆固醇在小肠内壁的吸收限制性屏障;另一方面膳食纤维可通过形成凝胶吸附胆酸,造成胆酸减少,使机体利用胆固醇合成胆酸,增加胆固醇的去路、降低血清胆固醇质量浓度。由图4可知,超微型大豆皮水不溶性膳食纤维对胆固醇的吸附能力受粒度和pH值环境影响较大,在中性环境下的吸附能力明显高于酸性环境,这也表明在模拟小肠环境比在模拟胃的酸性环境对胆固醇的吸收能力更强。经过微粉化后,膳食纤维的表面更加粗糙,结构相对疏松,导致其毛细管作用更加明显,更易形成黏膜层和凝胶,从而增强对胆固醇吸附作用[25]。
2.2.3 对胆酸钠的吸附作用
通过实验可以得到胆酸钠质量浓度与光密度之间的标准曲线回归方程为y=0.740 3x+0.008 2,R2=0.997,说明OD值与胆酸钠质量浓度具有良好的正相关性。
胆汁酸由肝脏内合成并在胆囊中储存,在食物刺激下从胆囊中进入小肠,参与肝肠循环起到调节胆固醇代谢的作用。由图5可知,膳食纤维对胆酸钠的吸附作用受粒度和质量浓度影响较大,其吸收能力随着粒度的减小先升高后趋于稳定稍有下降;胆酸钠质量浓度越高,吸附量越大,这表示膳食纤维对胆酸盐的吸附能力存在动态平衡[26]。当体系的胆酸盐质量浓度很高时,表现出较高的吸附能力,降低肠道中胆酸的再次吸收,加快胆固醇的分解,起到降低血清和肝中的胆固醇含量的作用,并且也降低了胆汁酸在肠道菌群的作用下产生的致癌次级代谢产物,可以预防结肠癌;而当体系的质量浓度相对较低时,其吸附能力亦较低,从而维持食物中胆固醇的正常代谢,保证机体的正常生理活动。
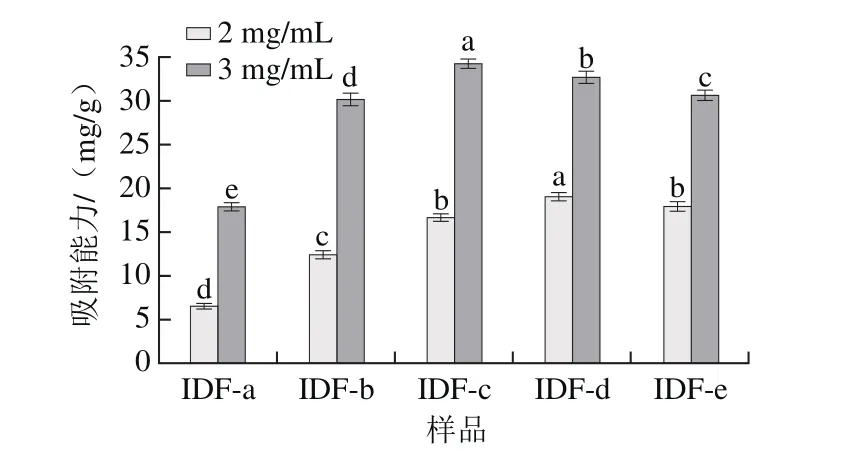
图5 超微型大豆皮水不溶性膳食纤维对胆酸钠吸附能力Fig.5 Adsorption capacity for sodium bile acid of ultramicro insoluble dietary fi ber from soybean hull
2.2.4 对葡萄糖的吸附作用
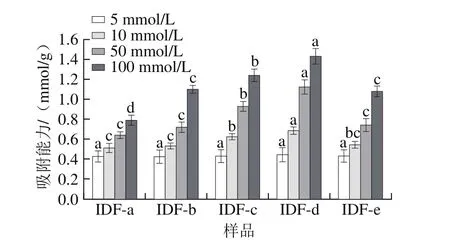
图6 超微型大豆皮水不溶性膳食纤维对葡萄糖吸附能力Fig.6 Glucose adsorption capacity of ultramicro insoluble dietary fi ber from soybean hull
图6 显示了超微型大豆皮水不溶性膳食纤维对葡萄糖的吸附能力。随着粒度的减小、溶液浓度的升高,超微型大豆皮水不溶性膳食纤维对葡萄糖的吸附能力均呈现增大的趋势;在葡萄糖浓度为5 mmol/L时,不同粒度超微型大豆皮水不溶性膳食纤维的吸附能力无显著性差异,几乎为全吸收,随后升高葡萄糖浓度,不同粒度超微型大豆皮水不溶性膳食纤维的吸附能力先升高后下降。当葡萄糖浓度越高和粒度越小时,膳食纤维的网状结构接触的几率就越大,对葡萄糖的束缚力就会增强,但是当粒度减小到一定程度时会影响分子间的作用力,形成氢键,使超微型大豆皮水不溶性膳食纤维形成网状结构吸附葡萄糖的能力减弱[27],这种特性有利于控制饭后的血糖水平。
2.2.5 对重金属的吸附作用
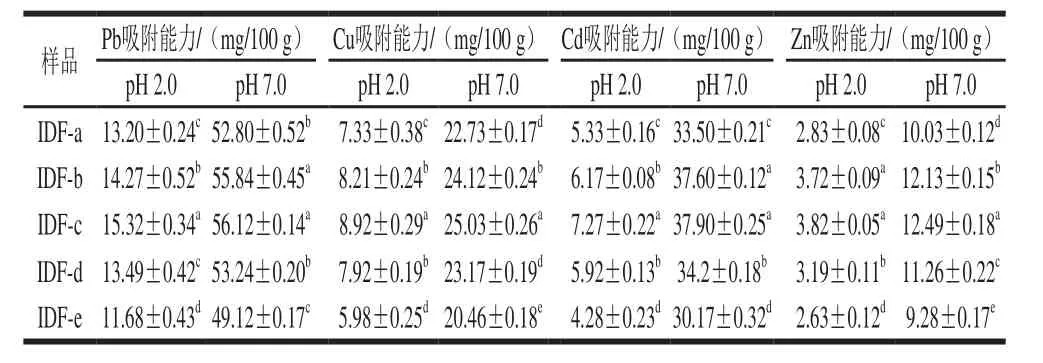
表3 超微型大豆皮水不溶性膳食纤维对重金属吸附作用Table3 Adsorption capacity for heavy metals of ultramicro insoluble dietary fiber from soybean hull
由表3可知,吸附能力随粒径的增大呈现先增大后减小的趋势;pH值为7.0时明显高于pH值为2.0时的吸附能力;相同条件下吸附能力为:Pb>Cd>Cu>Zn。膳食纤维内含有羧基的糖醛酸、酚酸等吸附基团[12,28],当pH值升高时,相应基团上的羧基质子解离度增大,对重金属的吸附能力也相应增强,当解离度下降时,对重金属的吸附能力也相应减弱,所以pH值为7.0时明显高于pH值为
2.0 时的吸附能力。超微粉碎后的粒度不同对吸附能力也有较大影响,粒度变小,比表面积增大时会使暴露更多的吸附基团增大其吸附重金属的能力[29];但是当粉碎超过一定程度时,会造成膳食纤维的吸附基团的断裂,也破坏膳食纤维相应的空间结构造成其吸附能力相应的下降。
2.3 超微型大豆皮水不溶性膳食纤维的电镜扫描分析
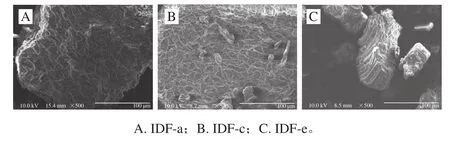
图7 超微型大豆皮水不溶性膳食纤维扫描电子显微镜图Fig.7 Scanning electron microscopic images of ultramicro insoluble dietary fi ber from soybean hull
由图7可知,IDF-a为网格状结构,表面有清晰的网格;IDF-c也为网格状结构,但是与IDF-a相比,组成网格的纤维较细,比表面积增大,基团更易暴露,网状结构更丰富,因此IDF-c的各吸附指标较IDF-a均有所提高;而IDF-e的网格状结构依旧保留,但呈碎块化,体积明显变小,比表面积更大,亲水亲油基团暴露更明显,毛细管作用也更加明显,对油脂和胆固醇的吸附能力继续提高,但网状结构变弱,对胆酸钠、葡萄糖、重金属的网状吸附作用减弱,吸附能力降低[25]。较低功率的气流粉碎并不能破坏膳食纤维的基本组织结构,但是会使组成网格的纤维结构变细,当功率超过一定程度时,膳食纤维的网状结构被粉碎成束状结构。经超微粉碎改性后,膳食纤维的分子链被切断、粒度变小,比表面积增大,分子聚合度下降,微观结构和分子大小均发生明显改变,证明气流超微粉碎技术具有明显的改性作用[30]。而膳食纤维微观结构与其理化功能特性密切相关,这也和之前的实验结果相吻合。
3 结 论
大豆皮水不溶性膳食纤维经超微粉碎后得到5 种超微型大豆皮水不溶性膳食纤维,即IDF-a、IDF-b、IDF-c、IDF-d、IDF-e,其D50分别为58.18、51.54、38.22、23.57、13.78 µm,IDF-e的体积平均粒径达到16.24 µm时,比表面积最大约为165.95 m2/kg;IDF-a、IDF-b、IDF-c、IDF-d、IDF-e的白度分别是48.5%、51.1%、54.8%、59.2%、63.7%;IDF-e的持水力和持油力最高分别为2.31、5.27 g/g,分别比IDF-a提高了1.07、2.53 g/g;黏度和阳离子交换能也均有显著性改变。
超微型大豆皮水不溶性膳食纤维对猪油和花生油的吸附能力在体积平均粒径为28.27 µm时吸附作用分别为6.53、3.16 g/g,较61.21 µm的膳食纤维分别提高了1.92、2.36 g/g;对胆固醇的吸附能力受粒度和pH值的影响较大;对胆酸盐及葡萄糖吸附能力受粒径和质量浓度的影响;对重金属的吸附能力的大小为:Pb>Cd>Cu>Zn,在中性环境和粒径为40.17 µm时吸附能力较好;在体积平均粒径为28.27 µm和40.17 µm时,超微型大豆皮水不溶性膳食纤维的吸附功能特性都较为理想。超微粉碎改性法对大豆皮水不溶性膳食纤维的理化及吸附功能特性有很明显的改良作用。
[1] YANG J K, CHOI M S, KIM C J, et al. Physiological function of insoluble dietary fiber prepared from exploded oak wood (Quercus mongolica)[J]. American Journal of Chinese Medicine, 2006, 34(1):87-97. DOI:10.1142/S0192415X06003667.
[2] 许晖, 孙兰萍, 张斌. 酶解法制备米糠膳食纤维[J]. 中国粮油学报,2007, 22(4): 117-120. DOI:10.3321/j.issn:1003-0174.2007.04.027.
[3] 李伦, 张晖, 王兴国, 等. 超微粉碎对脱脂米糠膳食纤维理化特性及组成成分的影响[J]. 中国油脂, 2009, 34(2): 56-59. DOI:10.3321/j.issn:1003-7969.2009.02.016.
[4] 王建中. 膳食纤维对肾功能、炎症和死亡风险的作用[J]. 中华肾病研究电子杂志, 2014(5): 37.
[5] NOORI N, NAFAR M, POORREZAGHOLI F, et al. Dietary intakes of fi ber and magnesium and incidence of metabolic syndrome in fi rst year after renal transplantation[J]. Journal of Renal Nutrition, 2010,20(2): 101-111. DOI:10.1053/j.jrn.2009.06.001.
[6] RENTERIA-FLORES J A, JOHNSTON L J, SHURSON G C, et al.Effect of soluble and insoluble fi ber on energy digestibility, nitrogen retention, and fiber digestibility of diets fed to gestating sows[J].Journal of Animal Science, 2008, 86(10): 2568-2675. DOI:10.2527/jas.2007-0375.
[7] 戴永利, 武海宁. 膳食营养素对非酒精性脂肪肝发生发展的影响[J].中国保健营养, 2016(2): 131.
[8] YIN R X, LIN W X, YANG H J, et al. Diet, lifestyle, and blood pressure of the middle-aged and elderly in the Guangxi Bai Ku Yao and Han populations[J]. American Journal of Hypertension, 2008,21(4): 382-387.
[9] BRAGADO M J, GARCÍA L J, LÓPEZ M A, et al. Protective effect of long term high fiber diet consumption on rat exocrine pancreatic function after chronic ethanol intake[J]. Journal of Nutrition Biochemistry, 2001, 12(6): 338-345. DOI:10.1016/S0955-2863(01)00147-4.
[10] 肖安红, 陆世广. 超细大豆皮膳食纤维对糖尿病模型小鼠糖耐量的影响[J]. 食品科学, 2010, 31(21): 329-331.
[11] 苏珏. 大豆渣、大豆皮膳食纤维对TFA致高脂血症小鼠血脂及抗氧化能力的影响[D]. 武汉: 武汉工业学院, 2012: 1-68.
[12] KACHENPUKDEE N, SANTERRE C R, FERRUZZI M G, et al.Modif i ed dietary fi ber from cassava pulp and assessment of mercury bioaccessibility and intestinal uptake using an in vitro, digestion/Caco-2 model system[J]. Journal of Food Science, 2016, 81(7): 1854-1863.
[13] GONG R M, LIU L L, FENG M, et al. Soybean hull functionalized by phosphoric acid for sorption of copper from aqueous solution[J].Korean Journal of Chemical Engineering, 2009, 26(2): 462-467.DOI:10.1007/s11814-009-0079-9.
[14] 汪勇, 欧仕益, 张宁, 等. 大豆皮酶法水解的研究[J]. 中国油脂, 2003,28(5): 59-61. DOI:10.3321/j.issn:1003-7969.2003.05.021.
[15] 田成, 莫开菊, 汪兴平. 水不溶性豆渣膳食纤维改性的工艺优化[J].食品科学, 2010, 31(14): 148-152.
[16] 刘佳, 金思岑, 张颖, 等. 微粉化技术在名贵中药中的应用[J]. 中国药房, 2014, 25(23): 2192-2194. DOI:10.6039/j.issn.1001-0408.2014.23.30.
[17] 陆世广. 超细大豆皮膳食纤维性质的研究[D]. 武汉: 武汉工业学院,2008: 1-72.
[18] HU G H, HUANG S H, CHEN H, et al. Binding of four heavy metals to hemicelluloses from rice bran[J]. Food Research International,2010, 43(1): 203-206.
[19] 黄素雅, 何亚雯, 钱炳俊, 等. 高静压和高压均质对豆渣水不溶膳食纤维的改性及其功能的影响[J]. 食品科学, 2015, 36(15): 81-85.DOI:10.7506/spkx1002-6630-201515016.
[20] 刘恩岐, 张建萍, 唐仕荣, 等. 酶法制备大豆皮微晶纤维素及其理化特性[J]. 食品科学, 2012, 33(24): 122-126. DOI:10.7506/spkx1002-6630-201224025.
[21] 刘玉梅. 胡柚皮膳食纤维的提取及理化性质的研究[D]. 长沙: 中南林业科技大学, 2013: 8-9.
[22] GÓRECKA D, LAMPART-SZCZAPA E, JANITZ W, et al.Composition of fractional and functional properties of dietary fiber of lupines (L. luteus and L. albus)[J]. Molecular Nutrition & Food Research, 2000, 44(4): 229-232.
[23] 吴占威, 胡志和, 邬雄志. 豆渣膳食纤维及豆渣超微化制品对小鼠肠道菌群的影响[J]. 食品科学, 2013, 34(3): 271-275.
[24] LIU W, FU Y J, ZU Y G, et al. Supercritical carbon dioxide extraction of seed oil from Opuntia dillenii Haw. and its antioxidant activity[J]. Food Chemistry, 2009, 114(1): 334-339. DOI:10.1016/j.foodchem.2008.09.049.
[25] 梅新, 木泰华, 陈学玲, 等. 超微粉碎对甘薯膳食纤维成分及物化特性影响[J]. 中国粮油学报, 2014, 29(2): 76-81.
[26] 桂余. 不同粒度甘薯渣纤维素生理功能性质的研究[D]. 重庆: 西南大学, 2014: 1-61.
[27] 赵健, 郑刚, 赵国华. 超高压处理对红薯渣膳食纤维理化性质的影响[J]. 食品科学, 2009, 30(17): 109-112. DOI:10.3321/j.issn:1002-6630.2009.17.025.
[28] 阮传英. 动态高压微射流技术对豆渣膳食纤维吸附重金属能力的影响[D]. 南昌: 南昌大学, 2014: 1-68.
[29] 黄晟, 朱科学, 钱海峰, 等. 超微及冷冻粉碎对麦麸膳食纤维理化性质的影响[J]. 食品科学, 2009, 30(15): 40-44. DOI:10.3321/j.issn:1002-6630.2009.15.008.
[30] 蓝海军, 刘成梅, 涂宗财, 等. 大豆膳食纤维的湿法超微粉碎与干法超微粉碎比较研究[J]. 食品科学, 2007, 28(6): 171-174.DOI:10.3321/j.issn:1002-6630.2007.06.038.
